Hormony steroidowe do których należy progesteron odgrywają istotną rolę w kontroli wielu funkcji ośrodkowego i obwodowego układu nerwowego. Przez długi okres czasu możliwość oddziaływania hormonów steroidowych na układ nerwowy była przypisywana wyłącznie hormonom wydzielanym przez obwodowe gruczoły dokrewne, które jako związki lipofilne łatwo mogą przechodzić przez barierę krew – mózg. W ostatnich 20 latach ubiegłego stulecia zwrócono uwagę na możliwość biosyntezy hormonów steroidowych w innych narządach niż gonady i nadnercza (1, 2), podkreślając rolę ośrodkowego i obwodowego układu nerwowego, a zwłaszcza mózgu jako narządu, w którym występuje ekspresja enzymów odpowiedzialnych za biosyntezę progesteronu, oraz innych steroidów mózgowych (2-5). Wykazano, że hormony steroidowe mogą być syntetyzowane w strukturach układu nerwowego w sposób niezależny od wydzielania obwodowego (6, 7). Steroidy syntetyzowane w układzie nerwowym de novo z cholesterolu oraz z prekursorów hormonów steroidowych nazwano neurosteroidami (2, 4). Do głównych neurosteroidów syntetyzowanych w mózgu zalicza się: pregnenolon, siarczan pregnenolonu, progesteron, 5 α dwuhydroprogesteron, 3 α 5 α tetrahydroprogesteron, (allopregnanolon), dehydroepiandrosteron (DHEA), siarczan dehydroepiandrosteronu (2, 4).
Początek badań nad neurosteroidami wiąże się z pracami doświadczalnymi w których wykazano, że stężenia pregnenolonu, dehydroepiandrosteronu i ich pochodnych siarczanowych w tkance mózgowej szczura nie ulegały zmianie po adrenalektomii i kastracji, podczas gdy stężenia testosteronu i kortykosteronu obniżały się do wartości nieoznaczalnych (8). W kolejnych pracach wykazano, że synteza progesteronu w układzie nerwowym przebiega niezależnie od syntezy w gruczołach dokrewnych, ponieważ stężenia progesteronu w tkance mózgowej samic i samców szczura również nie ulegały zmianie po adrenalektomii i kastracji (9). W doświadczeniach przeprowadzonych w hodowli komórek gleju szczura wykazano, że progesteron jest syntetyzowany z mewalonianu poprzez wstępną syntezę cholesterolu i pregnenolonu (10, 11). Tak więc udowodniono, że progesteron jest nie tylko hormonem steroidowym wydzielanym do krwi przez jajniki, łożysko, nadnercza i prekursorem w syntezie innych hormonów steroidowych, ale również neurosteroidem wydzielanym miejscowo w strukturach układu nerwowego, którego synteza nie odbiega od klasycznego schematu syntezy hormonów steroidowych w innych tkankach (4, 5).
Synteza progesteronu w ośrodkowym układzie nerwowym odbywa się w komórkach neurogleju – astrocytach i oligodendrocytach oraz w neuronach (5). W obwodowym układzie nerwowym w komórkach neurogleju – neurolemocytach (komórki Schwanna) (12), oraz w neuronach czuciowych (13).
Kolejne etapy syntezy progesteronu zostały przedstawione na rycinie 1. Konwersja cholesterolu do pregnenolonu jest etapem kluczowym i wspólnym dla syntezy wszystkich hormonów steroidowych. Polega ona na odszczepieniu bocznego łańcucha cholesterolu i powstaniu pregnenolonu. Reakcja ta przebiega pod wpływem katalitycznego działania kompleksu enzymatycznego złożonego z cytochromu P-450scc, adrenodoksyny i reduktazy adrenodoksyny (CYP 11A) zlokalizowanego na wewnętrznej błonie mitochondrialnej. Inhibitorem tej reakcji jest aminoglutetymid. Kolejny etap – konwersja pregnenolonu do progesteronu przebiega pod wpływem działania enzymu dehydrogenazy hydroksysteroidowej /Δ4-5 izomerazy (3 β-HSD), którego inhibitorem jest trilostan. Wykazano aktywności kluczowych enzymów w syntezie progesteronu – P450scc i 3 β-HSD we wszystkich tkankach gruczołowych, w których występuje synteza progesteronu (14). Wykazano aktywność enzymu P450scc w substancji białej mózgowia szczura (1) i w mitochondriach oligodendrocytów (15), oraz ekspresję enzymu P450 w astrocytach (3, 16) i w komórkach gleju (10). Czynnikiem limitującym przebieg biosyntezy progesteronu jest szybkość przechodzenia cholesterolu w przestrzeni od zewnętrznej do wewnętrznej błony mitochondrialnej (14). Wykazano, że transport cholesterolu w przestrzeni między błonami mitochondrialnymi jest regulowany przez białko StAR (białko regulujące steroidogenezę o natychmiastowym działaniu) (14), oraz białko tzw. obwodowy receptor benzodiazepinowy (PBR) (17).
Ryc. 1. Biosynteza progesteronu.
Konwersja cholesterolu do pregnenolonu w gruczołach dokrewnych jest pobudzana przez hormony tropowe: ACTH w nadnerczach, LH w gonadach poprzez stymulację cAMP (18), natomiast w układzie nerwowym czynniki tropowe pobudzające steroidogenezę nie są w pełni poznane (19). Wydaje się, że mogą to być czynniki o działaniu autokrynnym związane z lokalnym metabolizmem tkankowym (20).
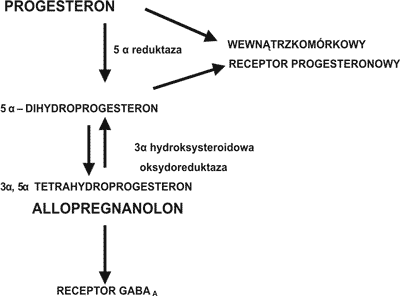
Stosując technikę RT-PCR stwierdzono w komórkach kory mózgowej szczura ekspresję genów dla kluczowych enzymów w biosyntezie następujących steroidów: w astrocytach dla pregnenolonu, DHEA, progesteronu, androstendionu, testosteronu, estronu i estradiolu; w oligodendrocytach dla – pregnenolonu i progesteronu; w neuronach – dla pregnenolonu, progesteronu, androstendionu, estronu i estradiolu (5). W astrocytach głównie syntetyzowany jest progesteron, DHEA, androstendion i testosteron, w oligodendrocytach – progesteron, w neuronach – estradiol (5). Dominującą rolę w syntezie neurosteroidów mózgowych odgrywają astrocyty z których do oligodendrocytów może przechodzić progesteron a do neuronów testosteron, który następnie przekształcany jest do estradiolu (5). Uważa się również, że pregnenolon może przechodzić z oligodendrocytów do astrocytów. Metabolizm progesteronu w układzie nerwowym przedstawiono na rycinie 2. Progesteron – pochodzący z obwodu i syntetyzowany w układzie nerwowym pod wpływem działania enzymu 5 α reduktazy jest przekształcany do 5 α dwuhydroprogesteronu. W organizmach ssaków jest to reakcja nieodwracalna (21). Następnie 5 α dwuhydroprogesteron może być przekształcany odwracalnie po wpływem działania enzymu 3 α hydroksysteroidowej oksydoreduktazy do 3 α, 5 α tetrahydroksyprogesteronu (allopregnanolonu).
Ryc. 2. Metabolizm progesteronu
Ostatnia reakcja może przebiegać w kierunku redukcji jak i utleniania w zależności od obecności odpowiednich kofaktorów w środowisku (22). Wykazano, że enzymy – 5 α reduktaza i 3 α hydroksysteroidowa oksydoreduktaza występują w różnych izoformach, w zależności od ich lokalizacji (23).
Progesteron reguluje szereg czynności układu nerwowego poprzez działanie genomowe i niegenomowe, to ostatnie poprzez allosteryczną interakcję z błonowymi receptorami neuroprzekaźników (24). Działanie genomowe progesteronu polega na wiązaniu do cytoplazmatycznym receptorem progesteronowym, który po aktywacji jako czynnik transkrypcyjny wiąże się z odpowiednimi sekwencjami DNA i reguluje transkrypcję genową. Jest to mechanizm poprzez który hormony steroidowe w tym i progesteron mogą wpływać na działanie neuroprzekaźników poprzez wpływ na ich syntezę, metabolizm i gęstość receptorów (24). Wykazano, że działanie genomowe mogą wywierać również pochodne progesteronu – 5 α dwuhydroprogesteron i allopregnanolon, po utlenieniu do 5 α dwuhydroprogesteronu (25). Wykazano, że 5 α dwuhydroprogesteron podobnie jak progesteron wiąże się do receptorów progesteronowych i indukuje transkrypcję genową. Progesteron jako modulator allosteryczny odziaływuje antagonistycznie wywierając efekt hamujący na błonowe receptory glicynowe, nikotynowe i oksytocynowe (2) i receptory sigma-1 (26). Progesteron oddziaływuje również pośrednio pobudzająco poprzez wpływ agonistyczny swego metabolitu allopregnanolonu na receptor GABA A (2). Receptor GABA A zbudowany jest z jednostek tworzących ściany kanału chlorkowego i zawiera miejsca wiążące kwas γ-aminomasłowy (GABA), benzodiazepiny, barbiturany,pikrotoksynę i prawdopodobnie miejsce wiążące neurosteroidy, które do tej pory nie zostało opisane (27, 28). Allopregnanolon i inne neurosteroidy hamujące poprzez modulację allosteryczną receptora GABA A w stężeniach nanomolowych nasilają napływ jonów chlorkowych do wnętrza komórki prowadząc do hiperpolaryzacji i zmniejszenia przewodnictwa neuronalnego. Stwierdzono, że neurosteroidy w wysokich stężeniach (mikromolarnych) same otwierają kanał chlorkowy (29).
1. Le Goascogne C, et al.: Neurosteroids: cytochrome P450scc in rat brain. Science 1987; 237: 1212-1215.
2. .Robel P, Balieu EE: Neurosteroids. Biosynthesis and function Trends. Endocrinol. Metab., 1994; 5: 1-8.
3. Mellon SH: Neurosteroids: biochemistry, modes of action and clinical relevance. J. Clin. Endocrinol. Metab., 1994; 78: 1003-1008.
4. Balieu EE: Neurosteroids: Of the nervous system, by the nervous system, for the nervous system. Rec. Prog. Horm. Res., 1997; 52: 1-32.
5. Zwain IH, Yen SS: Neurosteroidogenesis in astrocytes, oligodendrocytes and neurons of cerebral cortex of rat brain. Endocrinology 1999; 140: 3843-52.
6. Akwa Y, et al.: Neurosteroid metabolism, 7 alpha-hydroxylation of dehydroepiandrosterone and pregnenolone by rat microsomes. Biochem. J., 1992; 288, 959-964.
7. Balieu EE: Neurosteroids: a new function in the brain. Biol. Cell., 1991;71: 963-987.
8. Coperchot C, et al.: Characterization and measurement of dehydroepiandrosterone sulfate in rat brain. Proc. Natl. Acad. Sci. USA, 1981; 78: 4704-4707.
9. Coperchot C, et al.: Pregnenolone and its sulfate ester in the rat brain. Brain Res., 1983; 270: 119.
10. Jung-Testas J, et al.: Neurosteroids: biosynthesis of pregnenolone and progesterone in primary cultures of rat glial cells. Endocrinology 1989; 125: 2083-2091.
11. Jung-Testas I, et al.: Progesterone as a neurosteroid: synthesis and actions in rat glial cells. J. Steroid. Biochem. Mol. Biol., 1999; 69: 97-107.
12. Akwa Y, et al.: Neurosteroids in rat sciatic nerves and Schwann cells. CR Acad. Sci., 1993; 316: 410-414.
13. Guennoun R, et al.: Neurosteroids:expretion of functional 3β-hydroksysteroid dehydrogenase by rat sensory neurons and Schwann cells. Eur. J. Neurosci., 1997; 9: 2236-2247.
14. Stocco DM, Clark BJ: Regulation of the acute production of steroids in steroidogenic cells. Endocrine Rev., 1966; 17: 221-244.
15. Mellon SH, et al.: Neurosteroid biosynthesis: genes for adrenal steroirogenic enzymes are expressed in the brain. Brain Res., 1993; 629: 283-270.
16. Zongh YH, et al.: Neurosteroids: Oligodendrocyte mitochondria convert cholesterol to pregnenolone. Proc. Natl. Acad. Sci., 1987; 84: 8215-8219.
17. Papadopoulos V, et al.: Translocator protein (18 kDa): new nomenclature for peripheral-type benzodiazepine receptor based on its structure and molecular function. Trends. Pharmacol. Sci., 2006; 27: 402-409.
18. Zhang P, et al.: Transciptional regulation of P450scc gene expression in neural and steroidogenic cells: implications for regulation of neurosteroidogenesis. Mol. Endocr., 1995; 9: 1571-1582.
19. Compagnone N, et al.: Expression of the steroidogenic enzyme P450scc in the central and peripheral nervous system during rodent embryogenesis. Endocrinology 1995; 136: 2689-2696.
20. Akwa Y, et al.: Astrocytes and neurosteroids:metabolism of pregnenolone and dehydroepiandrosterone. Regulation by cell density. J. Cell. Biol., 1993; 121:135-143.
21. Celotti F, et al.: The 5 α-reductase in the brain: molecular aspects and relation to brain function. Front. Neuroendocrinol., 1992; 13: 163-215.
22. Rupprecht R, et al.: Progesterone receptor – mediated effects of neuroactive steroids. Neuron., 1993; 11: 523-530.
23. Compagnone NA, Mellon SH: Neurosteroids: biosynthesis and function of these novel neuromodulators. Front. Neuroendocrinol., 2000; 21: 1-56.
24. Fink G: Molecular principles from neuroendocrine models: steroid control of central neurotransmission. Prog. Brain Res., 1994; 100: 139-147.
25. Rupprecht R: The neuropsychopharmacolpgical potenmtial of neuroactive steroids. J. Psychiatr. Res., 1997; 31: 297-314.
26. Maurice T, et al.: Neuroactive neurosteroids as endogenous effectors for the sigma 1(sigma 1) receptor: pharmacological evidence and therapeutic opportunities. Jpn. J. Pharmacol., 1999; 81: 125-155.
27. Gee KW, et al.: Steroid modulation of the chloride ionophore in the rat brain: structure-activity requirements, regional dependence and mechanism of action. J. Pharmacol. Exp. Ther., 1988; 246: 803-812.
28. Tuner DM, et al.: Steroid anaesthetic a nd naturally occurring analogs modulate the γ-aminobutyric acid receptor complex at a site distinct from barbiturates. J. Pharmacol. Exp. Ther., 1989; 248: 960.
29. Majewska MD, et al.: Steroid hormone metabolites are barbiture-like modulators of the GABA receptor. Science (Wash DC) 1086; 232: 1004-1007.
30. Atkinson RM, et al.: Action of some steroids on the central nervous system of the mouse. J. Med. Chem., 1965; 8: 426.
31. Seyle H: The antagonism between anaesthetic steroid hormones and pentamethylenetetrazol (metrazol). J. Lab. Clin. Med., 1942; 27: 1051.
32. Fink G: Estrogen and progesterone interactions in the control of gonadotrophins and prolactin secretion. J. Steroid. Biochem., 1988; 30: 169-178.
33. Lasoń W: Endogenne substancje neuroprotekcyjne o budowie steroidowej. Neuroprotekcja. XX Zimowa Szkoła Instytutu Farmakologii PAN. Mogilany 2003. pod. Red. Marii Śmiałkowskiej. str. 187-195.
34. Basta-Kaim A, et al.: Przegląd Lekarski. 2005; 62: 1287-1292.
35. Schumacher M, et al.: Novel perspectives for progesterone In hormone replacement therapy, with special reference to the nervous system. Endocrine Rev., 2007; 28: 387-439.
36. Hoffman SW, et al.: Bilateral frontal cortical contusion in rat: behavioral and anatomic consequences. J. Neurotrauma., 1994; 11: 417-431.
37. Stein DG: Brain damage, srex hormones and recovery: a new role for progesterone and estrogen? Trends Neurosci 2001; 24: 386-391.
38. Gonzales-Vidal MD, et al.: Progesteronne: protective effects on the cat hippocampal neuronal damage due to acute global cerebral ischemia. Arch. Med. Res., 1998; 29: 117-124.
39. Cervantes M, et al.: Neuroprotective effects of progesterone on damage elicited by acute global cerebral ischemia in neurons of caudate nucleus., 2002; 33: 6-14.
40. Jiang N, et al.: Progesterone is neuroprotective after transient middle cerebral artyery occlusion in male rats. Brain Res., 1996; 735: 101-107.
41. Kumon Y, et al.: Neuroprotective effect of postischemic administration of progesterone in spontaneously hypertensive rats with focal cerebral ischemia. J. Neurosurg., 2000; 92: 848-852.
42. Thomas AJ, et al.: Progesterone is neuroprotective after acute experimental spinal cord trauma in rats. Spine., 1999; 24: 2134-2138.
43. Labombarda F, et al.: Cellular basis for progesterone neuroprotection in the injured spinal cord. J. Neurotrauma 2002; 19: 343-355.
44. Gonzalez SL, et al.: Progesterone up-regulates neuronal brain-derived neurotrophic factor expression in the injured spinal cord. Neuroscience., 2004; 125: 605-614.
45. Wright DW, et al.: Steady-state serum concentrations of progesterone following continuous intravenous infusion in patients with acute moderate tosevere traumatic brain injury. J. Clin. Pharmacol., 2004; 45: 640-648.
46. Robertson CL, et al.: Physiologic progesterone reduces mitochondrial dysfunction and hippocampal cell loss after traumatic brain injury in female rats. Exp. Neurol., 2006; 197: 235-243.
47. Guo Q, et al.: Progesterone administration modulates AQQP4 expression and edema after traumatic brain injury in male rats. Exp. Neurol., 2006; 198: 469-478.
48. Yu WH: Survival of motor neurons following axotomy is enhanced by lactation or by progesterone treatment. Brain Res., 1989; 491: 379-382.
49. Nilsen J, et al.: Divergent impact of progesterone and medroxyprogesterone acetate (Provera) on nuclear mitogen-activated protein kinase signaling. Proc. Natl. Acad, Sci USA, 2003; 100: 10506-10511.
50. Yao XL, et al.: Progesterone differentially regulates pro- and anti-apoptotic gene expression in cerebral cortex following traumatic brain injury in rats. J. Neurotrauma. 2005; 22: 656-668.
51. Koenig HL, et al.: Progesterone synthesis and myelin formation by Schwann cells. Science., 1995; 268: 1500-1503.
52. Desarnaud F, et al.: Progesterone stimulates the activity of the promoters of peripheral myelin protein-22 and Po genes in Schwann cells. J. Neurochem., 1998; 71: 1765-1768.
53. Belelli D, Herd MB: The contraceptive agent Provera enhances GABA(A) receptor-mediated inhibitory neurotransmission in the rat hippocampus: evidence for endogenous neurosteroids? J. Neurosci., 2003; 23: 10013-10020.
54. Bernardi F, et al.: Progesterone and medroxyprogesterone acetate effects on central and perripharal allopregnanolone and β-endorphin levels. Neuroendocrinology., 2006; 83: 348-359.
55. Newmark ME, Penry JK: Catamenial epilepsy: a review. Epilepssia., 1980; 21: 281-300.
56. Bjorn I, et al.: Negative mood changes during hormone replacement therapy: a comparison between two progestogens. Am. J. Obstet. Gynecol., 2000; 183: 1419-1426.
57. Cagnacci A, et al.: A comparison of the central effects of different progestins used in hormone replacedment therapy. Maturitas., 2004; 48: 456-462.
58. Nilsen J, Brinton RD: Impact of progestins on estrogen-induced neuroprotection: synergy by progesterone and 19-norprogesterone and antagonism by medroxyprogesterone acetate. Endocrinology., 2002; 143: 205-212.
59. Nilsen J, Brinton RD: Divergent impact of progesterone and medroxyprogesterone acetate (Provera) on nuclear mitogen-activated protein kinase signaling. Proc. Natl. Acad. Sci USA, 2003; 100: 10506-10511.
60. Nilsen J, et al.: Medroxyprogesterone ac etate exacerbates glutamate excitotoxicity. GYnecol. Endocrinol., 2006; 22: 355-361.
61. Lee TC, et al.: Medroxyprogesterone acetate and dexamethasone are competitive inhibitors of different human steroidogenic enzymes. J. Clin. Endocrinol. Metab., 1999; 84: 2104-2110.
62. Thomas T, et al.: Progestins initiate adverse events of menopausal estrogen therapy. Climacteric. 2003; 6: 293-301.
63. Effects of estrogen or estrogen/progestin rtegiments on heart disease risk factors in postmenopausal women. The Postmenopausall Estrogen/Progestin Interventions (PEPI) Trial. The Group for the PEPI Trial. JAMA 1995; 273: 199-208.