© Borgis - Postępy Nauk Medycznych 3/2008, s. 198-202
*Jarosław Kozakowski, Wojciech Zgliczyński
Rola układu endokannabinoidowego w patogenezie otyłości
The role of the endocannabinoid system in the pathogenesis of obesity
Klinika Endokrynologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki Endokrynologii: prof. CMKP dr hab. med. Wojciech Zgliczyński
Streszczenie
Układ endokannabinoidowy obejmuje receptory CB1 i CB2 obecne w mózgu oraz w narządach obwodowych, ich naturalne ligandy (endokannabinoidy, EC), takie jak anandamina (AEA) i 2-arachidonyl-glycerol (2-AG) oraz enzymy związane z ich syntezą, wychwytem i degradacją. Uważa się, że fizjologiczną rolą EC jest ich udział w regulacji bilansu energetycznego. W wyniku działania centralnego i obwodowego związki te powodują wzrost łaknienia, wpływają na metabolizm węglowodanów i lipidów oraz zwiększają akumulację tłuszczów. Działanie pobudzające łaknienie związane jest z obecnością licznych receptorów CB1 w odpowiednich strukturach podwzgórza. EC wpływają na bilans energetyczny działając także w komórkach przewodu pokarmowego, w wątrobie, tkance tłuszczowej i w mięśniach szkieletowych. Związki te zwiększają przyswajanie pokarmów, pobudzają adipogenezę i zmniejszają wydatek energetyczny w mięśniach, sprzyjając rozwojowi otyłości. Poznanie tych mechanizmów stało się przesłanką dla prób zablokowania układu EC. Badanie przeprowadzone wśród ponad 6000 osób z otyłością lub nadwagą i innymi czynnikami ryzyka chorób układu krążenia wykazało, że po 12 miesiącach leczenia rimonabantem – selektywnym blokerem receptorów CB1 dochodzi do istotnego spadku ciężaru ciała i zmniejszenia obwodu talii, spadku insulinooporności, stężenia insuliny na czczo, wzrostu stężenia HDL cholesterolu i obniżenia stężenia triglicerydów. W grupie osób z otyłością i zaburzeniami lipdowymi wykazano dodatkowo spadek stężenia małych cząstek LDL, wzrost stężenia adiponektyny, redukcję stężenia leptyny i białka c-reaktywnego (CRP). Wyniki te stały się podstawą zarejestrowania rimonabantu jako leku do zwalczania otyłości. Wydaje się, że ze względu na wielokierunkowe działanie preparat może być bardzo przydatny w leczeniu zespołu metabolicznego.
Summary
The endocannabinoid system consist of the receptors CB1 and CB2 located in the brain and peripherial organs, their natural ligands (endocannabinoids, ECs): anandamine and 2-arachidonyl-glycerol, and the enzymatic machinery, necessary for their synthesis, re-uptake and degradation.
It is believed that EC system is involved in control of energy homeostasis. ECs activate brain areas involved in food intake, regulate glucose and lipid metabolism and cause lipids accumulation. ECs via CB1 and CB2 receptors increase food absorption, stimulate adipogenesis and decrease energy expenditure in skeletal muscles, thereby promote obesity. The discovery of EC system and of its impact on the regulation of energy metabolism have suggested that CB1 blockade may represent a viable treatment target for adiposity, and beneficial metabolism modulation. Data from the trials designed to asses the efficacy and safety of rimonabant – the first selective CB1 blocker in the treatment of over 6000 obese or overweighed subjects during 1 year have shown significant decrease in their body weight, waist circumference, improve in plasma glucose, insulin homeostasis and the lipoid profile (increase in serum HDL-cholesterol and decrease in triglycerides levels). Moreover, in subgroup of overweighed patients with atherogenic lipid profile decrease in serum LDL- cholesterol, leptin and c-reactive protein levels, and increase in adiponectin levels have been shown. Rimonabant therefore represents novel therapeutic approach for the treatment of obesity and metabolic abnormalities leading to diabetes and cardio-vascular disease.

Określenie kannabinoidy obejmuje grupę związków chemicznych, które działają na swoiste receptory w mózgu. Od pierwszej połowy XIX wieku substancje te były znane pod postacią alkaloidów roślinnych, obecnych np. w konopiach indyjskich czy południowoafrykańskiej dagga. W 1964 wyekstrahowano w czystej postaci Δ9- tetrahydrocannabinol (Δ9-THC) – główny komponent psychoaktywny, wywołujący stan zadowolenia i dobrego samopoczucia, zwiększający uczucie głodu i pobudzający apetyt, szczególnie na smaczne potrawy, np. słodycze, a także regulujący motorykę przewodu pokarmowego. Obecnie znanych jest ok. 60 związków należących do tej grupy, w tym także kannabinoidy pozbawione działania psychoaktywnego, np. cannabidiol.
Wyizolowanie THC było pierwszym krokiem na drodze do zidentyfikowania całego układu kannabinoidowego. Wpierw u szczurów (w 1988 roku), a następnie również u ludzi odkryto i zlokalizowano w mózgu wspomniane receptory kannabinoidowe typu 1 i 2 (CB1 i CB2) (1, 2). Poszukiwania ich naturalnych ligandów zaowocowały odkryciem grupy endokannabinoidów (EC): anandaminy (N-arachidonoyloetanolamidu, AEA, ryc. 1), a następnie 2-arachidonyl-glycerolu (2-AG) (3, 4).
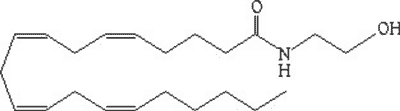
Ryc. 1. Struktura chemiczna N-arachidonoyloetanolamidu (AEA).
W ostatnim czasie przedmiotem badań stały się dwa kolejne związki: homo-γ-linolenyloetanolamid (homo-γ-LEA) i docosotetraenylethanolamide. Wszystkie te endogenne ligandy są bardzo nietrwałe i charakteryzują się bardzo krótkim okresem półtrwania. Powstają lokalnie, on demand tam, gdzie są aktualnie potrzebne. Są produktami metabolizmu fosfolipidów i są niezwłocznie uwalniane z komórek a następnie, po wywołaniu efektu wychwytywane zwrotnie i degradowane. Na cały układ kannabinoidowy składają się: 1/ receptory CB1 i CB2, 2/ endokannabinoidy oraz 3/ enzymy związane z ich syntezą, wychwytem ( re-uptake) i degradacją, takie jak: N-acylo-fosfatydylo-etanolamino-selektywna fosfolipaza D (NAPE-PLD), lipazy diacylglicerolu (DAGL α i β), hydrolaza amidów kwasów tłuszczowych (FAAH, odpowiada za metabolizowanie anandaminy) czy lipaza monoacylglicerolu (MAGL, uczestniczy w metabolizowaniu 2-AG). Do układu tego niektórzy zaliczają również 4/ domniemany transporter, umożliwiający internalizację tych związków do komórek i ich następową degradację (5). W ustroju zidentyfikowano także szereg związków o strukturze i działaniu przypominającym EC. Są one najczęściej pochodnymi endogennych wolnych kwasów tłuszczowych (FFA) i wykazują częściowe działanie, będące wynikiem niepełnego wiązania z receptorami CB1 i CB2. Ich rola polega prawdopodobnie na potencjalizowaniu działania właściwych endokannabinoidów, choć ich znaczenie fizjologiczne jest jeszcze mało poznane (6, 7).
Receptory CB1 i CB2 należą do grupy receptorów związanych z białkiem G. W 44% są homologiczne. Po przyłączeniu ligandu aktywują odpowiednie podjednostki białek G (i,0), czego efektem jest hamowanie cyklazy adenylowej, aktywowanie kinazy MAP ( mitogen-activated protein) i zależny od receptora specyficzny wpływ na jonowe kanały wapniowe oraz potasowe (8, 9). Receptory CB1 obecne są w dużej liczbie w mózgu (w podwzgórzu, nucleus accumbens, pniu), nerwowym układzie autonomicznym (n. X, zwoje nerwowe), w wątrobie, mięśniach szkieletowych, przewodzie pokarmowym (w komórkach nabłonka jelitowego), trzustce i w tkance tłuszczowej. Aktywacja receptorów zlokalizowanych w ośrodkowym układzie nerwowym (OUN) powoduje zahamowanie lub zwiększenie wydzielania neurotransmiterów. Mechanizm działania EC w mózgu polega na presynaptycznej supresji hamowania lub uwalniania neurotransmitera w następstwie postsynaptycznej depolaryzacji ( depolarization-induced suppression of inhibition/excitation, DSI/DSE) (10, 11). Fenomen ten odkryto przed 12 laty i dopiero w 2001 roku ustalono, że rolę wstecznego neurotransmitera odgrywają właśnie endokannabinoidy. Receptory CB2 w OUN znajdują się w niewielkiej liczbie, głównie w pniu mózgu, a ponadto zlokalizowane są w układzie immunologicznym (wpływają na syntezę i działanie cytokin), trzustce i kościach (12). Ostatnie badania wskazują, że pobudzenie receptorów CB2 może zmniejszać liczbę i wielkość blaszek miażdżycowych (13).
Uważa się, że fizjologiczną rolą EC jest ich udział w regulacji bilansu energetycznego. W wyniku działania zarówno centralnego jak i obwodowego związki te powodują wzrost łaknienia, wpływają na metabolizm węglowodanów i lipidów oraz akumulację tłuszczów (14). Działanie orexygenne (pobudzające łaknienie) endokannabinoidów związane jest z obecnością licznych receptorów CB1 w podwzgórzu. Zlokalizowane są one w okolicy jądra łukowatego (ARC), brzuszno medialnego (VMN), przykomorowego (PVN) i w okolicy bocznej podwzgórza a więc regionach, w których obecne są neurony produkujące neuromediatory odpowiedzialne za wzrost lub zmniejszenie apetytu, takie jak neuropeptyd Y (NPY), agouti-related protein (AGRP), melanocyte concentraining hormone (MCH) corticotropin releasing hormone (CRH) czy proopiomelanokortyna (POMC) (14, 15). Działanie neuromodulacyjne EC nie jest w pełni wyjaśnione. Postuluje się, że pod ich wpływem dochodzi m.in. do wzrostu ekspresji i produkcji NPY i hamowania ekspresji CRH. Wpływ endokannabinoidów na wydzielanie CRH ma miejsce w okolicy jądra przykomorowego. Wzrost stężenia glikokortykoidów w surowicy prowadzi do uwolnienia EC, a te działając na włókna presynaptyczne hamują uwalnianie CRH. Można więc uważać, że wzmożone łaknienie pod wpływem glikokortykoidów jest, przynajmniej po części, wynikiem działania EC (16). W okolicy jądra przykomorowego ma także miejsce integracja działania układu EC i ghreliny. Wykazano, że apetyt nie wzrasta po podaniu ghreliny w sytuacji, gdy zablokowane są receptory CB1. Można więc zakładać, że wzrost łaknienia pod wpływem ghreliny przynajmniej w części jest związany z indukowaniem układu EC w podwzgórzu (17). Istnieje także zależność między aktywnością układu EC a wydzielaniem leptyny. Stwierdzono, że leptyna obniża stężenie endokannabinoidów w podwzgórzu szczura, a z drugiej strony szczególnie wysokie stężenie EC wykazano u myszy ob/ob, a więc zwierząt z genetycznie uwarunkowanym brakiem leptyny (18). Z kolei dodanie leptyny do hodowli in vitro limfocytów ludzkich powoduje zahamowanie układu EC. Niedawno opublikowane prace wykazały istnienie ujemnej korelacji między stężeniem leptyny i aktywnością endokannabinoidów u kobiet z prawidłowym ciężarem ciała i z anoreksją (19).
Istnieje także synergizm w działaniu ligandów receptorów CB1 i MCR4. Zastosowanie blokera CB1 hamuje chęć spożywania posiłku wywołany przez antagonistów MCR4. Ważną rolę w regulacji łaknienia wywiera układ limbiczny, który uczestniczy w przekazywaniu informacji o składzie i ilości spożytego pokarmu. Stwierdzono czynnościowe połączenie między układem EC i dopaminergicznym w tym obszarze mózgu, oraz wykazano, że antagoniści receptora D1 zmniejszają orexygenne działanie THC. Endokannabinoidy działają też synergistycznie z opioidami. Do współdziałania obu układów, w zakresie zwiększania łaknienia dochodzi prawdopodobnie również w okolicy jądra przykomorowego w podwzgórzu. Mniej poznana jest interakcja między układem EC a systemem serotoninergicznym.
Endokannabinoidy wpływają na bilans energetyczny także w efekcie działania obwodowego. Ich receptory obecne są w komórkach przewodu pokarmowego. EC współdziałają tu z innymi systemami (cholecystokininy, opioidowym) w zakresie regulacji wchłaniania pokarmów (20, 21). Oprócz tego wykazano, że agoniści receptora CB1 hamują wydzielanie soku żołądkowego indukowane pentagastryną, czy histaminą (THC) (22). Przeciwne działanie mają antagoniści. THC hamuje ponadto opróżnianie żołądka, co udowodniono u gryzoni i u ludzi. Endokannabinoidy hamują również aktywność motoryczną jelit, zwalniając ich ruchy perystaltyczne (23). W niedrożności porażennej stwierdzono podwyższone stężenie AEA oraz zwiększoną ekspresję receptorów CB1. Efektem działania EC jest także wzrost napięcia dolnego zwieracza przełyku.
W wyniku zwiększenia aktywności lipazy lipoproteinowej w tkance tłuszczowej pod wpływem endokannabinoidów dochodzi do wzmożonej adipogenezy (14). Wykazano, że zastosowanie blokera receptora CB1 (rimonabantu) hamuje proces tworzenia się tkanki tłuszczowej, a ponadto prowadzi do uwalniania adiponektyny – adipokininy o właściwościach przeciwmiażdżycowych i antydiabetogennych. Wzmożona lipogeneza i zmniejszona beta-oksydacja tłuszczów są wynikiem zahamowania aktywności kinazy aktywowanej AMP pod wpływem endokannabinoidów. Jak wynika z badań przeprowadzonych u myszy, po zastosowaniu rimonabantu dochodzi do nasilenia lipolizy w następstwie przyspieszenia procesów beta-oksydacji i cyklu kwasów trójwodorowęglowych oraz do poprawy metabolizmu glukozy w wyniku zwiększenia aktywności transportera Glut4.
Receptory CB1 obecne są w mięśniach szkieletowych. Ich blokada u myszy ob/ob (z genetycznie uwarunkowaną otyłością w następstwie braku leptyny) skutkuje zwiększonym wychwytem glukozy i poprawą metabolizmu węglowodanów (24). Wzmożenie termogenezy, być może w wyniku pobudzenia układu adrenergicznego lub nasilenia oksydacji wolnych kwasów tłuszczowych przyczynia się do zwiększenia wydatku energetycznego (24, 25).
Pobudzenie receptorów EC w wątrobie nasila aktywność enzymów lipogenezy. Dieta wysokotłuszczowa u myszy powoduje wzrost stężenia AEA, up-regulation receptorów CB1 w wątrobie i w efekcie stłuszczenie tego narządu (26). Wątroba myszy z genetycznie uwarunkowanym brakiem receptora CB1 (CB1 -/-) jest niepodatna na stłuszczenie.
Część wewnątrzwydzielnicza trzustki posiada zarówno receptory CB1 (komórki α) jak i CB2 (komórki α i β). Aktywacja receptorów CB1 prowadzi do pogorszenia tolerancji glukozy, prawdopodobnie w następstwie zmniejszenia wydzielania insuliny stymulowanego glukozą (27, 28).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Devane WA, et al.: Determination and characterization of a cannabinoid receptor in rat brain. Mol. Pharmacol., 1988; 34: 605-13.
2. Herkenham M, et al.: Cannabinoid receptor localization in brain. Proc. Natl. Acad. Sci., 1990; 87: 1932-1936.
3. Devane WA, et al.: Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 1992; 258: 1946-1949.
4. Mechoulam R, et al.: Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors. Biochem. Pharmacol., 1995; 50: 83-90.
5. Kogan NM, Mechoulam R: The chemistry of endocannabinoids. J. Endocrinol., 2006; 29, (Suppl. 3): 3-14.
6. Lambert DM, Di Marzo V: The palmitoylethanolamide and oleamide enigmas: are these two fatty acid amides cannabimimetic? Curr. Med. Chem., 1999; 6: 757-773.
7. Jonsson KO, et al.: Effects of homologues and analogues of palmitoylethanolamide upon the inactivation of the endocannabinoid anandamide. Br. J. Pharmacol., 2001; 133: 1263-1275.
8. Glass M, Northup JK: Agonist selective regulation of G proteins by cannabinoid CB(1) and CB(2) receptors. Mol. Pharamacol., 1999; 56: 1362-1369.
9. Howlett AC, Shim J-Y: Cannabinoid receptors and signal transduction. In: Di Marzo ed. Cannabinoids. Kluwer Academic/Plenum Publishers-Landes Bioscience. 2004, 84-97.
10. Kreitzer AC, Regehr WG: Retrograde inhibition of presynaptic calcium influx by endogenous cannabinoids at excitatory synapses onto Purkinje cells. Neuron 2001; 29: 717-727.
11. Kreitzer AC, Regehr WG: Cerebellar depolarization-induced suppression of inhibition is mediated by endogenous cannabinoids. J. Neurosci 2001; 21: RC174.
12. Klein TW: Cannabinoid-based drugs as anti-inflammatory therapeutics. Nat. Rev. Immunol., 2005; 5746: 329-332.
13. Steffens S, et al.: Low dose oral cannabinoid therapy reduces progression of atherosclerosis in mice. Nature, 2005, 434: 782-786.
14. Cota D, et al.: The endogenous cannabinoid system affects energy balance via central orexygenic drive and peripheral lipogenesis. J. Clin. Invest., 2003; 112: 423-431.
15. Gamber KM, et al.: Cannabinoids augment the release of neuropeptide Y in the rat hypothalamus. Neuropharmacology. 2005; 49: 646-652.
16. Di S, et al.: Nongenonic glucocorticoid inhibition via endocannabinoid release in the hypothalamus: a fast feedback mechanism. J. Neurosci 2003; 23: 4850-4857.
17. Tucci SA, et al.: The cannabinoid CB1 receptor antagonist SR 141716 block the orexigenic effects of intrahypothalamic ghrelin. Br. J. Pharmacol., 2004; 143: 520-533.
18. Maccarrone M, et al.: Up-regulation of the endocannabinoid system in the uterus of leptin knock-out (ob/ob) mice and implications for fertility. Mol. Hum. Reprod., 2005; 11: 21-28.
19. Monteleone P, et al.: Blood levels of the endocannabinoid anandamide are increased in anorexia nervosa and in binge-eating disorder, but not in bulimia nervosa. Neuropsychopharmacology. 2005; 30: 1216-1221.
20. Kulkarni-Narla A, Brown DR: Localization of CB1-cannabinoid receptor immunoreactivity in the porcine enteric nervous system. Cell Tissue Res., 2000; 302: 73-80.
21. Kulkarni-Narla A, Brown DR: Opioid, cannabinoid and vanilloid receptor localization on porcine cultured myenteric neurons. Neurosci Lett 2001; 308: 153-156.
22. Rivas V, Garcia R: Inhibition of histamine-stimulated gastric acid secretion by delta 9-tetrahydrocannabinol in rat isolated stomach. Eur. J. Pharmacol., 1980; 65: 317-318.
23. McCallum RW, et al.: Delta-9-tetrahydrocannabinol delays the gastric emptying of solid food in humans: a double-blind, randomized study. Aliment. Pharmacol. Ther., 1999; 13: 77-80.
24. Liu YL, et al.: Effects of the cannabinoid CB1 receptor antagonist SR141716 on oxygen consumption and soleus muscle glucose uptake in Lep(ob)/Lep(ob) mice. Int. J. Obes. Relat. Metab. Disord., 2005; 29: 183-187.
25. Tzavara ET, et al.: The cannabinoid CB1 receptor antagonist SR141716A increases norepinephrine outflow in the rat anterior hypothalamus. Eur. J. Pharmacol., 2001; 426: R3-R4.
26. Osei-Hyiaman D, et al.: Endocannabinoid activation at hepatic CB1 receptors stimulates fatty acid synthesis and contributes to diet-induced obesity. J. Clin. Invest. 2005; 81: 273-282.
27. Juan-Pico P, et al.: Cannabinoid receptors regulate Ca(2+) signals and insulin secretion in pancreatic beta-cell. Cell Calcium 2006; 39: 155-162.
28. Bermudez-Silva F, et al.: Activation of cannabinoid CB(1) receptors induces glucose intolerance in rats. Eur. J. Pharmacol., 2006; 531: 282-284.
29. Di Marzo V, et al.: The endocannabinoid system and its therapeutic exploitation. Nat. Rev. Drug. Discov., 2004; 3: 771-184.
30. Kunos G, Batkai S: Novel physiologic functions of endocannabinoids as revealed through the use of mutant mice. Neurochem Res., 2001; 26: 1015-1021.
31. Despres JP: Intra-abdominal obesity: An untreated risk factor for Type 2 diabetes and cardiovascular disease. J. Clin. Invest., 2006; 29, (Suppl. 3): 77-82.
32. Van Gaal LF, Peiffer F: New approaches for the management of patients with multiple cardiometabolic risk factors. J. Endocrinol. Invest., 2006; 29, (Suppl. 3): 83-89.

