© Borgis - Postępy Nauk Medycznych 5/2008, s. 304-309
*Monika Góra1, 2, Marlena Godlewska1
Mapowanie epitopów konformacyjnych ludzkiej peroksydazy tarczycowej1)
Mapping conformational epitopes of human thyroid peroxidase
1Zakład Biochemii i Biologii Molekularnej Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Zakładu: prof. dr hab. Andrzej Gardas
2Zakład Genetyki Instytutu Biochemii i Biofizyki w Warszawie
Kierownik Zakładu: prof. dr hab. Andrzej Paszewski
Streszczenie
Peroksydaza tarczycowa (TPO), enzym odpowiedzialny za biosyntezę hormonów tarczycy, jest jednocześnie głównym antygenem w autoimmunologicznych chorobach tarczycy. Autoprzeciwciała anty-TPO w surowicach pacjentów są w przeważającej większości skierowane przeciwko dwóm głównym konformacyjnym epitopom (A i B) zlokalizowanym na powierzchni cząsteczki TPO. Ze względu na nieciągłą budowę mapowanie epitopów konformacyjnych bez znajomości struktury krystalicznej antygenów jest dużym wyzwaniem. Dzięki zastosowaniu metod ukierunkowanej mutagenezy oraz bibliotek prezentacji na fagu, połączonych z możliwością komputerowej analizy modelu trzeciorzędowej struktury TPO, w ostatnich latach zidentyfikowano szereg reszt aminokwasowych wchodzących w skład domen A i B peroksydazy tarczycowej. Poznanie struktury konformacyjnych epitopów obecnych na powierzchni TPO i określenie mechanizmu wiązania autoprzeciwciał może w przyszłości posłużyć do zrozumienia mechanizmów prowadzących do powstania choroby autoimmunologicznej, a także otworzyć nowe perspektywy terapeutyczne.
Summary
Thyroid peroxidase (TPO), the enzyme responsible for the biosynthesis of thyroid hormones, is also a major autoantigen in autoimmune thyroid diseases. The majority of the anti-TPO antibodies in patients´ sera are restricted to two dominant conformational epitopes (A and B) on the TPO surface. Due to their discontinuous nature mapping of conformational epitopes without knowledge of the crystal structure of the antigen is a great challenge. Site-directed mutagenesis and phage display, together with computer analysis of a three dimensional model of the TPO structure, allowed identification of several amino acid residues participating in domains A and B of thyroid peroxidase. Insight into the structure of conformational epitopes on the TPO surface and the mechanism of autoantibody binding could lead to better understanding of the mechanisms inducing autoimmune disease could open new perspectives for novel immunotherapeutic strategies as well as.

WPROWADZENIE
Choroby autoimmunologiczne pole-gają na załamaniu tolerancji organizmu na autoantygeny i skierowaniu odpo-wiedzi immunologicznej przeciwko wła-snym tkankom i narządom. W zależności od lokalizacji procesu chorobowego mamy do czynienia z bardzo zróżnicowanymi zespołami objawów, zgrupo-wanymi w ponad 70 jednostek chorobowych (cukrzyca typu 1, autoimmunologiczne choroby tarczycy, stwardnienie rozsiane, reumatoidalne zapalenie stawów, niedokrwistość hemolityczna, toczeń układowy i wiele innych). Wspólną cechą chorób autoimmunologicznych jest obecność w surowicy pacjentów autoprzeciwciał, które odgrywają znaczącą rolę w diagnostyce choroby, przy czym poziom tych przeciwciał często koreluje z zaawansowaniem stanu chorobowego (1).
Autoimmunologiczne choroby tarczy-cy (AITD – ang. autoimmune thyroid diseases) mogą być uznane za niezwykle istotny model choroby o podłożu autoimmunologicznym, zarówno ze względu na wysoką częstość występowania w populacji ludzkiej (2%), jak i na dostępność modeli zwierzęcych (2). Do tej grupy chorób zalicza się zapalenie tarczycy typu Hashimoto, prowadzące do niedoczynności tarczycy, oraz chorobę Gravesa-Basedowa, powodującą nadczynność tego gruczołu. W surowicach pacjentów z AITD oznaczane są autoprzeciwciała skierowane przeciwko białkom tarczycowym, a szczególnie przeciwko głównemu antygenowi mikrosomalnemu – peroksydazie tarczycowej (TPO) (3). Przeciwciała anty-TPO występują w surowicach ponad 90% pacjentów z chorobą Hashimoto i 75% pacjentów z chorobą Gravesa-Basedowa, są zatem ważnym mar-kerem diagnostycznym autoimmunologicznych chorób tarczycy (4).
Mimo wielu lat badań etiologia i patogeneza chorób autoimmunologicznych nie została w pełni poznana i wyjaśniona. Co ciekawe, liczba autoantygenów w porównaniu z liczbą wszystkich ludzkich białek jest bardzo mała – szacuje się, że autoantygeny stanowią nie więcej niż 1-2% ogólnej liczby białek (5). W ogromnej większości przypadków do tej pory nie wiadomo, dlaczego dane białko zostaje autoantygenem, choć proponuje się wpływ takich czynników, jak strukturalne właściwości samego białka (w tym obecność sekwencji homologicznych do sekwencji czynników infekcyjnych – tzw. mimikra molekularna), jego lokalizacja i katabolizm, a także właściwości immunologiczne/prozapalne (5). Istnieje wiele danych świadczących, że autoprzeciwciała w różnych jednostkach chorobowych wiążą się często z ograniczonym regionem na powierzchni autoantygenu – tzw. domeny czy regionu immunodominującego (6, 7, 8). Występowanie takich immunodominujących determinant antygenowych może być spowodowane mechanizmami immunologicznej regulacji oraz//lub konsekwencją cech strukturalnych autoantygenu. Dlatego też określenie struktury i lokalizacji autoepitopów (regionów autoantygenów rozpoznawanych przez autoprzeciwciała) może być bardzo istotne w zrozumieniu mechanizmów prowadzących do powstania i rozwoju choroby autoimmunologicznej (9).
ODDZIAŁYWANIA ANTYGEN-PRZECIWCIAŁO
Analiza struktur krystalicznych wielu kompleksów antygen-przeciwciało oraz ich niezwiązanych składowych wykazała, że podczas tworzenia kompleksu zachodzą konformacyjne zmiany zarówno przeciwciała, jak i wiązanego antygenu. A zatem przeciwciało rozpoznaje antygen raczej zgodnie z modelem „indukowanego dopasowania”, a nie modelem „klucza i zamka” (10). Dopasowanie oddziałujących powierzchni nie musi być doskonałe, wewnątrz znajdują się często cząsteczki wody, które mogą pośredniczyć w wiązaniu pomiędzy przeciwciałem a antygenem (11). Powierzchnie oddziaływań antygen-przeciwciało są względnie płaskie, okrągłe lub eliptyczne, zajmują średnio od 700 do 1700A2, a w większości kontaktów pomiędzy przeciwciałem a antygenem uczestniczą łańcuchy boczne reszt aminokwasowych (12,13,14). W reakcji antygenu z przeciwciałem udział biorą wiązania jonowe (mostki solne), wiązania wodorowe i wiązania van der Waalsa (15). Silne mostki solne i ich duże usieciowanie prowadzą do większej specyficzności, ale mniejszej elastyczności oddziaływania. Odwrotnie, wiązania wodorowe i mała liczba wiązań jonowych związane są z elastycznością konformacyjną i mniejszą specyficznością interakcji antygen-przeciwciało. Dlatego mutacja reszty aminokwasowej obdarzonej ładunkiem wywołuje zazwyczaj znaczące efekty w reakcji przeciwciała z antygenem, natomiast mutacja reszty hydrofobowej jest najczęściej mniej poważna (16). Na podstawie składu chemicznego trudno jak dotąd zidentyfikować miejsca oddziaływań antygen-przeciwciało. Wiadomo, że w paratopie przeciwciała obserwuje się dużą częstość występowania aminokwasów aromatycznych (34% reszt amino-kwasowych wchodzących w kontakt z antygenem), natomiast w epitopie antygenu udział aminokwasów aromatycznych jako reszt kluczowych dla kontaktu z przeciwciałem jest niewielki (11).
Przeciwciała powstające w czasie od-powiedzi immunologicznej w 90% roz-poznają epitopy nieciągłe, konformacyjne (10). Epitopy takie są zbudowane z reszt aminokwasowych, które nie zawsze sąsiadują ze sobą w sekwencji liniowej (strukturze pierwszorzędowej) białka, ale są położone blisko siebie w strukturze trzeciorzędowej wskutek odpowiedniego sfałdowania łańcucha polipeptydowego. Epitopy nieciągłe mogą zawierać kilka ciągłych odcinków aminokwasowych i często zbudowane są z reszt aminokwasowych 2-5 oddzielnych regionów łańcucha polipeptydowego.
Zbiór wszystkich reszt aminokwasowych będących w kontakcie z resztami aminokwasowymi przeciwciała (odległość międzyatomowa mniejsza niż 4A°) jest nazywany epitopem strukturalnym (10). Składa się on zazwyczaj z 15-22 reszt aminokwasowych. Czy reszty te biorą udział w energii wiązania wyjaśnić można jedynie w badaniach funkcjonalnych, mierzących zmianę powinowactwa przeciwciała do antygenu spowodowaną podstawieniem pojedynczego aminokwasu. Badania takie wykazały, że tylko od 3 do 5 reszt aminokwasowych epitopu strukturalnego wnosi indywidualnie znaczący wkład w energię wiązania, tworząc tzw. epitop funkcjonalny (10). Aminokwasy epitopu funkcjonalnego antygenu odpowiadają za ok. 90% energii wiązania przeciwciała (17).
METODY BADANIA EPITOPÓW KONFORMACYJNYCH
Ze względu na złożoną, nieciągłą budowę epitopów konformacyjnych, jedynie ustalenie struktury krystalicznej kompleksów antygen-przeciwciało może dać pełną informację o resztach aminokwasowych antygenu uczestniczących w wiązaniu przeciwciała. Oczyszczenie białek i otrzymanie kryształów wysokiej jakości, umożliwiających prawidłową analizę krystalograficzną, jest jednak często poważnym i niezwykle trudnym wyzwaniem. Dlatego stosowanych jest szereg innych technik mapowania epitopów konformacyjnych, które obejmują chemiczną modyfikację łańcuchów bocznych reszt aminokwasowych, badanie fragmentów antygenów chronionych przed modyfikacją lub proteolizą przez związanie przeciwciała, konstrukcję skróconych form antygenu i jego różnych fragmentów, konstrukcję wariantów hybrydowych pomiędzy antygenem a homologicznym białkiem, zastosowanie syntetycznych peptydów odpowiadających fragmentom sekwencji antygenu (17,18). W ostatnich latach niezwykle wartościowe w mapowaniu i definiowaniu epitopów konformacyjnych okazało się wprowadzenie metod ukierunkowanej mutagenezy (ang. site-directed mutagenesis) oraz testów prezentacji na fagu (ang. phage display).
Ukierunkowana mutageneza polega na podstawieniu wybranych reszt aminokwasowych, przy zastosowaniu technik rekombinowanego DNA, aminokwasami o innych właściwościach. Często stosowane jest podstawienie alaniną, niewielkim aminokwasem z grupą metylową, co pozwala na ustalenie udziału łańcuchów bocznych w energii wiązania. Natomiast podstawienie aminokwasami z łańcuchami bocznymi o większej objętości może umożliwić identyfikację innych reszt, które nie mają indywidualnie znaczącego udziału w energii wiązania (17).
W testach prezentacji na fagu do poszukiwania sekwencji, które wiążą badane przeciwciało z wysokim powinowactwem, stosuje się biblioteki przypadkowych peptydów w fuzji z białkami kapsydu bakteriofagów (19). Bakteriofagi „prezentują” sekwencje peptydowe na powierzchni, co umożliwia badanie oddziaływania tych sekwencji z przeciwciałami. Otrzymane peptydy (tzw. mimotopy) funkcjonalnie imitują epitopy konformacyjne, niekoniecznie posiadając tę samą sekwencję aminokwasową. Możliwe jest bowiem imitowanie nieciągłego epitopu poprzez rozmieszczenie w sekwencji liniowej kilku krytycznych aminokwasów w taki sposób, by ich łańcuchy boczne były ustawione podobnie jak w nieciągłym epitopie konformacyjnym. Do analizy mimotopów i znalezienia odpowiadających im sekwencji antygenu stosuje się zaawansowane metody komputerowe.
STRUKTURA I FUNKCJA PEROKSYDAZY TARCZYCOWEJ
Ludzka peroksydaza tarczycowa (TPO), główny autoantygen w autoimmunologicznych chorobach tarczycy, należy do rodziny pero-ksydaz ssaczych, w skład której wchodzą również mieloperoksydaza, laktoperoksydaza, peroksydaza eozynofili oraz peroksydaza ślinowa. TPO jest głównym enzymem uczestniczącym w biosyntezie hormonów tarczycy. Enzym ten katalizuje utlenianie jodków w obecności H2O2 i jodowanie tyrozyn, które są następnie sprzęgane do trijodotyroniny (T3) i tetrajodotyroniny (T4) (20). Peroksydaza tarczycowa zawiera jako grupę prostetyczną kowalencyjnie związaną cząsteczkę hemu b. W komórce TPO jest zlokalizowana w błonie szczytowej, a duża część zewnątrzkomórkowa tego białka jest zwrócona w stronę światła pęcherzyka tarczycowego. Peroksydaza tarczycowa jest białkiem glikozylowanym, w swojej sekwencji posiada 4 potencjalne miejsca przyłączania reszt cukrowych. Postuluje się, że TPO w stanie natywnym może występować jako dimer o masie ok. 220 kD (21).
Ludzka peroksydaza tarczycowa zbudowana jest z 933 aminokwasów, które obejmują: region zewnątrzkomórkowy składający się z 846 aminokwasów (w tym 18-aminokwasowa sekwencja sygnałowa), domenę transbłonową (25 aminokwasów) oraz krótki odcinek cytoplazmatyczny (62 aminokwasy) (ryc. 1). W domenie zewnątrzkomórkowej (tzw. ektodomenie) można wyróżnić trzy obszary wykazujące wysoką homologię do sekwencji innych białek. Region 142-738 posiada 42% identyczności i 71% podobieństwa do sekwencji mieloperoksydazy (domena typu MPO), region 739-795 posiada 21% identyczności i 48% podobieństwa do sekwencji 15-tej domeny czynnika H dopełniacza (domena typu CCP), natomiast region 796-841 posiada 36% identyczności i 62% podobieństwa do sekwencji domeny epidermalnego czynnika wzrostu w fibrylinie (domena typu EGF) (22). Podczas posttranslacyjnego procesu dojrzewania peroksydazy N-końcowe reszty aminokwasowe 1-108 są usuwane z białka (23).
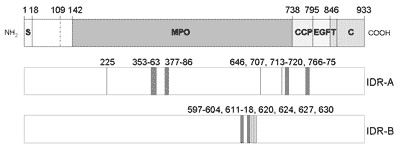
Ryc.1. Schemat struktury TPO oraz składu aminokwasowego regionów immunodominujących IDR-A i IDR-B rozpoznawanych przez autoprzeciwciała.
S, sekwencja sygnałowa; MPO, domena typu MPO; CCP, domena typu CCP; EGF, domena typu EGF; T, domena transbłonowa; C, domena cytoplazmatyczna.
AUTOEPITOPY PEROKSYDAZY TARCZYCOWEJ
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Druet P: Diagnosis of autoimmune diseases. J Imm Meth 1992; 150:177-84.
2. Rapoport B, McLachlan SM:Thyroid Autoimmunity. J Clin Invest 2001; 108:1253-9.
3. Czarnocka B, et al.: Purification of human thyroid peroxidase and its identification as the microsomal antigen involved in autoimmune thyroid diseases. FEBS Lett 1985; 190:147-52.
4. Mariotti S, et al.: Antithyroid peroxidase autoantibodies in thyroid diseases. J Clin Endocrinol Metab 1990; 71:661-9.
5. Plotz PH: The autoantibody repertoire: searching for order. Nat Rev Immunol 2003; 3:73-8.
6. Guo J, et al.: Rarity of autoantibodies to a major autoantigen, thyroid peroxidase, that interact with denatured antigen or with epitopes outside the immunodominant region. Clin Exp Immunol 1999; 117:19-29.
7. Mackay IR, Gershwin ME: Molecular basis of mitochondrial autoreactivity in primary biliary cirrhosis. Immunol Today 1989; 10:315--18.
8. Tzartos SJ, et al.: Anatomy of the antigenic structure of a large membrane autoantigen, the muscle-type nicotinic acetylcholine receptor. Immunol Rev 1998; 163:89-120.
9. Routsias JG, Vlachoyiannopoulos PG, Tzioufas AG: Autoantibodies to intracellular autoantigens and their B-cell epitopes: molecular probes to study the autoimmune response. Crit Rev Clin Lab Sci 2006; 43:203-48.
10. Van Regenmortel MHV: Mapping epitope structure and activity: from one-dimensional prediction to four-dimensional description of antigenic specificity. Methods 1996; 9:465-72.
11. Davies DR, Cohen GH: Interactions of protein antigens with antibodies. Proc Natl Acad Sci USA 1996; 93:7-12.
12. Chakrabarti, Janin J: Dissecting protein-protein recognition sites. Proteins 2002; 47:334-43.
13. Jones S, Thornton JM: Principles of protein-protein interactions. Proc Natl Acad Sci USA 1996; 93:13-20.
14. Lo Conte L, Chothia C, Janin J: The atomic structure of protein-protein recognition sites. J Mol Biol 1999; 285:2177-98.
15. Davies DR, Padlan EA, Sheriff S: Antibody-antigen complexes. Annu Rev Biochem 1990; 59:439-73.
16. Sinha N, et al.: Differences in electrostatic properties at antibody-antigen binding sites: implications for specificity and cross-reactivity. Biophys J 2002; 83:2946-68.
17. Benjamin DC, Perdue SS: Site-directed mutagenesis in epitope mapping. Methods 1996; 9:508-15.
18. Mackay IR, Rowley MJ: Autoimmune epitopes: autoepitopes. Autoimmun Rev 2004; 3:487-92.
19. Daniels DA, Lane DP: Phage Peptide Libraries. Methods 1996; 9:494-507.
20. Taurog A, Dorris ML, Doerge DR: Mechanism of simultaneous iodination and coupling catalyzed by thyroid peroxidase. Arch Biochem Biophys 1996; 330:24-32.
21. Baker JR, Arscott P, Johnson J: An analysis of the structure and antigenicity of different forms of human thyroid peroxidase. Thyroid 1994; 4:173-8.
22. Hobby P, et al.: Identification of an immunodominant region recognised by human autoantibodies in a three dimensional model of thyroid peroxidase. Endocrinology 2000; 141:2018-26.
23. Le Fourn V, Ferrand M, Franc JL: Endoproteolytic cleavage of human thyroperoxidase: role of the propeptide in the protein folding process. J Biol Chem 2005; 280:4568-77.
24. Ruf J, et al.: Relationship between immunological structure and biochemical properties of human thyroid peroxidase. Endocrinology 1989; 125:1211-18.
25. Czarnocka B, et al.: Immunoglobulin Gk antithyroid peroxidase antibodies in Hashimoto´s thyroiditis: Epitope mapping analysis. J Clin Endocrinol Metab 1997; 82:2639-44.
26. Guo J, et al.: Relationship between autoantibody epitopic recognition and immunoglobulin gene usage. Clin Exp Immunol 1998; 111:408-14.
27. Ruf J, Carayon P: Structural and functional aspects of thyroid peroxidase. Arch Biochem Biophys 2006; 445:269-77.
28. McLachlan SM, Rapoport B: Thyroid peroxidase as an autoantigen. Thyroid 2007; 17:939-48.
29. Libert F, et al.: Thyroperoxidase, but not the thyrotropin receptor, contains sequential epitopes recognized by autoantibodies in recombinant peptides expressed in the pUEX vector. J Clin Endocrinol Metab 1991; 73:857-60.
30. Finke R, et al.: Determination at the molecular level of a B-cell epitope on thyroid peroxidase likely to be associated with autoimmune thyroid disease. J Clin Endocrinol Metab 1991; 73:919-21.
31. Nishikawa T, et al.: Human thyroid peroxidase-myeloperoxidase chimeric molecules: tools for the study of antigen recognition by thyroid peroxidase autoantibodies. Endocrinology 1993; 133:2496-501.
32. Nishikawa T, Rapoport B, McLachlan SM: Exclusion of two major areas on thyroid peroxidase from the immunodominant region containing the conformational epitopes recognised by the human autoantibodies. J Clin Endocrinol Metab 1994; 79:1648-54.
33. Estienne V, et al.: A conformational B-cell epitope on the C-terminal end of the extracellular part of human thyroid peroxidase. J Biol Chem 1998; 273:8056-62.
34. Estienne V, et al.: Molecular model, calcium sensitivity, and disease specificity of a conformational thyroperoxidase B-cell epitope. J Biol Chem 1999; 274:35313-7.
35. Estienne V, et al.: Analysis of a conformational B cell epitope of human thyroid peroxidase: identification of a tyrosine residue at a strategic location for immunodominance. Int Immunol 2002; 14:359-66.
36. Blanchin S, et al.: Human thyroperoxidase folds in one complex B-cell immunodominant region. Biochem Biophys Res Commun 2002; 295:1118-24.
37. Grennan Jones F, et al.: Analysis of autoantibody epitopes on human thyroid peroxidase. Autoimmunity 1999; 30:157-69.
38. Xiong Z, et al.: Does the autoantibody immunodominant region on thyroid peroxidase include amino acid residues 742-771? Thyroid 2001; 11:227-31.
39. Guo J, Rapoport B, McLachlan SM: Localisation of the thyroid peroxidase autoantibody immunodominant region to a junctional region containing portions of the domains homologous to complement control protein and myeloperoxidase. J Biol Chem 2002; 277: 40189-95.
40. Gardas A, et al.: Human thyroid peroxidase: mapping of autoantibodies, conformational epitopes to the enzyme surface. Redox Report 2000; 5:237-41.
41. Góra M, et al.: Evaluation of conformational epitopes on thyroid peroxidase by anti-peptide antibody binding and mutagenesis. Clin Exp Immunol 2004; 136:137-44.
42. Góra M, et al.: Key residues contributing to dominant conformational autoantigenic epitopes on thyroid peroxidase identified by mutagenesis. Biochem Biophys Res Commun 2004; 320:795-801.
43. Dubska M, et al.: Structural insights into autoreactive determinants in thyroid peroxidase composed of discontinuous and multiple key contact amino acid residues contributing to epitopes recognized by patients´ autoantibodies. Endocrinology 2006; 147:5995-6003.
44. Bresson D, et al.: Localization of the discontinuous immunodominant region recognized by human anti-thyroperoxidase autoantibodies in autoimmune thyroid diseases. J Biol Chem 2003; 278:9560-9.
45. Bresson D, et al.: Directed mutagenesis in region 713-720 of human thyroperoxidase assigns 713KFPED717 residues as being involved in the B domain of the discontinuous immunodominant region recognized by human autoantibodies. J Biol Chem 2004; 279:39058-67.
46. Rebuffat SA, et al.: The key residues in the immunodominant region 353-363 of human thyroid peroxidase were identified. Int Immunol 2006; 18:1091-9.
47. Guo J, et al.: Search for the autoantibody immunodominant region on thyroid peroxidase: epitopic footprinting with a human monoclonal autoantibody locates a facet on the native antigen containing a highly conformational epitope. J Immunol 2001; 166:1327-33.
48. Bresson D, et al.: New insights into the conformational dominant epitopes on thyroid peroxidase recognized by human autoantibodies. Endocrinology 2005; 146:2834-44.
49. Gardas A, et al.: Purification and crystallisation of the human autoantigen thyroid peroxidase. Biochem Biophys Res Commun 1997; 237:366-70.
50. Hendry E, et al.: Recombinant human thyroperoxidase expressed in insect cells is soluble at high concentrations and forms diffracting crystals. J Endocrinol 1999; 160:R13-R15.

