© Borgis - Postępy Nauk Medycznych 8/2010, s. 627-634
*Tomasz Saniewski1, Włodzimierz Mojkowski2, Marek Dąbrowski1,2
Leczenie zaburzeń rytmu po zawale mięśnia sercowego – wskazania do wszczepienia kardiowertera-defibrylatora
Treatment of arrhythmias after myocardial infarction – indications for implantable cardioverter-defibrillator
1Kliniczny Oddział Kardiologiczny w Szpitalu Bielańskim
Ordynator Oddziału: dr hab. med. Marek Dąbrowski
2Zespół Kliniczno-Badawczy Chorób Układu Krążenia Instytutu Medycyny Doświadczalnej i Klinicznej PAN
Kierownik Zespołu: doc. dr hab. med. Marek Dąbrowski
Streszczenie
Najczęstszym mechanizmem nagłej śmierci sercowej (SCD) jest migotanie komór (VF). Pacjenci z zawałem serca są szczególnie zagrożeni nagłą śmiercią sercową. Wskazania do wszczepienia kardiowertera-defibrylatora (ICD) można sklasyfikować jako prewencję wtórną i pierwotną. Prewencja wtórna dotyczy pacjentów, u których wystąpił niestabilny hemodynamicznie, trwały częstoskurcz komorowy lub migotanie komór. Groźne komorowe zaburzenia rytmu występujące w ciągu 48 godzin od zawału serca są związane z odwracalnymi zmianami w niedokrwionej tkance mięśnia sercowego i nie są wskazaniem do implantacji kardiowertera-defibrylatora. Pacjenci z dysfunkcją lewej komory, niską frakcją wyrzutową, zagrożeni SCD są dobrymi kandydatami do wszczepienia ICD po 40 dniach od zawału serca.
W 70% przypadków w Szpitalu Bielańskim implantowano ICD po zawale serca w ramach prewencji pierwotnej. W trakcie rocznej obserwacji (± 3 miesiące) u 17% pacjentów tej grupy wystąpił trwały częstoskurcz komorowy lub migotanie komór. Skuteczność implantowanych kardiowerterów-defibrylatorów w tym okresie w przerywaniu groźnych, komorowych zaburzeń rytmu wyniosła 100%.
Summary
The most common mechanism of sudden cardiac death (SCD) is ventricular fibrillation (VF). Patients with myocardial infarction are particularly at risk of sudden cardiac death. Indications for implantable cardioverter-defibrillator (ICD) can be classified as primary and secondary prevention.
Secondary prevention applies to patients who have experienced hemodynamically unstable, sustained ventricular tachycardia (sVT) or ventricular fibrillation. Ventricular arrhytmias occurring within 48 hours of myocardial infarction associated with reversible changes in ischemic myocardial tissue are not an indication for implantable cardioverter-defibrillator. Patients with left ventricular dysfunction, low ejection fraction are at risk of SCD. They are good candidates for implantation ICD in primary prevention 40 days after MI.
70% of ICD after myocardial infarction were implanted in Bielański Hospital in primary prevention in 2009. During the annual follow-up (± 3 months) in 17% of that group of patients sVT or VF were occurred. Effectiveness of the ICD was 100%.

Wstęp
Pomimo rozwoju medycyny, obserwuje się stały wzrost występowania nagłej śmierci sercowej (SCD – sudden cardiac death). Najczęstszym mechanizmem zatrzymania krążenia pozostaje migotanie komór. Około 75% przypadków SCD występuje u chorych na chorobę wieńcową (1). Szczególnie narażeni nagłą śmiercią sercową są pacjenci z zawałem serca. Migotanie komór jest pierwszym objawem zawału serca u około 20% pacjentów (2). Pomimo zmniejszenia śmiertelności dzięki szybkiej diagnostyce i rewaskularyzacji w ostrej fazie zawału mięśnia sercowego, obserwuje się wzrost ryzyka SCD później, po początkowym okresie rekonwalescencji. Szczególnie zagrożeni są pacjenci z uszkodzeniem lewej komory, z obniżoną frakcją wyrzucania LVEF w ciągu 12 miesięcy po zawale serca.
Implantowane kardiowertery-defibrylatory (ICD – Implantable Cardioverter Defibrylator) są urządzeniami wykrywającymi i przerywającymi komorowe zaburzenia rytmu serca, tj. migotanie komór (VF), częstoskurcz komorowy (VT), o skuteczności przekraczającej 97% (3).
Patofizjologia
Etiopatogeneza groźnych komorowych zaburzeń rytmu serca ma złożony charakter i zależy od czasu dokonania się zawału serca. Mechanizm VT lub VF w świeżym zawale serca wynika z odwracalnych zmian w niedokrwionym mięśniu sercowym. Wśród 20% pacjentów z zawałem serca pierwszym objawem jest migotanie komór. W wyniku zawału serca dochodzi do uszkodzenia komórek, następnie do wtórnej reperfuzji niedokrwionych obszarów, w podwsierdziowej i podosierdziowej części mięśnia sercowego. Na poziomie komórkowym konsekwencje niedokrwienia obejmują zmianę fizjologii błony komórkowej związanej z odpływem jonów potasowych i napływem jonów wapniowych oraz kwasicę i obniżenie przezbłonowych potencjałów spoczynkowych. Dokomórkowy napływ jonów wapniowych oraz, wywołany niedokrwieniem, skracający repolaryzację, skierowany na zewnątrz, prąd potasowy przyczyniają się do niestabilności elektrycznej (4). Z uwagi na odwracalność wyżej opisanych zmian przyjmuje się, że VF lub trwały VT, które występują w ciągu 48 godzin od zawału, nie są czynnikami predykcyjnymi ponownych incydentów i nie są też wskazaniem do implantacji ICD.
W kolejnych dobach po zawale następuje proces gojenia uszkodzonej tkanki mięśnia sercowego, polegający na hiperplazji fibroblastów, odkładaniu kolagenu i tworzeniu się blizny (5). Niejednolita tkanka mięśnia sercowego utworzona przez przerośnięty mięsień sercowy wokół blizny pozawałowej stanowi warunki do pojawienia się kluczowych elementów fali nawrotnej- wolnego przewodzenia i bloku jednokierunkowego i tym samym nawracających częstoskurczów komorowych. Na poziomie komórkowym dochodzi do zmniejszenia napływu jonów wapniowych i sodowych w komórkach bezpośrednio graniczących z blizną pozawałową. W przerośniętych, oddalonych od blizny komórkach zmniejszenie odkomórkowego wypływu jonów potasowych wpływa na wydłużenie czasu trwania potencjału czynnościowego oraz powoduje zaburzenia repolaryzacji. Ściana lewej komory w miejscu pierwotnego niedokrwienia ulega remodelingowi polegającemu na ścieńczeniu, a w odległych obserwacjach mogącemu doprowadzić do rozstrzeni lewej komory. Groźne dla życia komorowe zaburzenia rytmu serca występujące po 48 godzinach od zawału serca mogą nawracać i związane są ze wzrostem ryzyka nagłej śmierci sercowej.
Materiał
W 2009 roku w Klinicznym Oddziale Kardiologii w Szpitalu Bielańskim implantowano 50 kardiowerterów-defibrylatorów u pacjentów po zawale serca. Poddani analizie pacjenci z wszczepionym ICD w ramach prewencji pierwotnej stanowili 70% (ryc. 1). Średnia frakcja wyrzutowa lewej komory w tej grupie chorych wyniosła 26%. W 40% przypadków implantowano ICD jednojamowe. W trakcie rocznej obserwacji (± 3 miesiące) u 17% pacjentów, którym wszczepiono kardiowertery-defibrylatory w ramach prewencji pierwotnej, wystąpiły trwałe częstoskurcze komorowe lub migotanie komór. Skuteczność implantowanych kardiowerterów-defibrylatorów w tym okresie w przerywaniu groźnych, komorowych zaburzeń rytmu wyniosła 100%.
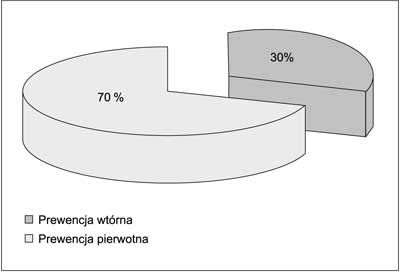
Ryc. 1. Implantacje ICD u pacjentów po zawale serca w ramach prewencji pierwotnej i wtórnej w 2009 roku w Szpitalu Bielańskim w Warszawie.
Opis przypadku
63-letni pacjent, palący papierosy, przyjęty został do Oddziału Kardiologii z powodu źle tolerowanych, nawracających, nieutrwalonych częstoskurczów komorowych (wykonany ambulatoryjnie Holter-EKG, ryc. 2). Wywiad w kierunku omdleń był negatywny. U chorego rozpoznano wcześniej chorobę wieńcową. W 1996 r. pacjent przebył zawał ściany dolnej mięśnia sercowego. Miał także rozpoznane nadciśnienie tętnicze. W badaniu przedmiotowym z odchyleń stwierdzono cechy niewielkiego zastoju u podstawy płuc. W badaniu ECHO serca opisano obszar akinetyczno-dyskinetyczny, ze ścieńczeniem ściany przypodstawnego i środkowego segmentu ściany dolnej, z istotną dysfunkcją skurczową, EF ~26%. Pacjenta zakwalifikowano do koronarografii, w której uwidoczniono prawą tętnicę wieńcową zrekanalizowaną w odcinku proksymalnym, obwód wypełniał się z opóźnieniem przez zwężenie. W ramach prewencji pierwotnej implantowano choremu dwujamowy kardiowerter-defibrylator. Okres okołozabiegowy był niepowikłany. Wykonano kontrolne zdjęcie RTG klatki piersiowej w celu udokumentowania lokalizacji elektrod (ryc. 3). Pacjent pozostaje pod opieką Poradni Elektrofizjologii i Elektroterapii. W trakcie rocznej obserwacji zarejestrowano liczne incydenty nieutrwalonego częstoskurczu komorowego (nsVT) oraz kilka trwałych częstoskurczów komorowych skutecznie przerwanych za pomocą ICD. (ryc. 4).
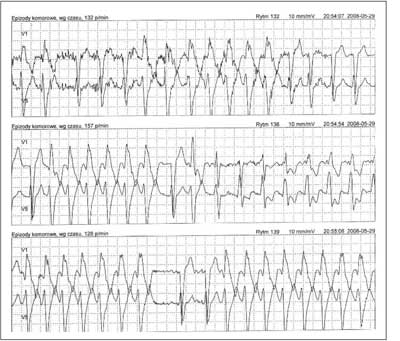
Ryc. 2. Badanie Holter-ekg.
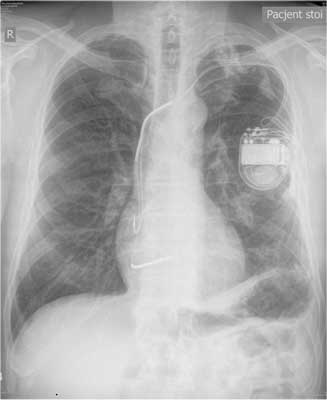
Ryc. 3. Zdjęcie RTG klatki piersiowej po wszczepieniu dwujamowego ICD. Elektroda komorowa położona w drodze odpływu prawej komory.
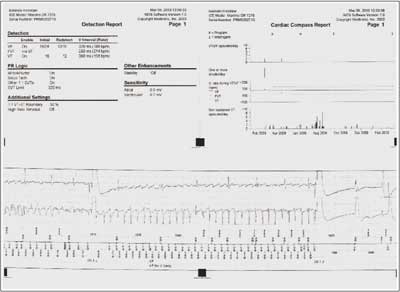
Ryc. 4. Wydruk z „pamięci” ICD.
Omówienie
Wskazania do wszczepienia ICD można sklasyfikować jako prewencję wtórną – po wystąpieniu groźnych zaburzeń rytmu serca – lub prewencję pierwotną.
Profilaktyka wtórna dotyczy pacjentów, którzy przeżyli zatrzymanie krążenia w mechanizmie migotania komór wywołanego przyczynami nieodwracalnymi lub niestabilny, trwały częstoskurcz komorowy. Implantację ICD w ramach prewencji wtórnej należy rozważyć także u chorych po omdleniu, obciążonych kardiologicznie, z wynikami badań sugerującymi jako przyczynę tachyarytmię komorową, np. po wykonaniu inwazyjnego badania elektrofizjologicznego, w którym indukowano trwały, monomorficzny częstoskurcz komorowy. Należy podkreślić, że w przypadku świeżego zawału serca powyższe wskazania dotyczą pacjentów, u których groźne dla życia komorowe zaburzenia rytmu wystąpiły po 48 godzinach od czasu niedokrwienia.
Zalecenia implantacji kardiowerterów-defibrylatorów w ramach prewencji wtórnej sformułowano na podstawie randomizowanych badań klinicznych (tab. 1).
Tabela 1. Podsumowanie głównych randomizowanych prób klinicznych dotyczących wszczepienia ICD w pierwotnej prewencji nagłego zgonu po zawale mięśnia sercowego*, KpD 2009 Kw. 8 (4).
| Badanie | Kryteria włączenia | Czas od MI kwalifikującego do udziału w badaniu | Frakcja wyrzutowa u osób włączonych do badania | Umieralność ogólna | Zmniejszenie śmiertelności dzięki leczeniu za pomocą ICD |
| Kryterium włączenia | Rzeczywista wartość | Grupa kontrolna | Grupa ICD | Względne | Bezwzględne |
| | % | % pacjentów | % zmniejszenia |
| MADIT (analiza po 2 latach) | EF ≤ 35%, przebyty MI, nieutrwalony VT, VT indukowany podczas badania elektrofizjologicznego i nieustępujący po podaniu leków antyarytmicznych | ≥ 3 tygodnie | ≥ 6 miesięcy w 75% przypadków | 26 ? 7 | 32 | 13 | 59 | 19 |
| MUSTT (analiza po 5 latach)** | EF ≤ 40%,przebyty MI, nieutrwalony VT, indukowany VT podczas badania elektrofizjologicznego | nieokre-ślony | ≥ miesiąc w 16% przypadków, 3 lata w 49% przypadków | Mediana 30 (rozstęp międzykwartałowy 21-35) | 55 | 24 | 58 | 31 |
| MADIT II (analiza po 2 latach) | EF ≤ 30%, przebyty MI | ≥ miesiąc | ≥ 6 miesiecy w 88% przypadków | 23 ? 5 | 22 | 16 | 28 | 6 |
| SCD-HeFT | zastoinowa niewydolność serca w II-III klasie wg HYHA w przebiegu choroby wieńcowej lub kardiomiopatii innej niż niedokrwienna | nieokreślony | Mediana 4,3 roku | Mediana 25 (rozstęp międzykwartylowy 20-30) | 36 | 29 | 23 | 7 |
| DINAMIT (analiza po 2,5 roku) | EF ≤ 35%, niedawno przebyty MI, nieprawidłowa HRV | 6-40 dni | średnio 18 dni | 28 ? 5 | 17 | 19 | - | - |
*Wartości ze znakiem ± to średnie ± odchylenie standardowe. DINAMIT – Defibrillators In Acute Myocardial Infarction Trial, EF – frakcja wyrzutowa, HRV – zmienność czynności rytmu serca, ICD – implantowany kardiowerter-defibrylator; MADIT – Multicenter Automatic Defibrillator Implantation Trial; MADIT II – Multicenter Automatic Defibrillator Implantation Trial II; MI – zawał mięśnia sercowego; MUSTT – Multicenter Unsustained Tachykardia Trial; NYHA – New York Heart Association; SCD-HeFT – Sudden Cardiac Death Hart Failure Trial.
**W przypadku podanych tutaj wyników badania MUSTT umieralność ogólna oraz względne i bezwzględne zmniejszenie ryzyka dotyczą grupy, w której stosowano leczenie antyarytmiczne zależnie od wyniku badania elektrofizjologicznego, w porównaniu z podgrupą leczoną za pomocą ICD, w której u większości uczestników badanie elektrofizjologiczne wykazało nieskuteczność farmakoterapii.
Badanie AVID (Antiarrhythmic Versus Implantable Defibrillator) było pierwszym, które potwierdziło większą przeżywalność u pacjentów z wszczepionym ICD w porównaniu z chorymi przyjmującymi leki antyarytmiczne (głównie amiodaron) (6). Względne zmniejszenie ryzyka śmierci dzięki leczeniu za pomocą ICD wyniosło w tym badaniu 27%, zaś bezwzględne 7%. Podobne wyniki uzyskano w badaniu CIDS (Canadian Implantable Defibrillator Study) oraz CASH (Cardiac Arrest Study of Hamburg) (7, 8). Warto podkreślić, że do badań włączeni zostali pacjenci, u których groźne komorowe arytmie wystąpiły po 72 godzinach od zawału. Bardzo ważnym czynnikiem predykcyjnym jest stopień uszkodzenia lewej komory, co udowodniono w badaniu AVID, w którym wykazano istotne zmniejszenie śmiertelności u pacjentów z implantowanym ICD, z frakcją wyrzutową lewej komory poniżej 35% (LVEF<35%).
Prewencja pierwotna. Kwalifikacja do implantacji ICD w prewencji pierwotnej jest dużo trudniejsza i polega na zdefiniowaniu grupy chorych, u których na podstawie dużych badań klinicznych spodziewać się można groźnych zaburzeń rytmu w przyszłości.
Dotyczy pacjentów narażonych na groźne komorowe zaburzenia rytmu, u których nie wystąpiło migotanie komór ani trwały, niestabilny hemodynamicznie częstoskurcz komorowy. Według ostatnich zaleceń towarzystw amerykańskich (ACC/AHA/HRS 2008 Guidelines for Device Based Therapy of Cardiac Rhythm Abnormalities) kandydatami do implantacji kardiowertera-defibrylatora są:
1. Pacjenci z LVEF <35%, NYHA II-III,> 40 dni po przebytym zawale serca [I/A].
2. Pacjenci z LVEF <30%, NYHA I,> 40 dni po przebytym zawale serca [I/A].
3. Chorzy z LVEF> 40%, z nieutrwalonym częstoskurczem komorowym na skutek przebytego zawału serca, indukowanym VF lub trwałym VT w badaniu elektrofizjologicznym (EPS).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Zipes D, Camm J, Borggrefe et al.: ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force and the EuropeanSociety of Cardiology Committee for Practice Guidelines (Writing Committee to develop Guidelines for Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death). Jam Coll Cardiol 2006; 5: e247-346 Europace 2006; 8: 746-837.
2. F. Van de Werf J, Bax A, Betriu C et al.: Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: the Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology. European Heart Journal 2008; 29: 2909-2945.
3. Zipes D, Roberts D: Results of the international study of the implantable pacemaker cardioverter: a comparison of epicardial and endocardial lead systems. Circulation 1995; 92: 59-65.
4. Zipes D, Libby P, Bonow R, Brauwald E: Braunwald's Heart Disease 7th Edition.
5. Goldberger JJ, Passman R: Implantable cardioverter-defibrillator therapy after acute myocardial infarction: the results are not shocking. J Am Coll Cardiol 2009 Nov 24; 54 (22): 2001-5.
6. The Antiarrhytmics Versus Implantable Defibrillators (AVID) Investigators. A comparison of antiarrhytmic drug therapy with implantable defibrillators in patietnts resuscitated from near – fatal ventricular arrhytmias. N Engl J Med 1997; 337: 1576-80.
7. Conolly SJ, Gent M, Roberts RS et al.: on behalf of the CIDS Investigators. Canadian Implantable Defibrillator study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation 2000; 101: 1297-302.
8. Kuck KH, Cappato R, Siebels J, Ruppel R: Randomized comparison of anriarrhytmic drug therapy withimplantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest study Hamburg (CASH). Circulation 2000; 102: 748-54.
9. Vardas PE, Auricchio A, Blanc JJ et al.: European Society of Cardiology; European Heart Rhythm Association: Guidelines for cardiac pacing and cardiac resynchronization therapy. The Task Force for Cardiac Pacing and Cardiac Resynchronization Therapy of the European Society of Cardiology. Developed in collaboration with the European Heart Rhythm Association. Eur Heart J 2007; 28 (18): 2256-95. Epub 2007 Aug 28.
10. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). Eur J Heart Fail 2008; 10 (10): 933-89.
11. Buxton AE, Lee KL, Fisher JD et al.: for the Multicenter Unsustained Tachycardia Trial Investigators. A randomized study of the prevention of sudden death in patients with coronary artery disease. N Engl J Med 1999; 341: 1882-90.
12. Greenberg H, Case RB, Moss AJ et al.: Analysis of mortality events in the mortality events in the Multicenter Automatic Defibrillator Implantation Trial (MADIT-II). J Am Coll Cardiol 2004; 43: 1459-1465.
13. Bardy GH, Lee KL, Mark DB et al.: for the Sudden Cardiac death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005; 352: 225-37.
14. Steinbeck G, Andresen D, Senges J et al.: Immediate Risk-Stratification Improves Survival (IRIS): study protocol. Europace 2004; 6: 392-9.
15. Moss Aj, Hall WJ, Cannom DS et al.: Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J 1996; 335: 1933-40.
16. Goldberger JJ, Passman R: Implantable Cardioverter-defibrillator therapy after acute myocardial infarction: the results are not shocking. J Am Coll Cardiol 2009, 24: 54 (22): 2001-5.
17. Mountantonakis S, Hutchinson MD: Who should receive an implantable cardioverter defibrillator after myocardial infarction? Curr Heart Fail Rep 2009 Dec; 6 (4): 236-44
18. Myerburg R: Stosowanie implantowanych kardiowerterów-defibrylatorów u osób po zawale mięśnia sercowego. KpD 2009; 8 (4): 12-25.
19. Myerburg RJ, Reddy V, Castellanos A: Indications for implantable cardioverter-defibrillators based on evidence and judgment. J Am Coll Cardiol 2009; 54 (9): 747-63.




