© Borgis - Postępy Nauk Medycznych 4/2012, s. 362-370
*Tomasz Szopiński1, Jakub Dobruch1, Piotr L. Chłosta1, 2, Andrzej Borówka1, 2
Leczenie farmakologiczne łagodnego rozrostu stercza (BPH)
Medical treatment of benign prostatic hyperplasia (BPH)
1I. Zespół Dydaktyki Urologicznej Kliniki Urologii Centrum Medycznego Kształcenia Podyplomowego, Oddział Urologii Europejskiego Centrum Zdrowia w Otwocku
Kierownik Zespołu: prof. dr hab. med. Andrzej Borówka
2Kliniczny Dział Urologii Świętokrzyskiego Centrum Onkologii w Kielcach
Kierownik Działu: prof. dr hab. med. Piotr L. Chłosta
Streszczenie
Łagodny rozrost gruczołu krokowego (BPH – benign prostatic hyperplasia) jest najczęstszą chorobą układu moczowo--płciowego u mężczyzn powyżej 50. roku życia. Stanowi niejednorodny zespół zmian patofizjologicznych oraz objawów i dolegliwości, których nasilenie i wzajemny udział u różnych chorych nie jest jednakowy. Elementami tego zespołu są: powiększenie gruczołu krokowego (BPE – benign prostatic enlargement), przeszkoda podpęcherzowa (BPO – benign prostatic obstruction) oraz objawy ze strony dolnych dróg moczowych (LUTS – lower urinary tract symptoms), na które składają się objawy fazy gromadzenia moczu w pęcherzu i fazy wydalania moczu z pęcherza. Rozpoznanie powiększenia stercza oraz określenie nasilenia LUTS i obiektywnych mierników sprawności mikcji jest proste.
Celem leczenia chorych na łagodny rozrost stercza jest wyeliminowanie lub złagodzenie LUTS oraz zapobieżenie niekorzystnym następstwom i powikłaniom choroby. Dostępnych jest wiele powszechnie stosowanych metod leczenia BPH. Wśród nich farmakoterapia ma istotne znaczenie.
Artykuł zawiera przegląd aktualnej wiedzy dotyczącej patofizjologii i rozpoznania BPH, a zwłaszcza leczenia farmakologicznego chorych na BPH.
Summary
Benign prostatic hyperplasia (BPH) is the most popular urological problem in men over the 50 years old. It is complex with regard to pathophysiology as well as signs and symptoms which differ among patients in intensity. The following elements create this entity i.e.: benign prostatic enlargement (BPE), benign prostatic obstruction (BPO) and lower urinary tract symptoms (LUTS) which include storage and voiding symptoms. Diagnosis of prostatic enlargement, severity of LUTS and micturation objective parameters is simple.
Aims of BPH patients treatment are reduction of LUTS inhibition of progression and complications of the disease.
There are many commonly used methods of treatment of BPH, including pharmacotherapy. This review presents actual knowledge on pathopysiology and diagnosis of BPH, with emphasis on pharmacological treatment.

Wstęp
Gruczoł krokowy (stercz, łac. – prostata, ang. – prostate) należy do układu męskich narządów płciowych. Znajduje się w bezpośrednim sąsiedztwie dna pęcherza moczowego oraz przepony moczowo-płciowej i otacza tylny odcinek cewki moczowej. Dlatego zmiany w obrębie stercza wywierają wpływ na stan dróg moczowych i często bywają powodem zaburzeń w oddawaniu moczu. Miąższ stercza jest utworzony przez elementy gruczołowe oraz zrąb zbudowany z tkanki łącznej i włókien mięśni gładkich. Struktura gruczołu krokowego nie jest jednorodna. Według Mc Neala, tworzą ją cztery strefy różniące się od siebie cechami morfologicznymi i czynnościowymi oraz podlegające różnym procesom patologicznym (ryc. 1):
– strefa obwodowa (peripherial zone),
– strefa przejściowa (transition zone),
– strefa środkowa (central zone),
– część przednia, zwana spoidłem lub przegrodą przednią (anterior septum).
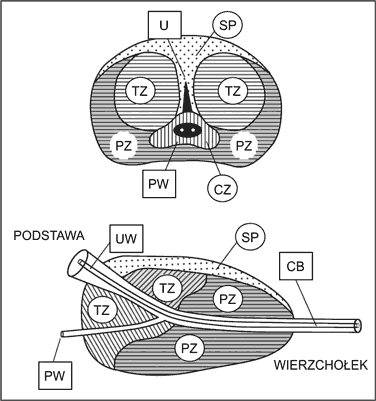
Ryc. 1. Schemat budowy strefowej stercza: góra – przekrój w płaszczyźnie czołowej, dół – przekrój w płaszczyźnie strzałkowej. Znaczenie akronimów: UW – ujście wewnętrzne cewki, CB – odcinek błoniasty cewki, TZ (transitional zone) – strefa przejściowa, CZ (central zone) – strefa środkowa, SP – spoidło przednie, PW – przewód wytryskowy, U (utriculus) – łagiewka sterczowa (1).
Strefa obwodowa jest pierwotnym miejscem rozwoju raka. Łagodny rozrost (BPH – benign prostatic hyperplasia), polegający na zwiększeniu liczby komórek zrębu i frakcji gruczołowej, dotyczy strefy przejściowej stercza. Rozrost w tym obszarze prowadzi do powstania struktury określanej mianem gruczolaka. Gruczolak jest objęty przez tzw. torebkę chirurgiczną, którą tworzy tkanka zepchniętej na zewnątrz strefy obwodowej i tkanka spoidła przedniego. Ilościowy udział zrębu włóknisto-mięśniowego oraz elementów gruczołowych w rozroście gruczołu krokowego jest osobniczo różny i stanowi podstawę do wyodrębnienia odmiennych typów histopatologicznych BPH – od typu z dużą przewagą utkania zrębowego po typ z dominacją tkanki gruczołowej, przy czym najczęściej występuje rozrost o charakterze włóknisto-mięśniowo-gruczolakowatym.
Stercz jest narządem hormonozależnym i podlega wpływowi hormonów płciowych – rozwój i rozrost frakcji gruczołowej stymulują androgeny, estrogeny wywierają wpływ na zrąb stercza. Rozrost zrębu oddziałuje również na komórki gruczołowe, pobudzając je także do rozrostu. Istnieją przesłanki sugerujące, że do BPH dochodzi w wyniku działania czynników wzrostowych (growth factors) na zrąb gruczołu krokowego i część gruczołową jego strefy przejściowej. Inna teoria stanowi, że rozrost stercza powstaje w wyniku zaburzenia równowagi ilościowej pomiędzy liczbą komórek obumierających w następstwie apoptozy a liczbą komórek nowopowstających. Przyjmuje się, że rozwój BPH jest następstwem kilku różnych, jednak łącznie działających procesów patologicznych. Wiadomo, że czynnikami niezbędnymi dla powstania tej choroby są czynność hormonalna jąder (BPH nie występuje u mężczyzn pozbawionych jąder przed okresem dojrzałości płciowej) oraz proces starzenia (BPH występuje na ogół u mężczyzn ponad 60-letnich).
Gruczolak uciska odcinek sterczowy cewki moczowej i tym samym może stanowić przeszkodę podpęcherzową oraz powodować objawy i dolegliwości ze strony dolnych dróg moczowych (LUTS – lower urinary tract symptoms). Niemniej, BPH stanowi niejednorodny zespół zmian patofizjologicznych oraz objawów i dolegliwości, których nasilenie i wzajemny udział u różnych chorych nie jest jednakowy.
Elementami tego zespołu są:
– powiększenie gruczołu krokowego (BPE – benign prostatic enlargement);
– przeszkoda podpęcherzowa (BPO – benign prostatic obstruction);
– objawy i dolegliwości ze strony dolnych dróg moczowych (LUTS), na które składają się objawy przeszkody podpęcherzowej i objawy podrażnienia pęcherza moczowego;
– zaburzenia czynności mięśnia wypieracza moczu (BD – bladder dysfunction), będące następstwem utrzymywania się BPE przez długi czas, a także związane ze starzeniem się.
Różne możliwości udziału tych elementów ilustrują ryciny 2 i 3. Schemat przedstawiony na rycinie 3 unaocznia, że nie ma bezpośredniego związku między stopniem powiększenia stercza i nasileniem dolegliwości związanych z oddawaniem moczu oraz nasileniem przeszkody podpęcherzowej. Należy przy tym podkreślić, że uciążliwość LUTS i ich wpływ na pogorszenie jakości życia są u różnych mężczyzn odmienne, np. dla niektórych konieczność 3-krotnego oddawania moczu w nocy nie jest kłopotliwa, zaś inni nie są w stanie zaakceptować nykturii o znacznie mniejszym nasileniu. U niektórych chorych dominuje powiększenie stercza ze znikomymi objawami przeszkody podpęcherzowej i niewielkimi dolegliwościami. U innych zaś stercz jest nieznacznie powiększony, jednak dolegliwości są duże, a przeszkoda podpęcherzowa niewielka. U jeszcze innych chorych występuje istotne utrudnienie odpływu moczu z pęcherza, a stercz jest mały i dolegliwości znikome.
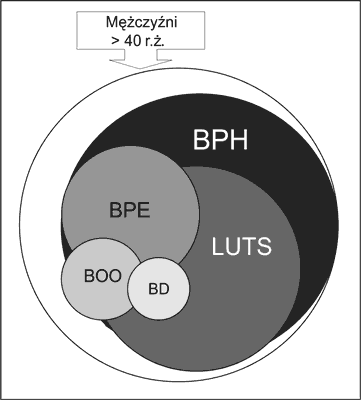
Ryc. 2. Wzajemny udział składowych zespołu klinicznego BPH: BPH-h – cechy histologiczne łagodnego rozrostu stercza, LUTS – objawy i dolegliwości ze strony dolnych dróg moczowych zależne od BPH, BPE – powiększenie stercza wskutek rozwoju gruczolaka, BOO – przeszkoda podpęcherzowa, BD – dysfunkcja mięśnia wypieracza (2).
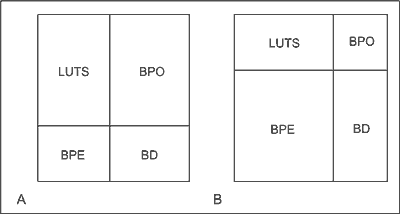
Ryc. 3. Ilustracja dwóch różnych wariantów wzajemnego udziału poszczególnych elementów składających się na zespół BPH.
A – chory ze znacznie nasilonymi LUTS i znacznie nasiloną przeszkodą podpęcherzową (BPO), u którego powiększenie stercza (BPE) i nasilenie zaburzeń czynności pęcherza moczowego (BD) są nieznaczne.
B – chory ze znacznie powiększonym gruczołem krokowym (BPE), u którego nasilenie przeszkody podpęcherzowej (BPO) jest znikome, a nasilenie LUTS i nasilenie BD są niewielkie.
Nasilenie LUTS, ich ujemny wpływ na jakość życia chorych oraz przeszkoda podpęcherzowa, która może doprowadzić do powikłań w postaci zakażenia dróg moczowych, rosnącego zalegania moczu w pęcherzu, rozstrzeni pęcherza, a nawet przewlekłej niewydolności nerek, są głównymi przesłankami zmuszającymi do wszczęcia leczenia chorych na BPH (3). Najczęstszymi objawami BPH są: częstomocz, konieczność oddawania moczu w nocy, zwężenie strumienia moczu, częste gwałtowne parcie na mocz i wydłużenie czasu mikcji. Objawy i dolegliwości ze strony dolnych dróg moczowych (LUTS) towarzyszące BPH możemy podzielić na dwie grupy – objawy podrażnienia i objawy świadczące o przeszkodzie podpęcherzowej (tab. 1) (4). Przeszkoda podpęcherzowa utrzymująca się długo prowadzi do rozstrzeni pęcherza. Jej przejawem jest stałe, bezwiedne wyciekanie moczu z pęcherza przez cewkę (ischuria paradoxa). Krwiomocz w przebiegu BPH zdarza się stosukowo rzadko. Jego wystąpienie zawsze wymaga przeprowadzenia badań, mających na celu wykrycie lub wyłączenie nowotworu narządów układu moczowego.
Tabela 1. Najczęściej występujące objawy i dolegliwości towarzyszące łagodnemu rozrostowi stercza.
| Objawy fazy gromadzenia moczu w pęcherzu („podrażnienia” pęcherza) | Objawy fazy wydalania moczu z pęcherza (przeszkody podpęcherzowej) |
– częstomocz
– oddawanie moczu w nocy
– gwałtowne parcie na mocz
– brak możliwości powstrzymania mikcji
– ból w czasie mikcji | – wyczekiwanie na mikcję
– zwężenie strumienia moczu
– wydłużenie czasu mikcji
– przerywany strumień moczu
– wykapywanie moczu z cewki po mikcji
– uczucie niecałkowitego opróżnienia pęcherza |
W celu zobiektywizowania oceny nasilenia dolegliwości mikcyjnych opracowano kilka metod umożliwiających określenie ilościowe LUTS, w których wykorzystuje się kwestionariusze (np. I-PSS – International Prostate Symptom Score, AUA-SS – American Urological Association Symptom Score, Boyarsky Score) zawierające pytania na temat poszczególnych dolegliwości. Odpowiedzi na pytania udziela chory. Każdej z nich jest przypisana odpowiednia liczba punktów. Kwestionariuszem rozpowszechnionym w Polsce i w innych krajach europejskich jest I-PSS (5). Pozwala on określić nasilenie LUTS na podstawie sumy punktów, wynikającej z wybranych przez chorego odpowiedzi na pytania kwestionariusza (tab. 2). Integralną częścią I-PSS jest pytanie o jakość życia (QoL – quality of life) zależną od LUTS. QoL określa się w skali od 0 do 6 punktów.
Tabela 2. Stratyfikacja nasilenia dolegliwości i objawów ze strony dolnych dróg moczowych (LUTS) u chorych na łagodny rozrost stercza, oparta na kwestionariuszu I-PSS.
| Liczba punktów | Nasilenie LUTS |
| ≤ 7 | Nie występują lub są znikome |
| 8-19 | Umiarkowane |
| 20-35 | Znaczne |
Badanie fizykalne w przypadku podejrzenia BPH obejmuje badanie jamy brzusznej i zewnętrznych narządów płciowych oraz badanie stercza palcem przez odbytnicę (DRE). Zasadniczą metodą oceny stopnia zasilenia BPO jest pomiar tempa przepływu moczu przez cewkę w czasie naturalnej mikcji (uroflowmetria). Wynik badania jest miarodajny, jeśli objętość mikcji nie jest mniejsza od 150 ml. Uroflowmetria umożliwia określenie szeregu mierników obiektywnych mikcji. Najważniejszym spośród nich jest maksymalny przepływ cewkowy (Qmax) – w warunkach prawidłowych u mężczyzn przewyższa on 15 ml/s. Pośrednią miarą przeszkody podpęcherzowej i sprawności mięśnia wypieracza jest zaleganie moczu w pęcherzu po mikcji (Rv). Określa się je metodą TAUS.
Badania laboratoryjne, których wykonanie w ramach procesu diagnostycznego u chorych na BPH jest potrzebne, obejmują: badanie ogólne moczu (stwierdzenie wzmożonej leukocyturii sugerujące istnienie zakażenia dróg moczowych jest wskazaniem do wykonania posiewu moczu), oznaczenie stężenia kreatyniny w surowicy oraz stężenia swoistego antygenu sterczowego (PSA – prostate-specific antigen) w surowicy. Nieprawidłowy wynik ostatniego z wymienionych może sugerować istnienie raka stercza i skłania do wykonania dalszych badań w tym kierunku.
TAUS wykonuje się u chorych na BPH rutynowo. Pozwala ona na określenie stanu nerek i górnych dróg moczowych, oraz pęcherza moczowego i objętości zalegającego w nim moczu po mikcji, a także umożliwia poznanie przybliżonej objętości stercza i stwierdzenie, czy powiększony stercz wpukla się do pęcherza. U chorych, u których istnieje potrzeba dokładnego określenia objętości stercza i jego konfiguracji, wykonuje się TRUS. Jeśli ocena stopnia dysfunkcji pęcherza moczowego jest konieczna, dokonuje się jej na podstawie badania urodynamicznego (test ciśnieniowo-przepływowy).
Przeszkoda podpęcherzowa (BPO) u chorych na BPH spowodowana jest przez dwa czynniki:
– mechaniczny, polegający na uciśnięciu cewki moczowej przez powiększony gruczoł krokowy,
– dynamiczny, spowodowany przez skurcz włókien mięśniowych gładkich zrębu stercza, sterczowego odcinka cewki i okolicy ujścia wewnętrznego cewki.
Element dynamiczny BPO stanowi u wielu chorych niemal 50% globalnego oporu cewkowego (6). Początkowo uważano, że LUTS związane są jedynie z przeszkodą podpęcherzową w wyniku BPE. Teraz wiadomo, że po potwierdzonym urodynamicznie zniesieniu przeszkody podpęcherzowej w wyniku leczenia operacyjnego, dochodzi do redukcji głównie objawów fazy opróżniania, natomiast objawy fazy napełniania nierzadko utrzymują się nadal (7). Przyczyną tego stanu bywa przetrwałe zaburzenie czynności pęcherza związane z nadaktywnością mięśnia wpieracza (OAB – overactive bladder, DOA – detrusor overactivity) (8). Stwierdzono, że OAB związana z przeszkodą podpęcherzową zależną od BPO występuje dwukrotnie częściej niż u mężczyzn bez BPO (9). Należy również podkreślić, że na nasilenie LUTS może wpływać przewlekłe zapalenie stercza („podrażnienie” dolnych dróg moczowych) oraz niewydolność nerek (wielomocz), a także zaburzenia sercowo-naczyniowe (wielomocz nocny) (3, 10).
Łagodny rozrost stercza rozpoznaje się zwykle u mężczyzn powyżej 50. roku życia. Na podstawie długoterminowego badania dotyczącego procesów starzenia, przeprowadzonego w Baltimore, USA (BLSA – Baltimore Longitudinal Study on Aging) stwierdzono, że objawy kliniczne BPH występują u około 60% mężczyzn w wieku 60 lat (11). Natomiast dane uzyskane w ramach badania przeprowadzonego w populacji ogólnej mężczyzn w wieku 40-79 lat mieszkających w amerykańskim hrabstwie Olmsted (Olmsted County Study) wskazują, że LUTS o co najmniej umiarkowanym nasileniu dotyczą 13% mężczyzn w wieku 40-49 lat oraz 28% mężczyzn w wieku powyżej 70 lat (12). Dane dotyczące epidemiologii BPH w Polsce są skąpe, niemniej wynika z nich, że objawy sugerujące istnienie BPH występują u około 50% mężczyzn powyżej 50. roku życia (13). Ocenia się, że liczba mężczyzn dotkniętych tą chorobą w Polsce znacznie przewyższa 2 miliony (14).
Cel leczenia BPH
Wskazania do leczenia BPH ustala się na podstawie nasilenia LUTS oraz następstw BPO. Biorąc pod uwagę postępujący charakter choroby oraz wpływ objawów powodowanych przez BPH można wyznaczyć dwa zasadnicze cele leczenia:
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. McNeal JE: Origin and evolution of benign prostatic enlargement. Invest Urol 1978; 15: 340-345.
2. Roehrborn CG: Pathology of benign prostatic hyperplasia. Int J Impot Res 2008; 20 (Suppl 3). 11-18.
3. Mark J, Speakman MJ: Lower Urinary Tract Symptoms Suggestive of Benign Prostatic Hyperplasia (LUTS/BPH): More Than Treating Symptoms? Eur Urol Supplements 2008; 7: 680-689.
4. Abrams P, Cardozo L, Fall M et al.: The standardization of terminology of lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society. Am J Obstet Gynec 2002; 187: 116-126.
5. Maruschke M, Protzel C, Hakenberg OW: How to make diagnosis of benign prostatic disease. Eur Urol supplements 2009; 8: 490-495.
6. Franks LM: Benign prostatic hypertrophy: gross and microscopic anatomy. US Dept. of Health Education and Welfare. NIH Publications 1996; 63-76.
7. Madersbacher S, Marberger M: Is transurethral resection of the prostate still justified? BJU Int 1999; 83: 227-237.
8. Thomas AW, Cannon A, Bartlett E et al.: The natural history of lower urinary tract dysfunction in men: minimum 10-year urodynamic follow-up of transurethral resection of prostate for bladder outlet obstruction. J Urol 2005; 174: 1887-1891.
9. Neal DE, Ramsden PD, Sharples L et al.: Outcome of elective prostatectomy. Brit Med J 1989; 299: 762-767
10. Shahin O: When to treat the prostate, the bladder, or both? Eur Urol Supplements 2008; 7: 690-695.
11. Chute CG, Panser LA, Girman CJ et al. : The prevalence of prostatism: a population-based survey of urinary symptoms. J Urol 1993; 150(1): 85-89.
12. Garraway WM, Collins GN, Lee RJ: High prevalence of benign prostatic hypertrophy in the community. Lancet 1991; 338: 469-471
13. Pająk A, Borówka A: Częstość występowania dolegliwości ze strony dolnych dróg moczowych u mężczyzn w wieku 50-79 lat. Wyniki pierwszych badań epidemiologicznych przeprowadzonych w Polsce. Urol Pol 1998; 51 (supl. 1a); 10-11, abstr. 5.
14. Kwias Z, Borówka A: Łagodny rozrost stercza – podstawowe wiadomości dla lekarza rodzinnego. Przewodnik Lekarza 2001; 10: 116-126.
15. Chapple CR, Roehrborn CG: A shifted paradigm for the further understanding, evaluation, and treatment of lower urinary tract symptoms in men: focus on the bladder. Eur Urol 2006; 49: 651-658.
16. Dobruch J, Borówka A, Chłosta P et al.: Znaczenie efektu placebo i efektu nocebo w badaniach nad skutecznością leczenia farmakologicznego chorych na łagodny rozrost stercza. Urol Pol 2004; 57 (4): 21-31.
17. Vela-Navarrete R, Gonzalez-Enguita C, Garcia-Cardoso JV et al.: The impact of medical therapy on surgery for benign prostatic hyperplasia: a study comparing changes in a decade (1992-2002). BJU Int 2005; 96: 1045-1048.
18. Rassweiler J, Teber D, Kuntz R, Hofmann R: Complications of transurethral resection of the prostate (TURP) – incidence, management, and prevention. Eur Urol 2006; 50: 969-980.
19. Rassweiler J, Teber D, Kuntz R, Hofmann R: Complications of transurethral resection of the prostate (TURP) – incidence, management, and prevention. Eur Urol 2006; 50: 969-80.
20. Madersbacher S: Urodynamics prior to prostatectomy: pro. Eur Urol 2004; 45: 557-600.
21. Michel M, Rosette J: Medical treatment of lower urinary tract symptoms suggestive of benign prostatic hyperplasia. Eur Urol Supplements 2009; 8: 496-503.
22. Marks L, Gittelmann MC, Hill LA, Volinn W, Hoel G: Rapid efficacy of the highly selective alpha 1A-adrenoceptor antagonists silodosin in men with signs and symptoms of benign prostatic hyperplasia: pooled results of 2 phase 3 studies. J Urol 2009; 181: 2634-2640.
23. Montorsi F: Profile of silodosin. Eur Urol Supplements 2010; 9: 491-495.
24. Chang DF, Campbell JR: Intraoperative floppy iris syndrome associated with tamsulosin. J Cataract Referact Surg 2005; 31: 664-673.
25. Avisar R, Weinberger D: Intraoperative floppy iris syndrome: possible relationship with alpha-1 adrenergic receptor antagonists. IMAJ 2009; 11: 42-44.
26. Rittmaster RS, Norman RW, Thomas LN et al.: Evidence for atrophy and apoptosis in the prostates of men given finasteride. J Clin Endocrinol Metab 1996; 81: 814-819.
27. Dorsam J, Altwein J: 5 alpha-reductase inhibitor treatment of prostatic diseases: background and practical implications. Prostate Cancer Prostatic Dis 2009; 12: 130-136.
28. Nickel JC: Comparison of clinical trials with finasteryde and dutasteride. Reviews in Urology 2004; 6 Suppl 9: 31-39.
29. McConnell JD, Roehrborn CG, Bautista O et al.: Medical Therapy of Prostatic Symptoms (MTOPS) Research Group. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003; 349: 2387-2398.
30. Kirby R, Roehrborn CG, Boyle P et al.: Prospective European Doxazosin and Combination Therapy Study Investigators. Efficacy and tolerability of doxazosin and finasteride, alone or in combination, in treatment of symptomatic benign prostatic hyperplasia: the Prospective European Doxazosin and Combination Therapy (PREDICT) trial. Urology 2003; 61: 119-126.
31. Roehrborn CG, Siami P, Barkin J et al.: The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombATstudy. Eur Urol 2010; 57: 123-131.
32. McConnell JD, Bruskewitz R, Walsh P et al.: The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N Engl J Med1998; 338: 557-563.
33. Naslund MJ, Miner M: A review of the clinical efficacy and safety of 5α-reductase inhibitors for the enlarged prostate. Clin Ther 2007; 29: 17-25.
34. Crea G, Sanfilippo G, Anastasi G et al.: Pre-surgical finasteride therapy in patients treated endoscopically for benign prostatic hyperplasia. Urol Int 2005; 74(1): 51-53.
35. Donohue JF, Sharma H, Abraham R et al.: Transurethral prostate resection and bleeding: a randomized, placebo controlled trial of the role of finasteride for decreasing operative blood loss. J Urol 2002; 168: 2024-2026.
36. Thompson IM, Goodman PJ, Tangen CM et al.: The influence of finasteride on the development of prostate cancer. N Engl J Med 2003; 349(3): 215-224.
37. Lepor H, Williford WO, Barry MJ et al.: The efficacy of terazosin, finasteride or both in benign prostatic hypertrophy. N Engl J Med 1996; 335: 533-539.
38. Borkowski A, Sosnowski M, Wolski Z et al.: Rola farmakoterapii skojarzonej w leczeniu BPH i męskich LUTS. Przegląd Urologiczny 2011; 2(66) suplement: 1-12.
39. Kaplan SA, Roehrborn CG, Dmochowski R et al.: Tolterodine extended release improves overactive bladder symptoms in men with overactive bladder and nocturia. Urology 2006; 68: 328-332.
40. KS, Choo MS, Kim DY et al.: Combination treatment with propiverine hydrochloride plus doxazosin controlled release gastrointestinal therapeutic system formulation for overactive bladder and coexisting benign prostatic obstruction: a prospective, randomized, controlled multicenter study. J Urol 2005; 174: 1334-1338.
41. Kaplan SA: Update on the American Urological Association guidelines for the treatment of benign prostatic hyperplasia. Rev Urol 2006; 8(Suppl. 4): S10-S17.
42. Roos NP, Wennberg JE, Malenka DJ et al.: Mortality and reoperation after open and ransurethral resection of the prostate for benign prostatic hyperplasia. N Engl J Med 989; 320: 1120-1144.
43. Jacobsen SJ, Girman CJ, Guess HA et al.: Natural history of prostatism: longitudinal changes in voiding symptoms in community dwelling men. J Urol 1996; 155: 595-600.
44. Roberts RO, Jacobsen SJ, Jacobson DJ et al.: Longitudinal changes in peak urinary flow rates in a community based cohort. J Urol 2000; 163: 107-113.
45. Kohler T, McVary K: The relationship between erectile dysfunction and lower urinary tract symptoms and the role of phosphodiesterase type 5 inhibitos. Eur Urol 2009; 55: 38-48.
46. McVary KT, Monnig W, Camps Jr JL et al.: Sildenafil citrate improves erectile function and urinary symptoms in men with erectile dysfunction and lower urinary tract symptoms associated with benign prostatic hyperplasia: a randomized, double-blind trial. J Urol 2007; 177(3): 1071-1077.
47. Stief CG, Porst H, Neuser D et al.: A randomised, placebo-controlled study to assess the efficacy of twice-daily vardenafil in the treatment of lower urinary tract symptoms secondary to benign prostatic hyperplasia. Eur Urol 2008; 53: 1236-1244.
48. Roehborn CG, McVary KT, Elion-Mbousa A et al.: Tadalafil administered once daily for lower urinary tract symptoms secondary to benign prostatic hyperplasia: a dose finding study. J Urol 2008; 180: 1228-1234.
49. Kaplan SA, Gonzalez RR, Te AE: Combination of alfuzosin and sildenafil is superior to monotherapy in treating lower urinary tract symptoms and erectile dysfunction. Eur Urol 2007; 51: 1717-1723.
50. Liguori G, Trombetta C, De Giorgi G et al.: Efficacy and safety of combined oral therapy with tadalafil and alfuzosin: an integrated approach to the management of patients with lower urinary tract symptoms and erectile dysfunction. Preliminary report. J Sex Med 2009; 6: 544-552.



