© Borgis - Postępy Nauk Medycznych 7/2013, s. 501-505
*Joanna Bienias, Anna Mazur, Katarzyna Błaszczyńska, Dorota Król, Stanisław Dyląg
Ocena krwinek płytkowych po procesie kriokonserwacji
Platelets estimation after cryopreservation
Regional Center of Blood Donation and Treatment, Katowice
Head of Regional Center: Stanisław Dyląg, Pharm D, PhD
Streszczenie
Wstęp. Koncentraty krwinek płytkowych stosuje się w leczeniu krwawień u pacjentów z małopłytkowością, w celu zapobiegania spontanicznym krwotokom oraz w czasie inwazyjnych zabiegów chirurgicznych. Metodą pozwalającą na dłuższe przechowywanie koncentratów jest kriokonserwacja.
Cel pracy. Celem pracy było sprawdzenie, czy metoda otrzymywania koncentratów krwinek płytkowych wpływa na liczbę odzyskanych płytek krwi po procesie kriokonserwacji.
Materiał i metody. Analizy prowadzono od czerwca 2006 do stycznia 2010 roku i objęły one 160 koncentratów krwinek płytkowych wcześniej wykonanych metodą aferezy i przez zlewanie kożuszków leukocytarno-płytkowych. Płytki krwi zamrażano, stosując jako środek krioochronny 5% dwumetylosulfotlenek (DMSO) i przechowywano w temperaturze -80°C. Oceniano liczbę krwinek płytkowych przed zamrożeniem i po rozmrożeniu przy użyciu licznika hematologicznego.
Wyniki. Średni odzysk rozmrożonych krwinek wyniósł 73,57% i w zależności od zastosowanej metody otrzymywania wahał się od 72,77 do 74,42%. Po przeprowadzonej analizie nie stwierdzono różnic znamiennych statystycznie pomiędzy wynikami odzysku krwinek płytkowych po rozmrożeniu otrzymanych różnymi metodami. Uzyskane średnie wartości dla wszystkich trzech metod otrzymywania KKP różniły się między sobą nie więcej niż o 1,65 punktu procentowego. Podobnie, zarówno mediany, jak i zakresy otrzymanych wyników serii były porównywalne.
Wnioski. Powyższa analiza pozwala wnioskować, że na liczbę odzyskanych krwinek po ich rozmrożeniu nie miała wpływu metoda produkcji koncentratów krwinek płytkowych.
Summary
Introduction. Platelet concentrates are essential for treating bleedings in patients with thrombocytopenia in order to prevent spontaneous hemorrhage. Platelets are also needed during invasive medical procedures. Storing their concentrates for further use can be prolonged by methods of cryopreservation.
Aim. The aim of this study is to estimate whether platelet concentrates preparation methods affect the number of platelets recovered after cryopreservation.
Material and methods. Analyses were carried out from June 2006 to January 2010. They included 160 platelet concentrates, received from aphaeresis and from pooled buffy coats. Platelets concentrates were frozen in five percent dimethyl sulfoxide (DMSO) and stored at -80°C. The number of platelets was counted before freezing and after thawing using the automated haematology analyser.
Results. The average recovery of thawed platelets was 73.57% – varied from 72.77 up to 74.42% depending on the applied method. The analysis did not reveal statistically significant differences in recovery between platelets from particular groups. Mean values in particular groups varied by 1.65 per cent. Median values and scope of results for particular groups were similar.
Conclusions. The above analysis proves that method of obtaining of platelet concentrate has no influence over the number of thawed platelets.

Introduction
Platelets are crucial for the process of blood clotting. Platelet count that is above and below normal may lead to various disturbances in homeostasis (1). After drawing and certain preparation, these cells are commonly used to treat platelet deficits. Transfusions are necessary in patients either with low platelet count or whose platelets show signs of functional disorders (2).
Main indications for platelet concentrate transfusions is treatment of bleedings occurring as a result of thrombocytopenia and preventing bleedings during invasive surgical procedures in patients with thrombocytopenia. Platelet concentrate is also administered prophylactically in hematologic diseases or before and after chemotherapy. Main indications for the transfusions are: hypoplastic anemia, acute leukemia, myelodysplastic syndromes, stem cell transplants. Platelet transfusions are performed in patients with functional disorders, such as: Glanzmann’s thrombasthenia, Bernard-Soulier syndrome and uremia. Other indications for platelet transfusions may be deficiencies connected to liver diseases or liver transplant (3-5).
Physiologically platelets’ lifespan is 8 to 12 days (6). Platelet concentrates are obtained by means of apheresis or from the stored blood (7). Storing platelets for transfusion purposes is difficult due to their sensitivity to changes in the environment. Storage at wrong temperature or pH changes cause change in the platelets’ discoid shape, as well as metabolic and functional disorders (6).
Changes in the cell’s cytoskeleton result in rearrangement in the structure of the cell membrane of both lipids and proteins. Mistakes in reception as well as transportation of the signals by the membrane receptors may induce unjustified activity and formation of microaggregates. On the other hand, changes in the cells’ metabolism prevent aggregation and adhesion. Normally, platelets’ shelf life is 5 to 7 days (after bacteriological tests).
Results of storing include drop in platelets count, “swirling”, changes in cells’ volume and shape, drop in pH and accumulation of lactate dehydrogenaze that constituses a cell lysis marker (8). Cryopreservation is an alternative storage method that significantly prolongs the platelets’ shelf life. Frozen platelet concentrate can constitute the reservoir in absence of fresh platelets (whose shelf life is 5 days).
The choice of freezing conditions should assure minimum water loss and prevent mechanical damage caused by formation of ice crystals inside the cells. Platelet concentrate must be frozen with the crioprotective to reduce the osmotic gradient between the intra- and intercellular space. To prevent recrystallization and deluting process, thawing should be relatively rapid (1).
Although there exist numerous methods of freezing and thawing of the platelets, loss in terms of quantity as well as function is more significant than in case of platelets stored in room temperature (6). Cryopreservation leads to drop in platelet count, lifespan in vivo as well as in vitro (8). Thawed platelets show inhibited aggregation in comparison with those stored in temperature of 22°C. However, their increased activity visible in changes in shape as well as expressed membrane receptors help in maintaining homeostasis (8-10).
Demand for platelet concentrates in the Regional Centre for Blood Donation and Haemotherapy in Katowice between 2005 and 2009 was from 7029 to 8856 therapeutic doses a year. Due to the constant demand for blood from all AB0 and Rh blood group systems, platelets were frozen and, if necessary, thawed and distributed to medical centres. Thawed platelet concentrates constituted 4.5-7.5% of all ordered platelet concentrate units (tab. 1, fig. 1).
Table 1. Platelets – mean recovery after thawing (% of the pre- freeze platelet content).
| Preparation method | APHERESIS | OPTI | ORBISAC | ACCUMULATED |
| mean ± SD | 72.77 ± 0.96 | 74.42 ± 1.57 | 73.53 ± 1.60 | 73.57 ± 0.79 |
| median | 73.25 | 74.07 | 72.50 | 72.70 |
| scope | 61.4-88.6 | 59.4-90.3 | 58.1-92.6 | 58.1-92.6 |
| required norm | > 40 |
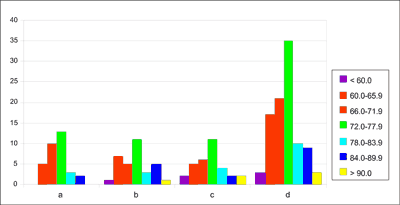
Fig. 1. Platelets – recovery after thawing (%) – histogram (a – APHERESIS; b – OPTI; c – ORBISAC; d – cumulated results).
Aim
The purpose of this report is a quantitative analysis of platelets before and after thawing. The platelets were obtained by apheresis and buffy coat collection. The important question was whether the method of obtaining the platelet concentrate influences changes in the platelet count after the cryopreservation process.
Material and methods
The analysis was conducted from June 2006 to January 2010 and focused on 160 platelet concentrates stored in temperature of about -80°C for no longer than one year.
Platelets for production of pooled platelet concentrates were isolated from the buffy coats obtained from standard whole blood units. Four buffy coats were connected manually in sterile conditions, put in a container together with plasma and centrifuged.
Then platelet-rich plasma was separated with the press so that the number of platelets was above 2.4 x 1011 and the number of leukocytes was below 2 x 108. To obtain the pooled platelet concentrates automatically, OrbiSac system produced by Caridian BCT was used.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Balint B, Vucetic D, Trajkovic-Lakic Z et al.: Quantitative, functional, morphological and ultrastructural recovery of platelets as predictor for cryopreservation. Haematologia (Budap) 2002; 32(4): 363-375.
2. Herman JH: Przetaczanie koncentratów krwinek płytkowych. Leczenie krwią. Zasady postępowania klinicznego. Red Mintz PD Sekcja Transfuzjologiczna Pol Tow Hem i Transf, Warszawa 2001: 73-90.
3. Wandt H, Ehninger G, Gallmeier WM: New strategies for prophylactic platelet transfusion in patients with hematologic diseases. The Oncologist 2001; 6: 446-450.
4. Hayward C: Diagnostic approach to platelet function disorders. Transfus Apher Sci 2008; 38(1): 65-76.
5. Rebulla P: Revisitation of the clinical indications for the transfusion of platelet concentrates. Rev Clin Exp Hematol 2001; 5(3): 288-310.
6. Windyga J: Hemostaza fizjologiczna. [W:] Mariańska B, Fabiańska-Mitek J, Windyga J: Badania laboratoryjne w hematologii. PZWL, Warszawa 2006: 151-163.
7. Antoniewicz-Papis J, Dzieciątkowska A: Preparatyka krwi i jej składników. [W:] Łętowska M (red.): Medyczne zasady pobierania krwi, oddzielania jej składników i wydawania, obowiązujące w jednostkach organizacyjnych publicznej służby krwi. Instytut Hematologii i Transfuzjologii, Warszawa 2006: 1-101.
8. Rothwell SW, Maglasang P, Reid TJ et al.: Correlation of in vivo and in vitro functions of fresh and stored human platelets. Transfusion 2000; 40(8): 988-993.
9. Hornsey VS, McMillan L, Morrison A et al.: Freezing of buffy coat-derived, leukoreduced platelet concentrates in 6 percent dimethyl sulfoxide. Transfusion 2008; 48(12): 2508-2514.
10. Valeri CR, Macgregor H, Ragno G: Correlation between in vitro aggregation and thromboxane A2 production in fresh, liquid-preserved, and cryopreserved human platelets: effect of agonists, pH, and plasma and saline resuspension. Transfusion 2005; 45(4): 596-603.
11. Balint B, Paunovic D, Vucetic D et al.: Controlled rate versus uncontrolled rate freezing as predictors for platelet cryoprese rvation efficacy. Transfusion 2006; 46(2): 230-235.
12. Valeri CR, Ragno G, Khuri S: Freezing human platelets with 6 percent dimethyl sulfoxide with removal of the supernatant solution before freezing and storage at 80°C without postthaw processing. Transfusion 2005; 45(12): 1890-1898.
13. Zhou X, Zhu H, Zhang Sz et al.: Freeze-drying of human platelets: influence of saccharide, freezing rate and cell concentration. Cryo Letters 2007; 28(3): 187-196.
14. Lozano M: Consensus and controversies in platelet transfusion: trigger for indication, and platelet dose. Transfus Clin Biol 2007; 14(6): 504-508.

