© Borgis - Postępy Fitoterapii 2/2016, s. 97-105
*Anna Adamska, Renata J. Ochocka
Nigella sativa źródłem związków bioaktywnych
Nigella sativa source of bioactive compounds
Katedra i Zakład Biologii i Botaniki Farmaceutycznej, Gdański Uniwersytet Medyczny
Kierownik Katedry: prof. dr hab. n. farm. Renata J. Ochocka
Summary
Nigella sativa L. (family Ranunculaceae) is an annual, flowering and herbaceous plant native to South-West Asia, cultivated and naturalized in North Africa and in Europe. The seeds of Nigella sativa, commonly known as black cumin or black seed, are widely used in cuisine by diverse cultures. Moreover in herbal (folk) medicine seeds are believed to have stimulatory, carminative, choleretic, cholagogue, diuretic and diaphoretic properties. Furthermore, seeds are meant to be the treatment and prevention of numerous diseases such as dyslipidaemia, asthma or eczema.
Nigella sativa seeds contain both fixed and volatile oils, alkaloids, proteins and saponins. The major component of the essential oil, thymoquinone, states for much of the biological activity of this plant.
Pharmacological investigations reveal a wide spectrum of biological activities including mainly antioxidant, anti-inflammatory, antibacterial, antiviral, antiparasitic, anticarcinogenic and antidiabetic actions.The beneficial effects of the seeds, which possess a very low degree of toxicity, might be associated with their antioxidant and cytoprotective actions and with their impact on some mediators of inflammation. Still, many issues concerning especially the mechanisms of those activities remain unsolved.

Wstęp
Występowanie, znaczenie i zastosowanie
Nigella sativa, czarnuszka siewna, gatunek rośliny z rodziny Ranunculaceae, pochodzi z południowej Europy i z Azji Zachodniej. W Polsce jest uprawiana i czasami miejscowo dziczejąca, spotykana na siedliskach ruderalnych, wśród zbóż (1).
Czarnuszka siewna znana i ceniona była już w starożytnej Asyrii, w Biblii występuje jako „leczniczy czarny kminek”. Jej właściwości lecznicze wykorzystywał także Hipokrates, a po raz pierwszy opisał grecki lekarz Dioskurides (2). W ówczesnej medycynie nasiona czarnuszki stanowiły środek do leczenia nieżytu żołądka i jelit. W dawnej Polsce biedna ludność stosowała je jako przyprawę zastępującą drogie przyprawy ze wschodu.
Obecnie jest popularnym dodatkiem kulinarnym w Bułgarii i na Dalekim Wschodzie. Czarne nasiona – same lub w połączeniu z miodem – używane są jako dodatek do posypywania chleba, do aromatyzowania wina, do przetworów warzywnych, a także na małą skalę do produkcji olejku eterycznego wykorzystywanego w cukiernictwie. Zmielone nasiona czarnuszki są dobrą alternatywą pieprzu dla osób z problemami gastrycznymi, gdyż nie podrażniają błony śluzowej żołądka.
Jako roślina ozdobna, uprawiana jest na ogrodowych rabatach oraz stosowana w postaci ciętych kwiatów do bukietów. Dekoracyjne są także jej owoce. Olejek czarnuszki wykorzystywany jest przez przemysł drogeryjny, do produkcji perfum.
Jako roślina lecznicza, czarnuszka znana jest z wielokierunkowego działania. W medycynie tradycyjnej wykorzystuje się jej właściwości w Indiach (3), Europie (4) oraz w krajach arabskich (5), gdzie ma status panaceum, lekarstwa na wszystkie choroby poza starzeniem się i uchronieniem od śmierci.
Surowcem leczniczym jest nasienie i olej z czarnuszki – Semen et Oleum Nigellae sativae. Surowiec wykazuje działanie hipoglikemiczne, przeciwbólowe, przeciwzapalne – także w reumatyzmie, silne działanie antybiotyczne, przeciwrobacze, żółciotwórcze i żółciopędne, moczopędne, wiatropędne, a także poprawiające trawienie. Zewnętrznie napary używane są w trądziku i atopowym zapaleniu skóry (6).
Wiele właściwości leczniczych czarnuszki wywodzących się z medycyny ludowej zostało zbadanych i potwierdzonych naukowo. Doniesienia piśmiennictwa dotyczą głównie jej działania przeciwutleniającego, przeciwnowotworowego, przeciwbakteryjnego, przeciwzapalnego oraz przeciwcukrzycowego.
Systematyka
| Domena: | Eukaryota (Jądrowe) |
| Królestwo: | Plantae (Rośliny) |
| Podkrólestwo: | Tracheobionta (Naczyniowe) |
| Nadgromada: | Spermatophyta (Nasienne) |
| Gromada: | Magnoliophyta (Okrytonasienne) |
| Klasa: | Magnoliopsida (Dwuliścienne) |
| Podklasa: | Magnoliidae (Magnoliowe) |
| Rząd: | Ranunculales (Jaskrowce) |
| Rodzina: | Ranunculaceae (Jaskrowate) |
| Rodzaj: | Nigella (Czarnuszka) |
| Gatunek: | Nigella sativa (Czarnuszka siewna) |
Rząd Jaskrowce jest blisko spokrewniony z rzędem Magnoliowców, z którym jeszcze do niedawna był łączony w jeden rząd Wieloowockowców (Polycarpiacae) – jak podaje np. Mowszowicz w „Pospolitych roślinach naczyniowych Polski” (7). Bez wątpienia wywodzi się on z Magnoliowców na skutek ich przekształcania się w rośliny głównie zielne, zawsze wytwarzające naczynia (8). Magnoliowce skupiają rośliny drzewiaste występujące w tropikach i subtropikach. Jaskrowce natomiast, jako wyżej wyspecjalizowane, zdolne są do zasiedlenia różnorodnych terenów – stanowiska o klimacie chłodnym i umiarkowanym, wysokie siedliska w górach, jak i siedliska wodne. W związku z tym charakteryzują się one wysoką i różnorodną specjalizacją sposobów zapylania. Obserwowane jest częste przystosowanie do konkretnych gatunków owadów zapylających (9).
Najliczniejszą rodziną, reprezentowaną przez około 2000 gatunków, są Jaskrowate (Ranunculaceae). Stanowią one istotny element krajowej flory. Ich charakterystyczną cechą jest przekształcanie się niektórych pręcików w twory o różnych kształtach wydzielających nektar, zwanych miodnikami, obecne np. w czarnuszce damasceńskiej (Nigella damascena). Wiele jaskrowatych wykazuje właściwości silnie trujące (np. tojad mocny, Aconitum firmum) oraz lecznicze (miłek wiosenny, Adonis vernalis) ze względu na obecność alkaloidów i glikozydów. W naszej florze omawiana rodzina liczy 70 gatunków, wśród których wyróżnić można 23 rodzaje.
Flora Europaea w rodzaju Nigella podaje 12 gatunków wraz z przypisanymi podgatunkami (10):
1. Nigella arvensis:
– N. arvensis subsp. arvensis,
– N. arvensis subsp. aristata,
– N. arvensis subsp. rechingeri.
2. Nigella hispanica:
– N. hispanica subsp. hispanica,
– N. hispanica subsp. atlintica.
3. Nigella galica.
4. Nigella segetalis.
5. Nigella degenii.
6. Nigella cretica.
7. Nigella fumariifolia.
8. Nigella doerfleri.
9. Nigella sativa.
10. Nigella elata.
11. Nigella damascena.
12. Nigella orientalia.
Morfologia
Łodyga czarnuszki jest wzniesiona i rozgałęziona, osiąga od 10 do 40 cm wysokości. Liście są podwójnie pierzastosieczne o równowąskich odcinkach. Kwiaty dość duże, o średnicy około 3 cm, wyrastają pojedynczo na szczycie pędów. Działki kielicha są koloru białego lub bladobłękitnego z błękitnym unerwieniem i o seledynowych szczytach. Płatki korony są szerokojajowate, zwężone w krótki paznokieć i zakończone dzióbkiem. Między nimi znajdują się pręciki oraz pięć słupków w środku, które następnie zrastają się w wielomieszek przypominający torebkę (1). Tak powstały owoc zawiera w środku czarne, trójgraniaste nasiona o silnym, korzennym, muszkatołowym zapachu i smaku gorzkiej kawy. Czarnuszka siewna jest rośliną jednoroczną, kwitnie od maja do września. Zbioru nasion dokonuje się we wrześniu. Ogólny widok omawianej rośliny przedstawiony został na rycinie 1.

Ryc. 1. Czarnuszka siewna (Nigella sativa) (fot. Anna Adamska)
Skład chemiczny
Nasiona czarnuszki siewnej zawierają w swoim składzie: 36-38% oleju, białko, alkaloidy, saponiny oraz 0,4-2,5% olejku eterycznego (11-14).
W skład oleju wchodzą głównie nienasycone kwasy tłuszczowe, w tym przede wszystkim kwas linolenowy, arachidonowy oraz kwas eikozadienowy (15). Olejek eteryczny był analizowany metodą chromatografii gazowej w połączeniu ze spektometrią mas (GC-MS) (16). Wykryto wiele składników, z których najważniejszym jest tymochinon (27,8-57,0%) (ryc. 2). Poza tym występuje w nim w większych ilościach: p-cymen (7,1-15,5%), karwakrol (5,8-11,6%), t-anetol (0,25-2,3%), 4-terpineol (2,0-6,6%) oraz longifolen (1,0-8,0%). Tymochinon łatwo ulega dimeryzacji do ditymochinonu (17).
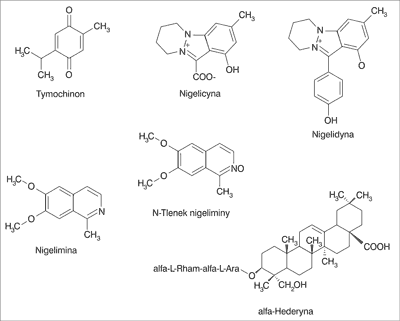
Ryc. 2. Wzory chemiczne najważniejszych związków wchodzących w skład nasion czarnuszki siewnej
Spośród alkaloidów wyróżniono cztery, z których dwa – nigelicyna (18) i nigelidyna (19) – zawierają w swej strukturze pierścień indazolowy, podczas gdy nigelimina (20) i jej N-tlenek (21) są pochodnymi izochinoliny (ryc. 2). Rozpoznana triterpenowa saponina to monodesmozyd – alfa-hederyna (ryc. 2) (22), obecna także w liściach bluszczu Hedera helix.
Aktywność biologiczna
Aktywność antyoksydacyjna
Dowiedziono, że zarówno oleje pochodzące z nasion czarnuszki, jak i tymochinon (główny składnik olejku eterycznego czarnuszki) wykazują aktywność antyoksydacyjną. Wymienione związki hamują cyklooksygenazę i 5-lipooksygenazę w kaskadzie szlaku kwasu arachidonowego. Doświadczenie przeprowadzono na leukocytach pochodzących z otrzewnej szczurów stymulowanych jonoforem wapniowym. Zaobserwowano spadek leukotrienu B4 i tromboksanu B2 (15). Ten sam zespół badawczy zaobserwował także hamowanie nieenzymatycznej peroksydacji tłuszczów w liposomach mózgu szczura dla wspomnianych związków, przy czym tymochinon wykazywał 10 razy mocniejszą inhibicję w porównaniu z olejem. Aktywność antyoksydacyjna badanego oleju była silniejsza niż oczekiwana. Tłumaczy się ten fakt prawdopodobnie obecnością nienasyconych kwasów tłuszczowych we frakcji olejowej.
Właściwości antyoksydacyjne zostały również potwierdzone przez egipskich naukowców (23). Zaobserwowano zdolność przeciwutleniającą wyciągu roślinnego za pomocą redukcji wolnych rodników takich jak DPPH (silniejszą dla nasion czarnuszki niż dla witaminy C) oraz tlenku azotu. Potwierdzono także aktywność przeciwko nieenzymatycznej peroksydacji tłuszczów w mikrosomach szczurzej wątroby, do której dochodzi po dodaniu chlorku żelaza(III) i kwasu askorbowego do materiału biologicznego.
Przy użyciu chromatografii cienkowarstwowej oraz związku DPPH wykazano, że związki wyizolowane z nasion czarnuszki (takie jak tymochinon, karwakrol, t-anetol i 4-terpineol) wykazują cenne działanie przeciwutleniające (24) o charakterze synergistycznym, stąd istotne jest, aby stosować cały olejek eteryczny w badaniach naukowych.
Jako przyczynę wielu chorób podaje się powstawanie wolnych rodników w organizmie. Być może dlatego nasiona czarnuszki siewnej są tak powszechnie stosowane w medycynie ludowej od wielu lat. Wytłumaczalne wydaje się także stosowanie w medycynie tradycyjnej oleju z czarnuszki w chorobach reumatycznych oraz innych chorobach o charakterze zapalnym.
Właściwości przeciwutleniające nasion czarnuszki prawdopodobnie uzasadniają ochronę wątroby przed działaniem hepatotoksycznym tetrachlorku węgla (25), przed zwłóknieniem oraz przed marskością tego narządu (26).
Aktywność przeciwdrobnoustrojowa
Działanie przeciwbakteryjne
Właściwości przeciwbakteryjne, zarówno ekstraktów, jak i olejku eterycznego z nasion czarnuszki zostały wielokrotnie potwierdzone przez zespoły badawcze pochodzące z różnych części świata, m.in. z Europy, Egiptu i Turcji.
Istnieją doniesienia z 1979 roku na temat szerokiego spektrum działania przeciwbakteryjnego in vitro olejku eterycznego czarnuszki siewnej, przeciwko Staphylococcus albus, Escherichia coli, Salmonella typhi i Vibrio cholera (27). W 1998 roku zaobserwowano, że najsilniejszą aktywność przeciwdrobnoustrojową tego olejku obserwuje się w odniesieniu do bakterii Gram-dodatnich, takich jak Staphylococcus aureus i Bacillus subtilis (28). W roku 2000 wykazano, że wodne ekstrakty z nasion oraz surowe ekstrakty alkaloidowe były aktywne wobec drobnoustrojów wyizolowanych od pacjentów cierpiących na septyczne zapalenie stawów, opornych na działanie antybiotyków. Zauważono wówczas, że bakterie Gram-ujemne były bardziej wrażliwe niż Gram-dodatnie, jak również to, że mniej stężone ekstrakty wykazywały silniejszy efekt przeciwbakteryjny, co tłumaczy się prawdopodobnie właściwościami fizykochemicznymi (jak rozpuszczalność, dyfuzja) (29).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Szafer W, Kulczyński S, Pawłowski B. Rośliny polskie. Część I. PWN, Warszawa 1988: 165. 2. Worthen DR, Ghosheh OA, Crooks PA. The in vitro anti-tumor activity of some crude and purified components of blackseed, Nigella sativa L. Anticancer Res 1998; 18:1527-32. 3. Nadkarni AK. Indian Materia Medica. Popular Parkishan, Bombay 1976: 854. 4. Lautenbacher LM. Schwarzkümmelöl. Dtsch-Apoth Ztg 1997; 137:68-9. 5. Sayed MD. Traditional medicine in health care. J Ethnopharmacol 1980; 2:19-22. 6. Wielgosz T. Wielka księga ziół polskich. Publicat SA, Poznań 2008. 7. Mowszowicz J. Pospolite rośliny naczyniowe Polski. Wyd. VII. PWN, Warszawa 1986: 85. 8. Pałczyński A, Podbielkowski Z, Polakowski B. Botanika. PWN, Warszawa 1991: 330. 9. Szweykowska A, Szweykowski J. Botanika – Systematyka. Tom II. PWN, Warszawa 1993: 369. 10. Flora Europaea on CD-ROM, University Press Cambridge 2001. 11. Ansari AA, Hassan S, Kenne L i wsp. Structural studies on a saponin isolated from Nigella sativa. Phytochem 1988; 27(12): 3977-9. 12. Taskin MK, Alankus-Caliskan O, Anil H i wsp. Triterpene saponins from Nigella sativa L. Turk J Chem 2005; 29:561-9. 13. Ghosheh OA, Houdi AA, Crooks PA. High performance liquid chromatographic analysis of the pharmacologically active quinones and related compounds in the oil of the black seed (Nigella sativa L.). J Pharm Biomed Anal 1999; 19:757-62. 14. Riaz M, Syed M, Chaudhary FM. Chemistry of the medicinal plants of the genus Nigella. Hamdard Medicus 1996; 39:40-5. 15. Houghton PJ, Zarka R, de las Heras B i wsp. Fixed oil of Nigella sativa and derived thymoquinone inhibit eicosanoid generation in leukocytes and membrane lipid peroxidation. Planta Med 1995; 61:33-6. 16. Burits M, Bucar F. Antioxidant activity of Nigella sativa essential oil. Phytother Res 2000; 14:323-8. 17. Ali BH, Blunden G. Pharmacological and Toxicological Properties of Nigella sativa. Phytotherapy Research 2003; 17:299-305. 18. Atta-ur-Rahman, Malik S, Cun-heng H i wsp. Isolation and structure determination of nigellicine, a novel alkaloid from the seeds of Nigella sativa. Tetrahedron Lett 1985; 23:2759-62. 19. Atta-ur-Rahman, Malik S, Hasan SS i wsp. Nigellidine, a new indazole alkaloid from the seeds of Nigella sativa. Tetrahedron Lett 1995; 36:1993-6. 20. Atta-ur-Rahman, Malik S, Zaman K. Nigellimine, a new isoquinoline alkaloid from the seeds of Nigella sativa. Nat Prod 1992; 55:676-8. 21. Atta-ur-Rahman, Malik S, Ahmed S i wsp. Nigellimine-N-oxide – a new isoquinoline alkaloid from the seeds of Nigella sativa. Heterocycles 1985; 23:953-5. 22. Swamy SMK, Tan BKH. Extraction, isolation and characterisation of antitumor principle, α-hederin, from the seeds of Nigella sativa. Planta Med 2001; 67:29-32. 23. Zaher KS, Ahmed WM, Zerizer SN. Observations on the biological effects of black cumin seed (Nigella sativa) and green tea (Camellia sinensis). Global Veterinaria 2008; 2(4):198-204. 24. Burits M, Bucar F. Antioxidant activity of Nigella sativa essential oil. Phytother Res Aug 2000; 14(5):323-8. 25. Nagi MN, Alam K, Badary OA. Thymoquinone protects against carbon tetrachloride hetatotoxicity in mice via an antioxidant mechanism. Biochem Mol Biol Int 1999; 47:143-59. 26. Turkdogan MK, Agaoglu Z, Yener Z i wsp. The role of antioxidant vitamins (C and E), selenium and Nigella sativa in the prevention of liver fibrosis and cirrhosis in rabbits: new hops. Dtsch Tierarzt Wschr 2000; 108:71-3. 27. Agrawal R, Kharya MD, Shrivastava R. Antimicrobial and anthelmintic activities of the essential oil of Nigella sativa Linn. Indian J Exp Biol 1979; 17:1264-5. 28. El-Kamali HH, Ahmed AH, Mohammed AS i wsp. Antibacterial properties of essential oils from Nigella sativa seeds, Cymbopogon citratus leaves and Pulicaria undulata aerial parts. Fitoter 1998; 34:77-8. 29. Morsi NM. Antimicrobial effect of crude extracts of Nigella sativa on multiple antibiotics-resistant bacteria. Acta Microbiol Pol 2000; 49:63-74. 30. Ozmen A, Basbulbul G, Aydin T. Antimitotic and antibacterial effects of the Nigella sativa L. Seed Caryologia 2007; 60:270-2. 31. Salem ML, Hossain MS. Protective effect of black seed oil from Nigella sativa against murine cytomegalovirus infection. Inter J Immunopharmacol 2000; 22:729-40. 32. Mahmoud MR, El-Abhar HS, Saleh S. The effects of Nigella sativa oil against the liver damage induced by Schistosoma mansoni in mice. J Ethnopharmacol 2002; 79:1-11. 33. Nakamura A, Nagai K, Suzuki S i wsp. A novel method of screening for immunomodulating substances, establishment of an assay system and its application to culture broths of microorganisms. J Antibiot 1986; 39:1148-54. 34. Gerlier D, Thomasset N. Use of MTT colorimetric assay to measure cell activation. J Immunol Meth 1986; 94:57-63. 35. Mosmann T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. J Immunol Meth 1983; 65:55-63. 36. Scudiero DA, Shoemaker RH, Paull KD i wsp. Evaluation of a soluble tetrazolium/formazan assay for cell growth and drug sensitivity in culture using human and other tumor cell lines. Cancer Res 1988; 48:4827-33. 37. Swamy SM, Tan BK. Cytotoxic and immunopotentiating effects of ethanolic extract of Nigella sativa L. seeds. J Ethnopharmacol 2000; 70:1-7. 38. Hostettmann K. Saponins with molluscicidal activity from Hedera helix L. Helv Chim Acta 1980; 63:606-8. 39. Danloy S, Quetin-Leclercq J, Coucke P i wsp. Effects of alpha-hederin, a saponin extracted from Hedera helix, on cells cultured in vitro. Planta Med 1994; 60:45-9. 40. Bhuvan PR, Taxal GS, Jignesh DP i wsp. Potent anticancer activity of Nigella sativa seeds. Scholars Res Libr 2010; 2(1):52-6. 41. Salomi MJ, Nair SC, Panikkar KR. Inhibitory effects of Nigella sativa and saffron (Crocus sativus) on chemical carcinogenesis in mice. Nutr Cancer 1991; 16:67-72. 42. Salomi NJ, Nair SC, Jayawardhanan KK i wsp. Antitumour principles from Nigella sativa seeds. Cancer Lett 1992; 63:41-6. 43. Ito N, Tsuda H, Hasagawa R i wsp. Sequential observation of pathomorphologic alterations in preneoplastic lesions during the promoting stage of hepatocarcinogenesis and the development of short-term system for hepatopromoters and hepatocarcinogens. Toxicol Pathol 1982; 10:37-49. 44. Alan S, Ian W. The haematoxylin and eosin. [In:] John DB, Alan S (eds.). The Theory and Practice of Histological Techniques. Whitehall Books Ltd, Welington 1996:212. 45. Cotter TG, Martin SJ. Technique in apoptosis. A user Guide. Portland Press, London 1996. 46. Aggarwal BB, Bhardwaj A, Aggarwal RS i wsp. Role of resveratol in prevention and therapy of cancer: Preclinical studies. Anticancer Res 2004; 24:2783-840. 47. Schoieb AM, Dudrick PS, Bell JD i wsp. In vitro inhibition of growth and induction of apoptosis in cancer cell lines by thymoquinone. Int J Oncol 2003; 22:107-13. 48. Latifah SY, Ng WK, Al-Naqeeb G i wsp. Cytotoxicity of thymoquinone (TQ) from Nigella sativa towards human cervical carcinoma cells (HeLa). J Pharmcy Res 2009; 2(4):585-9. 49. Badary OA. Thymoquinone attenuates ifosfamide-induced Fanconi syndrome in rats and enhances its antitumor activity in mice. J Ethnopharmacol 1999; 67:135-42. 50. Badary OA, Gamal AM. Inhibitory effects of thymoquinone against 20-methylcholanthrene-induced fibrosarcoma tumorigenesis. Cancer Detect Prev 2001; 25:362-8. 51. Ng WK, Yazan LS, Ismail M. Thymoquinone from Nigella sativa was more potent than cisplatin in eliminating of SiHa cells via apoptosis with down-regulation of Bcl-2 protein. Toxicol In Vitro 2011; 25:1392-8. 52. Al-Hader A, Aqel M, Hasan Z. Hypoglycemic effect of the volatile oil of Nigella sativa seeds. Int J Pharmacogn 1993; 31:96-100. 53. El-Zawahrawy B, Al-Zahraa FAH. Effect of Nigella sativa on blood level and structure of liver and pancreas in adult male albino rats. Al-Azhar Med J 1998; 27:479-83. 54. Rakieten N, Rakieten ML, Nadkarni MV. Studies on the antidiabetic action of streptozotocin. Cancer Chemother Rep 1963; 29:91-6. 55. Gu D, Arnush M, Sarvetnick N. Endocrine/exocrine intermediate cells in streptozotocin-treated Ins-IFN-c transgenic mice. Pancreas 1997; 15:246-50. 56. Wilson GL, Patton NJ, McCord JM i wsp. Mechanisms of streptozotocin and alloxan-induced damage in rat beta-cells. Diabetol 1984; 27:587-96. 57. Gandy SE, Buse MG, Crouch RK. Protective role of superoxide dismutase against diabetogenic drugs. J Clin Invest 1982; 70:650-9. 58. Hammers HD, Martin S, Federslin K. Aminoguanidine treatment inhibit the development of experimental diabetic retinopathy. Proc Natl Acad Sci USA 1991; 88:11. 59. Albers DS, Beal MF. Mitochondrial dysfunction and oxidative stress in aging and neurodegenerative disease. J Neural Transm 2000; 59:133-54. 60. Abdelmeguid N, Fakhoury R, Kamal S i wsp. Effects of Nigella sativa and thymoquinone on biochemical and subcellular changes in pancreatic b-cells of streptozotocin-induced diabetic rats. J Diabetes 2010; 2:256-66. 61. Fararh KM, Shimizu Y, Shiina T i wsp. Thymoquinone reduces hepatic glucose production in diabetic hamsters. Res Vet Sci 2005; 79:219-23. 62. Pari L, Sankaranarayanan C. Beneficial effects of thymoquinone on hepatic key enzymes in streptozotocin-nicotinamide induced diabetic rats. Life Sci 2009; 85:830-4. 63. Mańkowska D, Bylka W. Nigella sativa L. – związki czynne, aktywność biologiczna. Herba Pol 2009; 55:109-25. 64. Salem ML. Immunomodulatory and therapeutic properties of the Nigella sativa L. seed. Int Immunopharmacol 2005; 5:1749-70. 65. Dollah MA, Parhizkar S, Latiff LA i wsp. Toxicity effect of Nigella sativa on the liver function of rats. Adv Pharm Bull 2013; 3:97-102.


