*Jacek Piłat1, Sławomir Rudzki1, Jacek Bicki2, Wojciech Dąbrowski3
Postępy w diagnostyce obrazowej chorób zapalnych odbytu
Progress in diagnostic imaging of anal inflammatory diseases
11st Chair and Department of General Surgery, Transplantation and Nutritional Therapy, Medical University of Lublin
2Institute of Medical Sciences of the Faculty of Medicine and Health Sciences, Jan Kochanowski University in Kielce
3Chair and 1st Department of Anaesthesiology and Intensive Therapy, Medical University of Lublin
Streszczenie
Autorzy przedstawiają zagadnienia z zakresu diagnostyki najczęściej spotykanych chorób zapalnych odbytu. W sposób szczególny zajmują się przetokami i ropniami odbytu. Przedstawiają różne metody diagnostyczne: począwszy od podstawowego badania proktologicznego poprzez metody instrumentalne. Oceniają przydatność, wady i ograniczenia poszczególnych metod. Najwyższą ocenę z przedstawionych metod diagnostycznych uzyskały dwa badania, tj. rezonans magnetyczny i badanie endosonograficzne w opcji 3D, wsparte użyciem opcji render mode lub wody utlenionej jako środka kontrastowego. Oba badania w pewnym sensie są porównywalne, jeżeli chodzi o choroby zapalne odbytu. W przypadku badania endosonograficznego zaletami są: niski koszt, powtarzalność i dostępność. Do wad rezonansu magnetycznego należą: wysoka cena badania, mała dostępność i ewentualna klaustrofobia pacjenta lub obecność metalowych implantów. Jednak niezaprzeczalną zaletą badania metodą rezonansu magnetycznego jest możliwość oceny przetok lub ropni odbytu zlokalizowanych wysoko, powyżej mięśni dźwigaczy. W ocenie zmian głęboko położonych przewaga rezonansu magnetycznego wynika z krótszego ogniska sondy endosonograficznej. Wysoka częstotliwość sondy daje dobrą jakość obrazu, ale okupiona jest krótszą penetracją w głąb promieni ultrasonograficznych. Użycie opcji render mode lub kontrastu – wody utlenionej – stawia badanie endosonograficzne w jednym rzędzie z rezonansem magnetycznym w diagnostyce płycej położonych, częściej występujących przetok i ropni. Mając na uwadze niższe koszty i powtarzalność badania endosonograficznego, jest ono cennym nowoczesnym instrumentem w diagnostyce zmian zapalnych odbytu.
Summary
The authors present issues related to the diagnosis of the most common inflammatory diseases of the anus. They deal with anal fistulas and abscesses in a special way. They present various diagnostic methods: from basic proctological examination to instrumental methods. They asses the usefulness, disadvantages and limitations of individual methods. The highest assessment of the presented diagnostic methods was obtained by two tests, i.e. magnetic resonance imaging and endosonographic examination in the 3D option, supported by the use of the render mode option or hydrogen peroxide as a contrast agent. In a sense, both examinations are comparable when it comes to inflammatory diseases of the anus. For endosonographic examination, the advantage is low cost, repeatability and availability. The disadvantage of magnetic resonance imaging is the high price of the test, the low availability and possible claustrophobia of the patient or the presence of metal implants. However, the undeniable advantage of magnetic resonance imaging is the ability to assess anal fistulas or abscesses located high above the levator muscles. In the assessment of deeply located lesions, the advantage of magnetic resonance results from the shorter focus of the endosonographic probe. The high frequency of the probe gives good image quality, but it is paid for the shorter penetration of the ultrasound rays. The use of the render mode or contrast – hydrogen peroxide option puts the endosonographic examination in a one row with magnetic resonance imaging in the diagnosis of the most frequent occurring fistulas and abscesses. Considering lower costs, repeatability of the endosonographic examination it is a valuable modern instrument in the diagnosis of inflammatory lesions of the anus.

Choroby zapalne odbytu należą do jednych z najczęstszych przyczyn zgłaszania się pacjentów do poradni i oddziałów chirurgicznych. Do chorób zapalnych należą: ropień, przetoka, szczelina odbytu, zapalenie odbytu. Manifestują się one różnymi objawami, głównie miejscowymi (ból, zaczerwienienie, obrzęk, krwawienie, zaburzenia wypróżnień, wyciek treści ropnej i/lub krwistej w okolicy odbytu) oraz czasami ogólnymi – zapalnymi, np. w przypadku wysoko zlokalizowanych ropni. Właściwa diagnostyka jest kluczowa dla prawidłowego rozpoznania i zoptymalizowania procesu leczniczego.
Najczęstsze choroby zapalne odbytu to szczeliny odbytu, przetoki i ropnie, które poza podstawowym badaniem proktologicznym często wymagają dodatkowych badań obrazowych. Wynik takiego badania ma określić przebieg kanału przetoki lub lokalizację ropnia (stosunek do zwieraczy) czy też miejsce ujścia wewnętrznego. Ropnie odbytu z reguły manifestują się klinicznie, nie budząc wątpliwości rozpoznawczych. Jednak spotykamy ropnie klepsydrowate lub położone wysoko powyżej mięśni dźwigaczy odbytu, które mogą nie dawać żadnych dolegliwości w okolicy odbytu, a jedynie objawy ogólne. W tych przypadkach diagnostyka poszerzona o badania dodatkowe jest kluczowa dla właściwego procesu leczniczego. Dolegliwości bólowe w okolicy odbytu o niejasnej etiologii są również wskazaniem do rozszerzenia diagnostyki, a nie pozostania tylko przy podstawowym badaniu proktologicznym (ryc. 1).
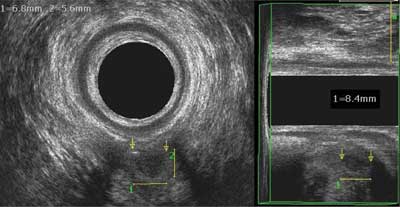
Ryc. 1. Mały ropień z widocznym powietrzem, głęboko położony między ramionami mięśnia łonowo-odbytniczego; ropień niemy klinicznie między widocznymi strzałkami o wymiarze 8,4 x 6,8 x 5,6 mm
Często pacjenci zgłaszają się z powikłaniami lub nawrotami chorób proktologicznych. Prawidłowe rozpoznanie oraz ocena już istniejących uszkodzeń spowodowanych chorobą i procesem leczenia wpływają na metodę leczenia i efekt końcowy. Zaburzenia w trzymaniu stolca mogą mieć przyczynę w chorobach ogólnych, starzeniu się, ale również w niewydolności zwieraczy na tle np. przebytych zabiegów, urazu kanału odbytu.
Diagnostyka chorób proktologicznych opiera się na dobrze przeprowadzonym wywiadzie i badaniu fizykalnym oraz badaniach dodatkowych. Poza oglądaniem krocza oraz okolicy okołoodbytowej i badaniem palcem przez odbyt można wykonać: anoskopię lub rektoskopię, endosonografię przez-odbytniczą lub przezkroczową, defekografię, test wydalania balonu, fistulografię, manometrię odbytniczo-odbytową, badanie tomografii komputerowej i rezonansu magnetycznego z użyciem lub bez cewki doodbytniczej. Wszystkie z wymienionych badań mają swoje zalety i ograniczenia, wybór uzależniony jest od wywiadu i wstępnego badania proktologicznego oraz dostępności metody diagnostycznej.
Przetoka odbytu jest kanałem otoczonym przez tkankę ziarninową, łączącym ujście wewnętrzne przetoki zlokalizowane w kanale odbytu z ujściem zewnętrznym – umiejscowionym najczęściej na skórze w okolicy odbytu. Przyczyną powstawania ropni i przetok w tej okolicy w myśl teorii odkryptowej jest infekcja rozpoczynająca się w gruczołach odbytowych Hermana i szerzenie się jej do okolicy okołoodbytowej. Ostre zakażenie formułuje ropień, a jego postacią przewlekłą jest przetoka (1, 2).
Do innych rzadszych czynników etiologicznych zaliczamy: choroby zapalne (szczególnie choroba Leśniowskiego-Crohna, gdzie często ujście wewnętrzne jest głębiej położone niż w kryptach okołoodbytowych), zakażenie szerzące się ze szczeliny odbytu, torbiele guziczne, nowotwory, ciała obce, chłoniaki, gruźlicę, zakażenie wirusem HIV, powikłania po zabiegach przeprowadzonych w tej okolicy (3, 4).
Diagnostyka przetok ma za zadanie odpowiednie zakwalifikowanie, czyli opisanie przebiegu anatomicznego przetoki. Obecnie najczęściej stosowaną klasyfikacją jest klasyfikacja Parksa. Wzięto w niej pod uwagę lokalizację ujścia wewnętrznego i przebieg kanału przetoki w stosunku do mięśnia zwieracza zewnętrznego. Wyróżnia się przetoki: podśluzowe, międzyzwieraczowe, przezzwieraczowe, nadzwieraczowe i pozazwieraczowe (5).
Ważnym jest również określenie, czy przetoka przechodzi w przedniej lub tylnej czy bocznej części kanału odbytu. Ma to duże znaczenie szczególnie u kobiet, gdzie przednia – odkroczowa – część kanału odbytu ma krótszy zwieracz zewnętrzny i dlatego operacje przetok w przedniej części są bardziej narażone na powikłanie w postaci niewydolności zwieraczy (6, 7).
Inną klasyfikacją jest klasyfikacja Goodsalla i Milesa dzieląca przetoki na: całkowitą, czyli kompletną, tj. posiadającą dwa ujścia – ujście zewnętrzne na skórze w okolicy odbytu i wewnętrzne – do światła przewodu pokarmowego, oraz niekompletną, czyli ślepą zewnętrznie, tj. brak ujścia zewnętrznego, lub ślepą wewnętrznie, czyli bez widocznego ujścia wewnętrznego (8).
W diagnostyce przetok odbytu można stosować wiele badań dodatkowych, są jednak lekarze praktycy, którzy uważają za wystarczające podstawowe badanie fizykalne. Dotyczy to szczególnie przetok pierwotnych nigdy nieleczonych i niepowikłanych. W innych przypadkach powinno wykonać się dodatkowe badania (9).
Pierwszą wskazówką, chociaż mało dokładną, co do umiejscowienia ujścia wewnętrznego w trakcie oglądania okolicy okołoodbytowej jest reguła Salomona Goodsalla. Dzieli ona odbyt poziomą linią na część przednią i tylną. Umiejscowienie ujścia zewnętrznego w przedniej połowie to podejrzenie przetoki z prostym kanałem podążającej do krypty przedniej. Jeśli ujście zewnętrzne mieści się w tylnej połowie lub ponad 3 cm od brzegu odbytu w przedniej połowie, to najprawdopodobniej kanał przetoki podąża do tylnej krypty – odogonowej. Reguła ta sprawdza się w około 80% przypadków przetok mających ujście wewnętrzne w tylnej połowie, a tylko w około 50% przypadków mających ujście w przedniej połowie podzielonego odbytu (10).
Do najczęściej wykonywanych badań dodatkowych stosowanych w diagnostyce przetok odbytu zalicza się (11):
1. Fistulografię rentgenowską – obecnie rzadko stosowaną ze względu na konieczność napromieniowania pacjenta oraz małą dokładność, tj. do 25% w identyfikacji ujścia wewnętrznego w odpowiedniej krypcie. Jej zaletą jest możliwość zlokalizowania ujścia wewnętrznego w wysokich przetokach pozazwieraczowych, co umożliwia np. przedostanie się kontrastu do uchyłka esicy (12, 13).
2. Przezodbytowa i przezodbytnicza ultrasonografia (TAUS – ang. transanal ultrasound i TRUS – ang. transrectal ultrasound) – stosowana ze względu na dużą dokładność i swoistość badania oraz niski koszt i powtarzalność. Badanie wykonywane jest w pozycji Simsa (czyli ułożeniu na lewym boku). Wprowadza się sondę ultrasonograficzną o wysokiej częstotliwości (od 9 do 16 MHz), mającą obraz 360°, co daje możliwość oglądania na obrazie całego odbytu. W przypadku badania bańki odbytnicy (należy użyć balon wodny w celu zapewnienia przewodzenia wiązki promieni ultrasonograficznych) mamy możliwość oglądania warstwowej budowy ściany odbytnicy i porównania z obrazem całości jej przekroju (ryc. 2a, b).
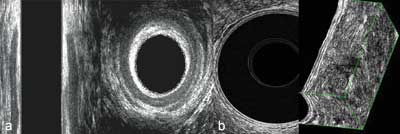
Ryc. 2a, b. (a) Badanie kanału odbytu (hypoechogeniczny zwieracz wewnętrzny i otaczający go o mieszanej echogeniczności zwieracz zewnętrzny); (b) badanie bańki odbytnicy (widoczna warstwowa budowa ściany jelita)
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Limura E, Giordano P: Modern management of anal fistula. World J Gastroenterol 2015; 21: 12-20.
2. Arendt J, Trompeta J, Michalski P et al.: Ropień okołoodbytniczy – problemy rozpoznawcze i lecznicze. Chirurgia Polska 2000; 2: 91-101.
3. Practice parameters for treatment of fistula-in-ano. The Standards Practice Task Force. The American Society of Colon and Rectal Surgeons. Dis Colon Rectum 1996; 39: 1361-1362.
4. Rosen L: Anorectal abscess-fistulae. Surg Clin North Am 1994; 74: 1293-1308.
5. Parks AG, Gordon PH, Hardcastle JD: A classification of fistula-in-ano. Br J Surg 1976; 63: 1-12.
6. Buchanan GN, Bartram CI, Williams AB et al.: Value of hydrogen peroxide enhancement of three-dimensional endoanal ultrasound in fistula-in-ano. Dis Colon Rectum 2005; 48: 141-147.
7. Roig JV, Jordán J, García-Armengol J et al.: Changes in anorectal morphologic and functional parameters after fistula-in-ano surgery. Dis Colon Rectum 2009; 52: 1462-1469.
8. Goodsall DH, Miles WE: Anorectal Fistula. Dis Colon Rectum 1982; 25: 262-278.
9. Sloots CE, Felt-Bersma RJ, Poen AC, Cuesta MA: Assessment and classification of never operated and recurrent cryptoglandular fistulas-in-ano using hydrogen peroxide enhanced transanal ultrasound. Colorectal Dis 2001; 3: 422-426.
10. Cirocco WC, Reilly JC: Challenging the predictive accuracy of Goodsall’s rule for anal fistulas. Dis Colon Rectum 1992; 35: 537-542.
11. Bartram C, Buchanan G: Imaging anal fistula. Radiol Clin North Am 2003; 41: 443-457.
12. Amato A, Bottini C, De Nardi P et al.: Evaluation and management of perianal abscess and anal fistula: a consensus statement developed by the Italian Society of Colorectal Surgery (SICCR). Tech Coloproctol 2015; 19: 595-606.
13. Bitter K, Bitterová J, Lohnert J et al.: Fistulografia perianálnych fistúl ako determinujúci faktor operacnej stratègie. ?s Radiol 1985; 29: 374-377.
14. Santoro GA, Fortling B: The advantages of volume rendering in three-dimensional endosonography of the anorectum. Dis Colon Rectum 2007; 50: 359-368.
15. Sudoł-Szopińska I, Kołodziejczak M, Szopiński TR: The accuracy of a postprocessing technique – volume render mode – in three-dimensional endoanal ultrasonography of anal abscesses and fistulas. Dis Colon Rectum 2011; 54: 238-244.
16. Visscher AP, Schuur D, Slooff RA et al.: Predictive factors for recurrence of cryptoglandular fistulae characterized by preoperative three-dimensional endoanal ultrasound. Colorectal Dis 2016; 18(5): 503-509.
17. Cheong DM, Nogueras JJ, Wexner SD, Jagelman DG: Anal endosonography for recurrent anal fistulas: image enhancement with hydrogen peroxide. Dis Colon Rectum 1993; 36: 1158-1160.
18. Kruskal JB, Kane RA, Morrin MM: Peroxide-enhanced anal endosonography: technique, image interpretation, and clinical applications. Radiographics 2001; 21 (Spec No): S173-189.
19. Oliveira IS, Kilcoyne A, Price MC, Harisinghani M: MRI features of perianal fistulas: is there a difference between Crohn’s and non-Crohn’s patients? Abdom Radiol (New York) 2017; 42: 1162-1168.
20. Gecse KB, Bemelman W, Kamm MA, Stoker J: A global consensus on the classification, diagnosis and multidisciplinary treatment of perianal fistulising Crohn’s disease. Gut 2014; 63(9): 1381-1392.
21. Sudoł-Szopińska I, Jakubowski W: Endosonography of anal canal diseases. Ultrasound Q 2002; 18: 13-33.
22. Zbar AP, Oyetunji RO, Gill R: Transperineal versus hydrogen peroxide-enhanced endoanal ultrasonography in never operated and recurrent cryptogenic fistula-in-ano: a pilot study. Tech Coloproctol 2006; 10: 297-302.
23. Terracciano F, Scalisi G, Bossa F et al.: Transperineal ultrasonography: First level exam in IBD patients with perianal disease. Dig Liver Dis 2016; 48: 874-879.
24. Plaikner M, Loizides A, Peer S et al.: Transperineal ultrasonography as a complementary diagnostic tool in identifying acute perianal sepsis. Tech Coloproctol 2014; 18(2): 165-171.
25. Kołodziejczak M, Santoro GA, Słapa RZ et al.: Usefulness of 3D transperineal ultrasound in severe stenosis of the anal canal: preliminary experience in four cases. Tech Coloproctol 2014; 18: 495-501.
26. Buchanan GN, Halligan S, Bartram CI et al.: Clinical Examination, Endosonography, and MR Imaging in Preoperative Assessment of Fistula in Ano: Comparison with Outcome-based Reference Standard. Radiology 2004; 233: 674-681.
27. Burdan F, Sudol-Szopinska I, Staroslawska E et al.: Magnetic resonance imaging and endorectal ultrasound for diagnosis of rectal lesions. Eur J Med Res 2015; 20: 4.
28. Dohan A, Eveno C, Oprea R et al.: Diffusion-weighted MR imaging for the diagnosis of abscess complicating fistula-in-ano: preliminary experience. Eur Radiol 2014; 24: 2906-2915.
29. Cattapan K, Chulroek T, Kordbacheh H et al.: Contrast-vs. non-contrast enhanced MRdata sets for characterization of perianal fistulas. Abdom Radiol (NY) 2019; 44(2): 446-455.
30. Waniczek D, Adamczyk T, Arendt J, Kluczewska E: Direct MRI fistulography with hydrogen peroxide in patients with recurrent perianal fistulas: a new proposal of extended diagnostics. Med Sci Monit 2015; 21: 439-445.
31. Bhatt S, Jain BK, Singh VK: Multi Detector Computed Tomography Fistulography In Patients of Fistula-in-Ano: An Imaging Collage. Polish J Radiol 2017; 82: 516-523.
32. Beets-Tan RG, Beets GL, van der Hoop AG et al.: Preoperative MR imaging of anal fistulas: Does it really help the surgeon? Radiology 2001; 218: 75-84.
33. Liang C, Lu Y, Zhao B et al.: Imaging of anal fistulas: comparison of computed tomographic fistulography and magnetic resonance imaging. Korean J Radiol 2014; 15(6): 712-723.
34. Liang C, Jiang W, Zhao B et al.: CT imaging with fistulography for perianal fistula: does it really help the surgeon? Clin Imaging 2013; 37: 1069-1076.
35. Meinero P, Mori L: Video-assisted anal fistula treatment (VAAFT): a novel sphincter-saving procedure for treating complex anal fistulas. Tech Coloproctol 2011; 15: 417-422.
36. Schwandner O: Video-assisted anal fistula treatment (VAAFT) combined with advancement flap repair in Crohn’s disease. Tech Coloproctol 2013; 17: 221-225.
37. Wałęga P, Romaniszyn M, Nowak W: VAAFT: a new minimally invasive method in the diagnostics and treatment of anal fistulas – initial results. Pol Przegl Chir 2014; 86(1): 7-10.
38. Rezaie A, Iriana S, Pimentel M et al.: Can three-dimensional high-resolution anorectal manometry detect anal sphincter defects in patients with faecal incontinence? Colorectal Dis 2017; 19: 468-475.
39. Cerro CR, Franco EM, Santoro GA et al.: Residual defects after repair of obstetric anal sphincter injuries and pelvic floor muscle strength are related to anal incontinence symptoms. Int Urogynecol J 2017; 28: 455-460.
40. Felt-Bersma RJF, Vlietstra MS, Vollebregt PF et al.: 3D high-resolution anorectal manometry in patients with perianal fistulas: comparison with 3D-anal ultrasound. BMC Gastroenterol 2018; 18: 44.
41. Siddiqui MRS, Ashrafian H, Tozer P et al.: A diagnostic accuracy meta-analysis of endoanal ultrasound and MRI for perianal fistula assessment. Dis Colon Rectum 2012; 55: 576-585.
42. Karanikas I, Koutserimpas C, Siaperas P et al.: Transrectal ultrasonography of perianal fistulas: a single center experience from a surgeon’s point of view. G Chir 2018; 39(4): 258-260.
43. Mihmanli I, Kantarci F, Dogra VS: Endoanorectal ultrasonography. Ultrasound Q 2011; 27: 87-104.
44. Navarro-Luna A, García-Domingo MI, Rius-Macías J, Marco-Molina C: Ultrasound study of anal fistulas with hydrogen peroxide enhancement. Dis Colon Rectum 2004; 47: 108-114.
45. Sudoł-Szopińska I, Jakubowski W, Szczepkowski M: Contrast-enhanced endosonography for the diagnosis of anal and anovaginal fistulas. J Clin Ultrasound 2002; 30: 145-150.
46. Knoefel WT, Hosch SB, Hoyer B, Izbicki JR: The Initial Approach to Anorectal Abscesses: Fistulotomy Is Safe and Reduces the Chance of Recurrences. Dig Surg 2000; 17: 274-278.
47. Alabiso ME, Iasiello F, Pellino G et al.: 3D-EAUS and MRI in the Activity of Anal Fistulas in Crohn’s Disease. Gastroenterol Res Pract 2016; 2016: 1895694.
48. Garcès-Albir M, García-Botello SA, Espi A et al.: Three-dimensional endoanal ultrasound for diagnosis of perianal fistulas: Reliable and objective technique. World J Gastrointest Surg 2016; 8: 513-520.
49. Visscher AP, Felt-Bersma RJ: Endoanal Ultrasound in Perianal Fistulae and Abscesses. Ultrasound Q 2015; 31: 130-137.
50. Aguilera-Castro L, Ferre-Aracil C, Garcia-Garcia-de-Paredes A et al.: Management of complex perianal Crohn’s disease. Ann Gastroenterol 2016; 30: 33-44.
51. Sun MRM, Smith MP, Kane RA: Current techniques in imaging of fistula in ano: three-dimensional endoanal ultrasound and magnetic resonance imaging. Semin Ultrasound CT MR 2008; 29: 454-471.



