*Marcin Szymański1, Marta Kolendowicz1, Arkadiusz Szymański2
Skład chemiczny i aktywność biologiczna Laetiporus sulphureus (Bull.)
Chemical composition and biological activity of Laetiporus sulphureus (Bull.)
1Centrum Zaawansowanych Technologii, Uniwersytet im. Adama Mickiewicza w Poznaniu
Dyrektor Centrum: prof. dr hab. n. chem. Bronisław Marciniak
2Wydział Chemii, Uniwersytet im. Adama Mickiewicza w Poznaniu
Dziekan Wydziału: prof. dr hab. n. chem. Maciej Kubicki
Streszczenie
Laetiporus sulphureus jest gatunkiem grzyba powszechnie obecnym na całym świecie. Jego owocniki występują najczęściej na drzewach liściastych, a bardzo rzadko na drzewach iglastych. Jest groźnym grzybem chorobotwórczym, powodującym obumieranie zarażonych drzew. W owocnikach grzyba występują m.in.: polisacharydy, lektyny, kompleksy polisacharydowo-białkowe, lipidy, triterpeny oraz związki fenolowe, które wykazują działanie: przeciwbakteryjne, przeciwgrzybicze, przeciwzapalne, przeciwnowotworowe, immunomodulujące i hipoglikemizujące.
Summary
Laetiporus sulphureus is a species of fungus commonly found all over the world. Its fruiting bodies are most often found on deciduous trees and very rarely on conifers. It is a dangerous pathogenic fungus that causes the death of infected trees. The fruiting bodies of the fungus contain, among others: polysaccharides, lectins, polysaccharide-protein complexes, lipids, triterpenes and phenolic compounds that exhibit antibacterial, antifungal, anti-inflammatory, anti-tumor, immunomodulating and hypoglycemic properties.

Wstęp
Grzyby są organizmami wszędobylskimi. Ich owocniki można znaleźć głównie na lądach, ale spotyka się je również w wodach słodkich i słonych. Najpopularniejsze są grzyby leśne rosnące w glebie i spróchniałym drewnie. Grzyby nadrzewne oraz nadrewnowe (poliporoidalne) często są oceniane jako szkodliwe ze względu na straty, jakie wywołują w leśnictwie, sadownictwie i budownictwie. Coraz częściej jednak docenia się ich rolę w regulacji ekosystemu – pełnią funkcję saprofitów rozkładających martwą materię i uwalniających pierwiastki do obiegu w przyrodzie. Należy również zaznaczyć, że grzyby były bardzo ważne w różnych kulturach – człowiek podpatrując przyrodę, uczył się, jak je rozpoznawać i użytkować. Huby włączono w system wierzeń oraz obrzędów religijnych (np. Fomitopsis officinalis – pniarek lekarski wykorzystywany był przez północnoamerykańskich Indian do produkcji świętych figurek), ponadto wykorzystywano owocniki do rozniecania ognia (poprzez łapanie iskry w łatwopalny miąższ owocników) czy produkcji ubrań (miąższ hubiaka pospolitego Fomes fomentarius służył do otrzymywania materiału przypominającego zamsz – amadou). Mimo iż te zastosowania zostały w dzisiejszych czasach zastąpione nowoczesnymi technologiami, to owocniki dziko rosnących gatunków grzybów nadal są wykorzystywane jako źródło pożywienia, a prowadzone przez ostatnie dekady badania wykazały, że są one bogate w liczne związki biologicznie aktywne. Zidentyfikowane w nich substancje o zróżnicowanej budowie chemicznej, takie jak: węglowodany, lektyny, kwasy tłuszczowe, lipidy, triterpeny, seskwiterpeny, fenolokwasy oraz flawonoidy, posiadają właściwości lecznicze (1). Wiele gatunków grzybów ma udowodnione działania farmakologiczne: przeciwzapalne, przeciwnowotworowe, przeciwcukrzycowe, immunomodulujące i inne.
Młode owocniki żółciaka siarkowego (Laetiporus sulphureus) są jadalne i stanowią dodatek do zdrowej i zbilansowanej diety.
Systematyka i polskie nazwy synonimiczne
Żółciak siarkowy należy do gromady podstawczaków (Basidiomycota), podgromady Agaricomycotina, rzędu żagwiowców (Polyporales) i rodziny pniarkowatych (Fomitopsidaceae) (2). W polskim piśmiennictwie mykologicznym można znaleźć nazwy synonimiczne, takie jak: huba żółta, żagiew Rostafińskiego, żagiew topolowa, grzyb siarkowy, huba siarkowa i żółciak siarkowy.
Skład chemiczny
Polisacharydy
Owocniki Laetiporus sulphureus są bogatym źródłem α-(1,3)-D-glukanów, które stanowią 88% ich ściany komórkowej, gdy w innych grzybach zawartość ta waha się od 9 do 46% (3).
Wyizolowano i scharakteryzowano przy wykorzystaniu: 13C, 1H oraz 13HSQC NMR, analizy metylacji oraz degradacji Smitha, dwa główne polisacharydy: laminarynę, po trzygodzinnej ekstrakcji wodą owocników w temp. 100°C, i fukomannogalaktan, poprzez wytrącenie z wykorzystaniem roztworu Fehlinga. Główny łańcuch fukomannogalaktanu składał się z połączonych wiązaniami (1→6) reszt α-D-galaktopyranozylu, z których część była podstawiona przy O-2 przez 3-O-D-mannopyranozyl-L-fukopyranozyl, α-D-mannopyranozyl oraz w mniejszym stopniu przez α-L-fukopyranozyl. Mimo iż ten heteropolisacharyd jest zbliżony do występujących u podstawczaków heterogalaktanów, to różni się on strukturą łańcuchów bocznych. Podczas gdy pojedyncze jednostki L-fukopyranozylu czy reszty 3-O-α-mannopyranozyl-L-fukopyranozylu można spotkać również w łańcuchach bocznych innych heterogalaktanów, to α-D-mannopyranozyl jest obecny tylko w fukomannogalaktanie wyizolowanym z żółciaka siarkowego (4).
Lektyny
Hemaglutynująca i hemolityczna lektyna została wyizolowana z owocników za pomocą chromatografii powinowactwa na żelu Sepharose 4B. Kolumnę zrównoważono przy użyciu soli fizjologicznej zbuforowanej fosforanem (PBS), następnie załadowano próbkę i przemywano PBS, aż absorbancja UV przy 280 nm spadła poniżej 0,01. Związaną lektynę eluowano z buforu za pomocą 4% roztworu laktozy. Masę cząsteczkową (około 190 tys.) określono, korzystając z filtracji żelowej oraz elektroforezy w warunkach niedenaturujących. Okazało się, że lektyna ma strukturę tetrametryczną i składa się z dwóch różnych typów podjednostek o masie około 60 tys. oraz 36 tys. Test inhibicji haptenów wykazał, że wyizolowana z Laetiporus sulphureus lektyna jest specyficzna dla reszt N-acetylolaktozaminowych (5).
Badacze kontynuujący pracę nad tą lektyną nazwali ją LSL – Laetiporus sulphureus lectin i potwierdzili, że jest ona tetramerem, zbudowanym z jednostek o masie około 35 kDa połączonych wiązaniami niekowalencyjnymi. Zarówno natywne, jak i rekombinowane formy LSL wykazywały aktywność hemolityczną oraz zdolność do hemaglutynacji i obie te właściwości zostały zahamowane przez N-acetylolaktozaminę. Dodatkowo, delecja w obrębie C-końca spowodowała zachowanie zdolności lektyny do hemaglutynacji, ale nie do hemolizy, co sugeruje, że N-końcowa domena jest odpowiedzialna za rozpoznawanie węglowodanów, a C-końcowa funkcjonuje jako domena oligomeryzująca (6).
Kompleksy polisacharydowo-białkowe
Kompleks polisacharydowo-proteinowy (PPF) obecny w Laetiporus sulphureus składał się w 84% z polisacharydów i w zaledwie 5% z protein. Przeprowadzono również analizę składu aminokwasowego PPF, a z wykrycia amoniaku wnioskowano, że asparagina oraz glutamina występowały częściowo w postaci kwasu asparaginowego oraz kwasu glutaminowego. Analiza monosacharydów wykazała, iż największy udział kompleksu stanowiła fukoza (94,5%), zawartość pozostałych cukrów: glukozy i galaktozy wyniosła odpowiednio 3,2 i 2,3% (7).
Lipidy i kwasy tłuszczowe
Sinanoglou i wsp. zbadali zawartość lipidów oraz kwasów tłuszczowych owocników Laetiporus sulphureus, korzystając z różnych rozpuszczalników (chloroformu i n-heksanu) oraz metod ekstrakcji (ultradźwiękowej i wspomaganej promieniowaniem mikrofalowym). Rozdział lipidów neutralnych (NL) oraz polarnych (PL) przeprowadzono za pomocą TLC-FID. NL dominowały we wszystkich ekstraktach i składały się głównie z triglicerydów oraz steroli, wśród PL przeważały fosfatydylocholiny i fosfatydyloetanoloaminy.
W owocnikach Laetiporus sulphureus wykazano obecność 31 kwasów tłuszczowych: nasyconych (SFA) – dominował kwas palmitynowy (C16:0); jednonienasyconych (MUFA) – kwas oleinowy (C18:1ω-9) oraz wielonienasyconych (PUFA) – kwas linolowy (C18:2ω-6). Biorąc pod uwagę sumę wszystkich kwasów tłuszczowych, PUFA stanowiły większość, a najmniej było MUFA. Łączna zawartość kwasów nienasyconych stanowiła od 77,74 do 79,36% w zależności od rozpuszczalnika oraz metody ekstrakcji, a stosunek kwasów nienasyconych do nasyconych wyniósł od 3,74 do 3,84. Badania wskazują, że zamiana SFA na MUFA oraz PUFA w diecie może zmniejszyć ryzyko chorób sercowo-naczyniowych, przez co wysoka wartość wskaźników MUFA: SFA (≥ 0,78) oraz PUFA: SFA (≥ 2,70) czyni Laetiporus sulphureus wartościowym składnikiem zdrowej diety (8).
Triterpeny
Wśród metabolitów wtórnych syntetyzowanych w żółciaku siarkowym większość (ok. 75%) stanowią triterpenoidy, głównie typu lanostanu (zawierają zazwyczaj 30 atomów węgla oraz posiadają charakterystyczny tetracykliczny szkielet) o charakterze kwasów, estrów, laktonów, alkoholi, eterów, nadtlenków, aldehydów, ketonów czy glukozydów (3).
W wyniku rozdziału etanolowego ekstraktu z wykorzystaniem chromatografii kolumnowej na żelu krzemionkowym i eluowania heksanem, mieszaniną heksanu i octanu etylu (8:2, 7:3, 6:4, 1:1; v/v), samym octanem etylu oraz mieszaniną octanu etylu i metanolu (8:2, v/v) otrzymano szereg frakcji. Frakcje oczyszczano na kolumnie ze złożem Sephadeks LH-20 (2,570 cm, 150 g) oraz za pomocą preparatywnej chromatografii cienkowarstwowej. Wyizolowano pięć wcześniej znanych triterpenów: kwas eburikowy, sulfurenowy, acetyloeburikowy, acetylotrametenolowy oraz 15α-hydroksytrametenolowy, a także nowy triterpen typu lanostanu: kwas 3-oksysulfurenowy (9).
Związki fenolowe
Oznaczono sumę związków polifenolowych w wyciągach: wodnym, metanolowo-wodnym i metanolowym w trzech owocnikach zebranych w puszczy Zielonce oraz lasach okolic Witnicy. Najwyższą zawartość stwierdzono w wyciągach wodnych (0,49-0,88% w przeliczeniu na kwas kawowy), następnie metanolowo-wodnych (0,46-0,63%), a najniższą w metanolowych (0,07-0,22%) (10).
Olennikov i wsp. jako pierwsi wyizolowali z różnych frakcji 70% etanolowego wyciągu z owocników Laetiporus sulphureus związki fenolowe. W trakcie badań otrzymali frakcję: heksanową (LF-1), chloroformową (LF-2), octanu etylu (LF-3), butanolową (LF-4), polisacharydową (LF-6) oraz wodną (LF-5 i LF-7). Badania składu chemicznego poszczególnych frakcji wykazały, że LF-3 zawiera największe stężenie związków fenolowych oraz flawonoidów (odpowiednio 174,73 i 90,77 mg/g), korzystając z chromatografii kolumnowej na żelu krzemionkowym oraz żelu Sephadex LH-20, a następnie z chromatografii preparatywnej, wyizolowano z niej i zidentyfikowano 7 związków fenolowych: kwas p-kumarowy (LF-3/1), kwercetynę (LF-3/2), kemferol (LF-3/3), kwas kawowy (LF-3/4), (+)-katechinę (LF-3/5), kwas galusowy (LF-3/6) oraz kwas 5-kawoilochinowy (LF-3/7). Identyfikacja opierała się na oznaczeniu temperatury topnienia, wartości masy do ładunku jonu molekularnego (m/z), spektroskopii UV, IR oraz 13C-NMR (ryc. 1) (11).
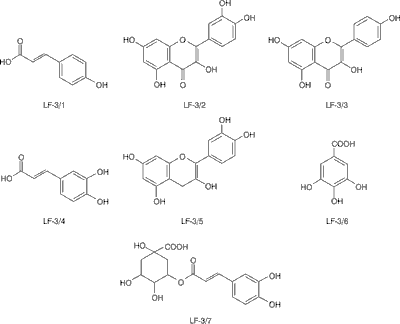
Ryc. 1. Struktury wyizolowanych związków fenolowych (11)
Barwniki
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Szczepkowski A. Grzyby nadrzewne w innym świetle – użytkowanie owocników. Studia i Materiały CEPL w Rogowie 2012; 32/3:172-89.
2. http://indexfungorum.org (data dostępu: 28.02.2021 r.).
3. Grienke U, Zöll M, Peintner U i wsp. European medicinal polypores – A modern view on traditional uses. J Ethnopharmacol 2014; 154(3):564-83.
4. Alquini G, Carbonero ER, Rosado FR i wsp. Polysaccharides from the fruit bodies of the basidiomycete Laetiporus sulphureus (Bull.: Fr.) Murr. FEMS Microbiol Lett 2004; 230:47-52.
5. Konska G, Guillot J, Dusser M i wsp. Isolation and characterization of an N-acetyllactosaminebinding lectin from the mushroom Laetiporus sulphureus. J Biochem 1994; 116:519-23.
6. Tateno H, Goldstein IJ. Molecular cloning, expression and characterization of novel hemolytic lectins from the mushroom Laetiporus sulphureus, which show homology to bacterial toxins. J Biol Chem 2003; 278(42):40455-63.
7. Kang CY, Lee CO, Chung KS i wsp. An antitumor component of Laetiporus sulphurous and its immunostimulating activity. Arch Pharm Res 1982; 5(2):39-43.
8. Sinanoglou VJ, Zoumpoulakis P, Heropoulos G i wsp. Lipid and fatty acid profile of the edible fungus Laetiporus sulphurous. Antifungal and antibacterial properties. J Food Sci Technol 2015; 52(6):3264-72.
9. Leon F, Quintana J, Rivera A i wsp. Lanostanoid triterpenes from Laetiporus sulphureus and apoptosis induction on HL-60 human myeloid leukemia cells. J Nat Prod 2004; 67:2008-11.
10. Szymański M, Kolendowicz M, Szymański A. Badania wyciągów z owocników grzyba Laetiporus sulphureus (Bull.). Post Fitoter 2021; (1):14-22.
11. Olennikov DN, Tankhaeva LM, Agafonova SV. Antioxidant components of Laetiporus sulphureus (Bull.: Fr.) Murr. fruit bodies. Appl Biochem Microbiol 2011; 47:419-25.
12. Weber RWS, Mucci A, Davoli P. Laetiporic acid, a new polyene pigment from the wood-rotting basidiomycete Laetiporus sulphureus (Polyporales, Fungi). Tetrahedron Lett 2004; 45(5):1075-8.
13. Rapior S, Konska G, Guillot J i wsp. Volatile composition of Laetiporus sulphureus. Cryptog Mycol 2000; 21(1):67-72.
14. Wu S, Zorn H, Krings U i wsp. Characteristic volatiles from young and aged fruiting bodies of wild Polyporus sulphureus (Bull.: Fr.) Fr. J Agric Food Chem 2005; 53:4524-8.
15. Siljegovic JD, Stojkovic DS, Nikolic MM i wsp. Antimicrobial activity of aqueous extract of Laetiporus sulphureus (Bull.: fr.) Murill. Matica Srpska Novi Sad 2011; 120:297-303.
16. Turkoglu A, Duru ME, Mercan N i wsp. Antioxidant and antimicrobial activities of Laetiporus sulphureus (Bull.) Murrill. Food Chem 2007; 101:267-73.
17. Jayasooriya RG, Kang CH, Seo MJ i wsp. Exopolysaccharide of Laetiporus sulphurous var. miniatus down-regulates LPS-induced production of NO, PGE2, and TNF-alpha in BV2 microgliacells via suppression of the NF-kB pathway. Food Chem Toxicol 2011; 49(11):2758-64.
18. Mlinaric A, Kac J, Pohleven F. Screening of selected wood-damaging fungi for the HIV-1 reverse transcriptase inhibitors. Acta Pharm 2005; 55:69-79.
19. Hwang HS, Yun JW. Hypoglycemic effect of polysaccharides produced by submerged mycelial culture of Laetiporus sulphureus on streptozotocin – induced diabetic rats. Biotechnol Bioprocess Eng 2010; 15:173-81.
20. Wiater A, Szczodrak J, Pleszczynska M. Mutanase induction in Trichoderma harzianum by cell wall of Laetiporus sulphurous and its application for mutant removal from oral biofilms. J Microbiol Biotechnol 2008; 18(7):1335-41.
21. Seo MJ, Kang BW, Park JU i wsp. Biochemical characterization of the exopolysaccharide purified from Laetiporus sulphurous mycelia. J Microbiol Biotechnol 2011; 21:1287-93.
22. Turkoglu A, Duru ME, Mercan N i wsp. Antioxidant and antimicrobial activities of Laetiporus sulphureus (Bull.) Murrill. Food Chem 2007; 101:267-73.

