*Marcin Szymański, Anna Wrzesińska
Olea europea L. jako źródło oleuropeiny
Olea europea L. as a source of oleuropein
Centrum Zaawansowanych Technologii, Uniwersytet im. Adama Mickiewicza w Poznaniu
Dyrektor Centrum: prof. dr hab. n. chem. Bronisław Marciniak
Streszczenie
Drzewo oliwne jest rośliną długowieczną, wzmianki o nim pojawiają się już w mitologii greckiej oraz Biblii. Obecnie większość plantacji skupia się w obrębie basenu Morza Śródziemnego i Bliskiego Wschodu. Owoc oliwki dojrzewa w sprzyjających warunkach klimatycznych około 5 miesięcy. Połowę zawartości owocu stanowi woda, pozostałe składniki to przede wszystkim: olej, węglowodany, celuloza, związki fenolowe, białka i związki nieorganiczne. Związek ten należy do sekoirydoidów z grupy terpenów, jest glukozydem estru kwasu elenolowego i 3,4-dihydroksyfenyloetanolu. Występuje w wielu rodzajach rodziny Oleaceae i Gentianaceae. Oleuropeina i hydroksytyrozol są odpowiedzialne za ostry i gorzkawy smak oleju.
Summary
The olive tree is a long-lived plant, mentioned already in Greek mythology and the Bible. Currently most plantations is concentrated in the Mediterranean and the Middle East. The fruit of the olive ripens in favorable climatic conditions for about 5 months. Half of the fruit's content is water, the other ingredients are mainly: oil, carbohydrates, cellulose, phenolic compounds, proteins and inorganic compounds. This compound belongs to the terpenes secoids, it is a glucoside of the ester of elenolic acid and 3,4-dihydroxyphenylethanol. It is found in many genera of the Oleaceae and Gentianaceae families. Oleuropein and hydroxytyrosol are responsible for the sharp and bitter taste of the oil.

Wstęp
Przodkiem uprawianej obecnie oliwki europejskiej (Olea europea L.) jest oliwka dzika (Olea silvestris). Najstarsze fragmenty drzewa oliwnego mające około 20 tysięcy lat, co określono metodą datowania węglem C14, znaleziono we Włoszech. Oliwka jest drzewem symbolicznym, wzmianki o niej pojawiają się m.in. w mitologii greckiej oraz Biblii (1). Pozostałości drzewa oliwnego odnaleziono również w Egipcie w grobowcu Tutenchamona. Klimat śródziemnomorski sprzyjał uprawom, a plantacje były zakładane w Prowansji, na Półwyspie Iberyjskim, we Włoszech oraz w Afryce Północnej. Dzięki kolonizatorom drzewo oliwne dotarło do Kalifornii, Meksyku i Ameryki Południowej (2, 3).
Olej z oliwek, zwany oliwą, jest głównym źródłem niezbędnych nienasyconych kwasów tłuszczowych (NNKT) w diecie śródziemnomorskiej, towarzyszą im: tokoferole, karotenoidy, fosfolipidy oraz polifenole (4, 5). Klasyfikacją poszczególnych rodzajów oliwy z oliwek zajmuje się Międzynarodowa Rada ds. Oliwy (6). Większe owoce wykorzystywane są do celów spożywczych, natomiast pozostałe służą do otrzymywania oleju. Olej z pierwszego tłoczenia (na zimno) charakteryzuje się najmniejszą liczbą kwasową (7) i otrzymywany jest w procesach łagodnej obróbki mechanicznej, a następnie poddawany płukaniu, dekantacji, odwirowaniu i filtracji (8). Otrzymany olej zawiera triglicerydy, estry kwasów tłuszczowych, wielonasycone kwasy tłuszczowe (WKT) oraz frakcję niezmydlającą się (tokoferole, fitosterole, pigmenty, fenole) (9).
Cechy morfologiczne
Drzewo oliwne jest długowieczne, osiąga 12 m wysokości i średnicę pnia do 50 cm. Drzewa stare składają się z kilku oddzielnych pozrastanych części. Stare pnie są często dziuplaste, a gałęzie drzewa zwisające. Pień oliwki jest nieregularny. Biel drewna jest wąska, szara do jasnożółtej; twardziel żółtobrązowa do ciemnooliwkowobrązowej; strefy przyrostów rocznych są nieregularne. Drewno jest rozpierzchłonaczyniowe; naczynia małe, uszeregowane w grupach promieniowych, okiem nieuzbrojonym widoczne jako drobne, jasne punkty. Kwiaty są drobne, białe, pachnące, zebrane w grona (10).
Owoc to owalny pestkowiec o długości 2-3 cm, skórka owocu pokryta jest woskiem; w czasie dojrzewania barwa owocu zmienia się z zielonej na fioletową bądź czarną. Mezokarp stanowi 84-90% masy owocu (11, 12).
Liście oliwki są pojedyncze, grube, skórzaste, lancetowate o długości 30-50 mm i szerokości 10-15 mm, z kolczastym wierzchołkiem, zwężającym się u podstawy do krótkiego ogonka. Brzeg liścia wygięty do dołu. Górna powierzchnia jest szarawozielona, gładka i błyszcząca, powierzchnia dolna bledsza i omszona, zwłaszcza wzdłuż nerwu głównego i głównych nerwów bocznych (13).
Występowanie – prawie 99% plantacji skupia się w obrębie basenu Morza Śródziemnego i Bliskiego Wschodu (14-17).
Skład chemiczny
Owoc oliwki dojrzewa w odpowiednich warunkach klimatycznych ok. 5 miesięcy. 50% zawartości owocu stanowi woda, pozostałe składniki to: olej (22%), węglowodany (19%), celuloza (5,8%), związki fenolowe (1-3%), białka (1,6%) i związki nieorganiczne (1,5%) (1).
W trakcie rozwoju owocu oliwki wyróżniamy trzy fazy różniące się zawartością występujących w nich związków (4). W pierwszej fazie wzrostu następuje nagromadzenie oleuropeiny, w drugiej (zielone dojrzewanie) zmniejsza się ilość chlorofilu oraz oleuropeiny, w trzeciej fazie (czarne dojrzewanie) obecne są antocyjany, a spada poziom oleuropeiny (18-20). Oleuropeina występuje głównie w młodych owocach, w których może stanowić do 14% suchej masy (19). W czarnych owocach następuje spadek zawartości oleuropeiny, nawet do zera w niektórych odmianach (Olea europaea var leccino). Spadkowi zawartości oleuropeiny towarzyszy spadek poziomu oleozydów (ligustrozyd) i wzrost niektórych flawonoidów i werbaskozydu. W małych i młodych owocach werbaskozyd występuje w ilościach śladowych, podczas gdy ligustrozyd osiąga wysoką zawartość, a następnie kiedy zielony owoc oliwki osiąga normalny rozmiar, zanika (20, 21).
Liście oliwki i ekstrakty alkoholowe z liści zawierają głównie: sekoirydoidy o charakterze fenoli (oleuropeina, oleurozyd, ligustrozyd); glukozydy estru kwasu elenolowego (oleozyd i jego estry mono- i dimetylowe), fenyloetanoidy (tyrozol i hydroksytyrozol), flawonoidy (7-glukozydy luteoliny, apigeniny i diosmetyny, rutozyd), kwasy fenolowe (kawowy, wanilinowy), katechinę, ponadto pentacykliczne triterpenoidy (erytrodiol, uwaol, kwas oleanolowy); wanilinę oraz sterole (18, 19).
Właściwości farmakologiczne oleuropeiny
Należy do sekoirydoidów z grupy terpenów (22). Jest glukozydem estru kwasu elenolowego i 3,4-di-hydroksyfenyloetanolu (23) o masie cząsteczkowej 540,4 Da. Oleuropeina (ryc. 1) i hydroksytyrozol są odpowiedzialne za ostry i gorzkawy smak (24). Związki fenolowe znajdują się we wszystkich częściach drzewa oliwnego, ale tkanki charakteryzuje zróżnicowany skład i stężenie (25, 26). Największe stężenie oleuropeiny w przeliczeniu na suchą masę jest w młodych owocach i może osiągać 140 mg/g, mniejsze w liściach oliwki od 60 do 90 mg (19, 27). Oleuropeina występuje w wielu rodzajach rodziny Oleaceae (oprócz gatunków z rodzaju Olea), np. we Fraxinus excelsior, F. angustifolia, F. chinensis, Syringa josikaea, S. vulgaris, Philyrea latifolia, Ligustrum ovalifolium; występuje również w rodzinie Gentianaceae.
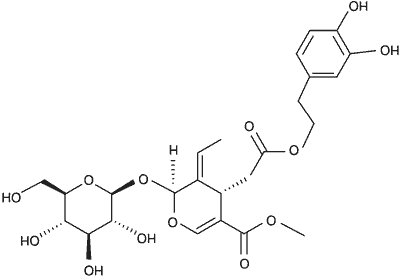
Ryc. 1. Oleuropeina
Oleuropeina wykazuje działanie antyoksydacyjne in vitro i in vivo, przeciwzapalne, przeciwmiażdżycowe, przeciwnowotworowe, przeciwdrobnoustrojowe, przeciwwirusowe.
Organizacja Narodów Zjednoczonych ds. Wyżywienia i Rolnictwa rekomenduje spożywanie 30 g oliwy dziennie (16).
Działanie antyoksydacyjne
Stres oksydacyjny spowodowany jest zwiększoną aktywnością reaktywnych form tlenu (RFT) w następstwie przewagi wolnych rodników nad zdolnością ich rozkładu, przy czym dzięki obecności układów antyutleniaczy komórki tolerują pewien nadmiar RFT. Skutkiem reaktywności RFT jest cytotoksyczność, wynikająca z dążenia do sparowania pojedynczego elektronu, znajdującego się na orbicie walencyjnej lub przekazania go innej cząsteczce. Zbyt duża ilość wolnych rodników powoduje oksydację i peroksydację lipidów, uszkodzenia białek, kwasów nukleinowych oraz inaktywację niektórych enzymów, co może prowadzić m.in. do miażdżycy, cukrzycy, chorób układu sercowo-naczyniowego i innych (28, 29).
Głównymi antyoksydantami w oliwce europejskiej są związki fenolowe o charakterze lipofilnym oraz hydrofilnym (18) wymiatające reaktywne formy tlenu RFT. Jako związki zawierające grupy hydroksylowe wykazują zdolność tworzenia wiązań wodorowych z wolnymi rodnikami, a tym samym blokują ciąg reakcji wywołanych przez RFT (30). Stopień ich działania skorelowany jest z liczbą i położeniem grup hydroksylowych (31), najaktywniejsze są związki posiadające grupy hydroksylowe w pozycjo orto bądź para (32).
Porównanie siły działania antyoksydacyjnego ekstraktu z liścia oliwki z α-tokoferolem wykazało, że α-tokoferol tylko na początku badania wykazuje większe właściwości zmiatające RFT, natomiast ekstrakt działa wolniej, jednak znacznie dłużej (33). Oliwa z oliwek wykazuje silniejsze właściwości antyoksydacyjne niż inne oleje roślinne, a uzyskana w procesie tłoczenia, działa silniej antyoksydacyjnie od uzyskanej w procesie rafinacji (34).
Działanie przeciwmiażdżycowe
Działanie przeciwmiażdżycowe oleuropeiny jest związane z aktywnością antyoksydacyjną, gdyż utlenione lipoproteiny o niskiej gęstości (LDL) biorą udział w patogenezie miażdżycy. Stosowanie naturalnych przeciwutleniaczy może prowadzić do zahamowania produkcji utlenionych LDL i zmniejszenia rozwoju i postępu miażdżycy (35). Liczne badania epidemiologiczne, przeprowadzane w rejonie basenu Morza Śródziemnego, dowodzą, iż dieta bogata w związki fenolowe zmniejsza częstość występowania chorób układu sercowo-naczyniowego (36).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Ryan D, Robards K. Phenolic compounds in olives. Analyst 1998; 123:31R-44R.
2. Knoops KT, de Groot LC, Kromhout D. Mediteranean diet, lifestyle factors, and 10-year mortality in elderly European men and women. J Am Med Assoc 2004; 292:1433-9.
3. Trichopoulou A, Costacou T, Bamia C i wsp. Adherence to a mediterranean diet and survival in a Greek population. N Engl J Med 2003; 348:2599-608.
4. Covas MI, Nyyssonen K, Poulsen HE. The effect of polyphenols in olive oil on heart disease risk factors. Ann Int Med 2006; 145:333-431.
5. Covas MI. Bioactive effects of olive oil phenolic compounds in humans: Reduction of heart disease factors and oxidative damage. Inflammopharmacol 2008; 16:216-8.
6. IOOC Home Page (International Olive Oil Council Activities: World Olive Oil Figures: World Olive Oil Consumption).
7. Fernández AG, Díez MJF, Adams MR. Table Olives: Production and processing. Chapman & Hall; London, UK 1997; 478.
8. Trade Standard Applying to Olive Oils and Olive-Pomace Oils. International Olive Council; Madrid, Spain: 2011. COI/ T.15/NC no. 3/Rev. 6. www.internationaloliveoil.org.
9. Viola P, Viola M. Virgin olive oil as a fundamental nutritional component and skin protector. Clin Dermatol 2009; 27:159-65.
10. Vademecum, Instytut Technologii Drewna Poznań, www.itd.pl.
11. Boskou D, Blekas G, Tsimidou M. Olive oil composition. W: Boskou D (ed.). Olive Oil: Chemistry and Technology. Am Oil Chem Soc Press, Champaign, IL, USA 2006; 1-33.
12. Niaounakis M, Halvadakis CP. Waste Management Series. 2nd ed. Vol. 5. Elsevier; Amsterdam, the Netherlands: Characterization of Olive Processing Waste, 2006; 23-64. Chapter 2.
13. Farmakopea XII wyd. 2020, Pol Tow Farm.
14. Guinda A, Albi T, Camino MCP i wsp. Supplementation of oils with oleanolic acid from the olive leaf (Olea europaea). Eur J Lipid Sci Technol 2004; 106:22-6.
15. Tabera J, Guinda A, Ruiz-Rodriguez A i wsp. Countercurrent supercritical fluid extraction and fractionation of high-added-value compounds from a hexane extract of olive leaves. J Agric Food Chem 2004; 52, 4774-9.
16. FAO Home Page.
17. FAOSTAT Crops Processed Data for Olive Oil. FAO; Rome, Italy 2009.
18. Elamrani A. The antitumoral activity and the cytotoxicity on renal cells of ethanolic extracts from the leaves of four varieties of Olea europaea L. ACL 2011; 1:63-9.
19. Amiot MJ, Fleuriet A, Macheix JJ. Accumulation of oleuropein derivatives during olive maturation. Phytochem 1989; 28(1):67-9.
20. Bianco A, Scalzo LR, Scarpati ML. Isolation of cornoside from Olea europaea and its transformation into halleridone. Phytochem 1993; 23:455-7.
21. Malik NSA, Bradford JM. Changes in oleuropein levels during differentation and development of floral buds in ‘Arbequina’ olives. Sci Horticult 2006; 110:274-8.
22. Soler-Rivas C, Espin JC, Wichers HJ. Oleuropein and related compounds. J Sci Food Agric 2000; 80:1013-23.
23. Fernández-Bolaños J, Rodríguez G, Rodríguez R i wsp. Extraction of interesting organic compounds from olive oil waste. Grasas Aceites 2006; 57:95-106.
24. Vissers MN, Zock PL, Roodenburg AJC i wsp. Olive oil phenols are absorbed in humans. J Nutr 2002; 132:409-17.
25. Kayano T, Burant C, Fukumoto H i wsp. Human facilitative glucose transporters. Isolation, functional characterization, and gene localization of cDNAs encoding an isoform (GLUT5) expressed in small intestine, kidney, muscle, and adipose tissue and an unusual glucose transporter pseudogene-like sequence (GLUT6). J Biol Chem 1990; 265:13276-82.
26. Ortega-Garc´ıa F, Perago J. HPLC analysis of oleuropein, hydroxytyrosol, and tyrosol in stems and roots of Olea europaea L. cv. Picual during ripening. Published online in Wiley Online Library: 20 July 2010.
27. Gryszczyńska A, Gryszczyńska B, Opala B. Liście oliwki europejskiej (Olea europaea L.) – chemizm i zastosowanie w medycynie Post Fitoter 2010; (1):30-7.
28. Bartosz G. Druga twarz tlenu. PWN, Warszawa 1995:24.
29. Berra B, Caruso D, Cortesi N i wsp. Antioxidant properties of minor polar components of olive oil on the oxidative processes of cholesterol in human LDL. La Rivista Italiana delle Sostanze Grasse 1995; 72:285-8.
30. Visioli F, Galli C. The effect of minor constituents of olive oil on cardiovascular disease: new findings. Nutr Rev 1998; 56:142-7.
31. Rice-Evans CA, Miller NJ, Paganga G. Structure antioxidant activity relationship of ?avonoids and phenolic acids. Free Radical Biol Med 1996; 20:933-56.
32. Finotti E, Di Majo D. In?uence of solvents on the antioxidant property of ?avonoids. Nahrung/Food 2003; 47:186-7.
33. Keceli T, Gordon MH. The antioxidant activity and stability of the phenolic fraction of green olives and extra virgin olive oil. J Sci Food Agric 2001; 81:1391-6.
34. Owen RW, Giacosa A, Hull WE i wsp. The antioxidant/anticancer potential of phenolic compounds isolated from olive oil. Eur J Cancer 2000; 36:1235247.
35. Visioli F, Bellomo G, Montedoro G i wsp. Low density lipoprotein oxidation is inhibited in vitro by olive oil constituents. Atheroscler19. Keys A. Mediterranean diet and public health: personal re?ections. Am J Clin Nutr 1995; 61:1321S-3S.
36. Hertog MLG, Feskens EJM, Katan MB i wsp. Dietary antioxidant ?avonoids and risk of coronary heart disease: the Zutphen Elderly Study. Lancet 1993; 342:1007.
37. Visioli F, Bellomo G, Montedoro GF i wsp. Low density lipoprotein oxidation is inhibited in vitro by olive oil constituents. Atherosclerosis 1995; 117:25-32.
38. Benkhalti F, Prost J, Paz E i wsp. Effects of feeding virgin olive oil or their polyphenols on lipid of rat liver. Adv Food Nutr Res 2002; 22:1067-75.
39. Carluccio MA, Siculella L, Ancora MA i wsp. Olive oil and red wine antioxidant polyphenols inhibit endothelial activation: antiatherogenic properties of Mediterranean diet phytochemicals. Arterioscler Thromb Vasc Biol 2003; 23(4):622-9.
40. Manna C, Migliardi V, Golino P i wsp. Oleuropein prevents oxidative myocardial injury by ischemia and reperfusion. J Nutr Biochem 2004; 15:461-8.
41. Ahamad J, Toufeeq I, Khan MA i wsp. Oleuropein: A natural antioxidant molecule in the treatment of metabolic syndrome. Phytother Res 2019; 33(12):3112-28.
42. Perk J, de Backer G, Gohlke H i wsp. Eur Heart J 2012; 33:1635-701.
43. Susalit E, Agus N, Effendi I i wsp. Olive (Olea europaea) leaf extract effective in patients with stage-1 hypertension: comparison with captopril. Phytomedicine 2011; 18(4):251-8.
44. Visioli F, Bellosta S, Galli C. Oleuropein, the bitter principle of olives, enhances nitric oxide production by mouse macrophages. Life Sciences 1998; 62(6):541-6.
45. Hricik DE, Dunn MJ. Angiotensin-converting enzyme inhibitor-induced renal failure: causes, consequences, and diagnostic uses. JASN, 1990; 1(6):845-58.
46. Khayyal MT, El-Ghazaly MA, Abdall DM i wsp. Blood pressure lowering effect of an olive leaf extract (Olea europaea) in L-NAME induced hypertension in rats. Arzneimittelforschung 2002; 52(11):797-802.
47. Perrinjaquet-Moccetti T, Busjahn A, Schmidlin C i wsp. Food supplementation with an olive (Olea europaea L.) leaf extract reduces blood pressure in borderline hypertensive monozygotic twins. Phytother Res 2008; 22:1239-42.
48. Corey EJ. Molecules and medicine. Hoboken, Wiley, 2007; 156.
49. Liu S, Zhao Q, Jiang S. Determination of the HIV-1 gp41 fusogenic core conformation modeled by synthetic peptides: applicable for identification of HIV-1 fusion inhibitors. Peptides 2003; 24:1303-13.
50. Guiqin Z, Zhifeng Y, Junxing D. Antiviral efficacy against hepatitis B virus replication of oleuropein isolated from Jasminum officinale L. var. grandiflorum. J Ethnopharmacol 2009; 125:265-8.
51. Micol V, Caturla N, Pèrez-Fons L. The olive leaf extract exhibits antiviral activity against viral haemorrhagic septicaemia rhabdovirus (VHSV). Antiviral Res 2005; 66:129-36.
52. Shuang-Cheng MA, Zhen-Dan HE, Xue-Long DENG i wsp. In vitro evaluation of Secoiridoid Glucosides from the fruits of Ligustrum lucidum as antiviral agents. Chem Pharm Bull 2001; 49(11):1471-3.
53. Jemai H, El Feki A, Sayadi S. Antidiabetic and antioxidant effects of Hydroxytyrosol and Oleuropein from Olive Leaves in Alloxan-Diabetic Rats. J Agric Food Chem 2009; 57(19):8798-804.
54. Al-Azzawie HF, Saeed Alhamdani MS. Hypoglycemic and antioxidant effect of oleuropein in alloxan-diabetic rabbits. Life Sciences 2006; 78(12):1371-7.
55. Medina E, de Castro A, Romero C i wsp. Comparison of the concentrations of phenolic compounds in olive oils and other plant oils: correlation with antimicrobial activity. J Agric Food Chem 2006; 54:4954-61.
56. Caturla N, Perez Fons L, Estepa A i wsp. Differential effects of oleuropein, a biophenol from Olea europaea, on anionic and zwiterionic phospholipid model membranes. Chem Phys Lipids 2005; 137:2-17.
57. Saija A, Uccella N. Olive biophenols: functional effects on human well-being. Trends Food Sci Technol 2001; 11:357-63.
58. Bisignano G, Tomaino A, Lo Cascio R i wsp. On the in vitro antimicrobial activity of oleuropein and hydroxytyrosol. J Pharm Pharmacol 1999; 51:971-4.
59. Aziz NH, Farag SE, Mousa LAA i wsp. Comparative antibacterial and antifungal effects of some phenolic compounds. Microbios 1998; 93:43-54.
60. Walter WM Jr, Flemming HP, Etchells JL. Preparation of antimicrobial compounds by hydrolysis of oleuropein from green olives. J Appl Bacteriol 1973; 26:773-6.
61. Sudjana AN, D’Orazio C, Ryan V i wsp. Antimicrobial activity of commercial Olea europaea (olive) leaf extract. Int J Antimicrob Agents 2009; 33:461-3.
62. Koruklooglu M, Sahan Y, Yigit A i wsp. Antibacterial activity and chemical constitutions of Olea europaea L. leaf extracts. J Food Process Preserv 2010; 34(3):383-96.
63. Huang MT, Osawa T, Ho CT i wsp. Food phytochemicals for cancer prevention. In Fruits and Vegetables. ACS Symposium Series no. 46. Washington, DC: American Chemical Society 1994.
64. Johnson IT, Williamson G, Musk SRR. Anticarcinogenic factors in plant foods. A new class of nutrients. Nutrition Research Reviews 1994; 7:1-30.
65. Yermilov V, Rubio J, Ohshima H. Formation of 8-nitroguanine in DNA treated with peroxynitrite in vitro and its rapid removal from DNA by depurination. FEBS Letters 1995; 376:207-10.
66. de Rojas-Walker T, Tamir S, Ji H i wsp. Nitric oxide induces oxidative damage in addition to deamination in macrophages DNA. Chem Res Toxicol 1995; 8:473-7.
67. Deiana M, Aruoma OI, Bianchi MDLP i wsp. Inhibition of peroxynitrite dependent DNA base modification and tyrosine nitration by the extra virgin olive oil-derived antioxidant hydroxytyrosol. Free Radical Biology and Medicine 1999; 26:762-9.
68. Tanaka T, Makita H, Kawamori T i wsp. A xanthine oxidase inhibitor 10 acetoxychavicol acetate inhibits azoxymethane-induced colonic aberrant crypt foci in rats. Carcinogenesis 1997; 18:1113-8.
69. Hamdi HK, Castellon R. Oleuropein, a non-toxic olive iridoid, is an anti-tumor agent and cytoskeleton disruptor. Biochem Biophys Res Commun 2005; 334:769-78.
70. Menendez JA, Vazquez-Martin A, Colomer R i wsp. Olive oil’s bitter principle reverses acquired autoresistance to trastuzumab (Herceptin™) in HER2-overexpressing breast cancer cells. BMC Cancer 2007; 7:80.
71. Tan M, Yu D. Molecular mechanisms of erbB2-mediated breast cancer chemoresistance. Adv Exp Med Biol 2007; 608:119-29.
72. Menendez JA, Vazquez-Martin A, Garcia-Villalba R i wsp. tabAnti-HER2 (erbB-2) oncogene effects of phenolic compounds directly isolated from commercial Extra-Virgin Olive Oil (EVOO). BMC Cancer 2008; 8:377.
73. Han J, Talorete TP, Yamada P i wsp. Anti-proliferative and apoptotic effects of oleuropein and hydroxytyrosol on human breast cancer MCF-7 cells. Cytotechnol 2009; 59:45-53.
74. Goulas V, Exarchou V, Troganis AN i wsp. Phytochemicals in olive-leaf extracts and their antiproliferative activity against cancer and endothelial cells. Mol Nutr Food Res 2009; 53:600-8.

