© Borgis - Nowa Pediatria 4/2001, s. 26-29
Urszula Jędrasiak, Małgorzata Kępińska
Rola makrofagów w reakcjach immunologicznych okresu okołoporodowego
Role of macrophages in immunological reactions of perinatal period
z Kliniki Neonatologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: dr med. Izabella Radomska
Streszczenie
Basic immunological mechanisms associated with macrophages system have been presented. The significance of monocytosis in perinatal period has been raised.

Układ immunologiczny obejmuje wiele tkanek, komórek i rozpuszczalnych w płynach ustrojowych cząsteczek: przeciwciał, cytokin, mediatorów zapalnych, składników dopełniacza. Działa i wspólnie funkcjonuje ze wszystkimi innymi układami organizmu, takimi jak układ neuroendokrynny, oddechowy, pokarmowy, moczowo-płciowy, mięśniowo-szkieletowy. Elementy tego układu znajdują się w każdej części ciała, wiele z nich przemieszcza się po całym organizmie, często zmierzając w określonym kierunku. Naczelną pozycję w odpowiedzi immunologicznej zajmują leukocyty, do których zaliczamy: limfocyty B produkujące przeciwciała, limfocyty T produkujące cytokiny, fagocyty oraz niektóre komórki pomocnicze np. bazofile. Komórki fagocytujące, to ważna grupa leukocytów. Obejmuje ona monocyty, makrofagi czyli tkankowe monocyty oraz wielopłatowe neutrofile. Komórki te wiążą mikroorganizmy, neutralizują je, a następnie niszczą. Działają jako pierwsza linia obrony – rozpoznają obce antygeny. Choć fagocytoza może dotyczyć różnych cząsteczek i komórek, największe znaczenie dla organizmu ma niszczenie drobnoustrojów. Fagocyty korzystają z pomocy innych elementów układu immunologicznego. Limfocyty B produkują przeciwciała opłaszczające antygeny i ułatwiające ich zniszczenie (opsonizacja), limfocyty T – cytotkiny, zwrotnie aktywujące fagocyty. Cząstki układu dopełniacza mogąc wiązać się z powierzchnią mikroorganizmu również ułatwiają proces fagocytozy. Sprawne działanie układu odpornościowego to działanie zbiorowe, zależne od wzajemnych interakcji składników komórkowych i humoralnych. Układ rozwija się od pierwszych tygodni życia płodowego i nadal po urodzeniu. Większość komórek wywodzi się z niezróżnicowanych macierzystych komórek hemopoetycznych tzw. komórek pnia (ang. HSC – haemopoetic stem cells). U płodu są one obecne początkowo w woreczku żółtkowym, a następnie w wątrobie, śledzionie i szpiku. Po urodzeniu znajdują się tylko w szpiku. Komórki te pod wpływem czynników mikrośrodowiskowych, między innymi interakcji między komórkami zrębu, działania cytokin, różnicują się w kierunku czterech linii komórkowych:
– linia erytroidalna,
– linia megakariocytowa,
– linia mieloidalna (granulocyty i fagocyty jednojądrzaste),
– linia limfoidalna (limfocyty).
Relatywnie mała ilość pluripotentnych komórek progenitorowych – komórek pnia, mających zdolność samoodnowy i różnicowania, daje początek dużej liczbie funkcjonalnie różnych komórek. Pierwszą komórką wywodzącą się z komórki pnia jest komórka zdolna do tworzenia kolonii – CFU (colony forming unit). CFU-GEMM to mielopoetyczna komórka macierzysta, która różnicuje się w kierunku wszystkich komórek krwi z wyjątkiem limfocytów. Komórki te pod wpływem czynników stymulujących powstawanie kolonii – CSF (ang. colony stimulating factor) oraz pod wpływem interleukin pochodzących głównie ze zrębowych komórek szpiku proliferują do:
– CFU-GM – prekursora granulocytów i monocytów,
– CFU-B – prekursora bazofili,
– CFU-E – prekursora eozynofili,
– BFO-E – prekursora szybko rozmnażających się kolonii erytroidalnych.
Linia limfoidalna pochodzi z odrębnej limfoidalnej komórki macierzystej (ryc. 1).
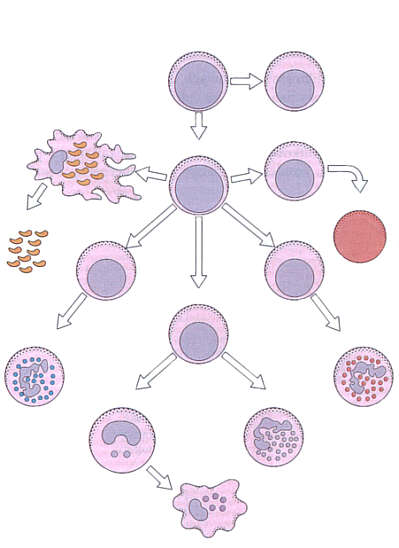
Ryc. 1. Rozwój granulocytów i monocytów.
Mielopoeza rozpoczyna się w wątrobie płodu około szóstego tygodnia ciąży. Pojedyncze komórki pnia, a także CFU-GEMM (komórka progenitorowa dla szeregu granulocytarnego, erytrocytarnego, megakariocytowego i monocytarnego) występują w woreczku żółtkowym już w 5 tygodniu życia płodowego. Krążąca krew przenosi pluripotentne komórki pnia z woreczka żółtkowego do wątroby. Wprawdzie 6-tygodniowy zarodek ma zawiązki szpiku, ale do 4 miesiąca życia płodowego nie stanowią one aktywnego ośrodka hematopoezy. Pierwsze komórki pnia zasiedlają szpik około 8 tygodnia życia płodowego; proces ten trwa do około 22 tygodnia. Obojczyki są pierwszymi kośćmi, w których rozpoczyna się hematopoeza. Pierwsze komórki wywodzące się z komórki pnia to właśnie CFU-GEMM. Dopiero po około 2 tygodniach powstaje limfoidalna komórka macierzysta, dająca początek limfocytom. Limfoidalne komórki macierzyste migrują do zawiązka grasicy, gdzie różnicują się pod wpływem mikrośrodowiska nabłonka do limfocytów grasiczych zwanych tymocytami.
Komórką prekursorową dla monocytów jest CFU-GM. Pod wpływem M-CSF (monocyte-colony stimulating factor), GM-CSF (granulocyte/monocyte colony stimulating factor) i IL-3 różnicuje się do monoblasta, a następnie do promonocyta i dojrzałego monocyta. Czas życia monocyta w szpiku jest krótki. Promonocyty opuszczają szpik kostny, wędrując z krwią jako monocyty. W całkowitej puli krążących monocytów możemy, podobnie jak w przypadku neutrofili, wyróżnić pulę krążącą i marginalną, uruchamianą w razie potrzeby. Pod wpływem czynników chemotaktycznych składników dopełniacza, komórki fagocytujące mogą gromadzić się w miejscu zakażenia. We krwi przebywają krótko, od 36 do 104 godzin. Po kilku dniach opuszczają łożysko naczyniowe, przechodząc przez śródbłonek naczyń. W tkankach różnicują się w makrofagi, tworząc tam pulę komórek trzykrotnie większą od krążących monocytów. Krążące monocyty stale uzupełniają populację osiadłych makrofagów tkankowych, gdzie przeżywają nawet do dwóch lat. Monocyty, które wywędrowały z naczyń, nigdy już nie wracają do krwiobiegu.
Monocyty występujące we krwi i makrofagi tkankowe określa się wspólną nazwą układu monocytomakrofagowego. Komórki zasiedlające tkanki i dojrzewające tam pod wpływem czynników tkankowych niszczą antygeny znajdujące się w krążeniu, a makrofagi węzłów chłonnych – niszczą antygeny dostarczane z limfą (ryc. 2).
| ukŁad fagocytÓw jednojĄdrzastych |
| Szpik | Krew | Tkanki |
Komórka pnia = pluripotencjalna
komórka macierzysta
ß
macierzysta komórka mielopoetyczna (CFU-GEMM)
ß
monoblast
ß
promonocyt
ß
monocyt | monocyty | komórki Kupfera w wątrobie
śródkłębkowe komórki mezangium nerki
makrofagi pęcherzyków płucnych
makrofagi błon surowiczych
mikroglej mózgu
makrofagi zatoki śledziony
makrofagi błon maziowych
osteoklasty |
Ryc. 2. Układ fagocytów jednonądrzastych.
W przeciwieństwie do makrofagów, mikrofagi czyli granulocyty żyją krótko. Okres półtrwania we krwi wynosi 6-8 godzin, czas życia w tkankach zaledwie 1-2 dni. Średnica dojrzałego granulocyta wynosi 12-15 mikrometrów, monocyta 15-20. Stąd podział fagocytów na mikro- i makrofagi. Monocyty są dojrzalszymi fagocytami. Nie tylko usuwają obce antygeny z krwi i tkanek, ale również prezentują antygen limfocytom T. Fagocytują mikroorganizmy, komórki nowotworowe, a także martwe i zużyte komórki ciała. Wiążą się z nimi dzięki specjalnym receptorom. Są wśród nich receptory MFR wiążące się z cukrami komórek bakteryjnych. Cząstki CD 14 na powierzchni komórek są receptorami dla białka wiążącego lipopolisacharydy (LPG), występującego w surowicy i pokrywającego Gram--ujemne bakterie. Monocyty mają również receptory Fc dla immunoglobulin G oraz E, a także receptory dla dopełniacza. Antygeny MHC, klasy II występujące na pewnych monocytach są ważne dla prezentacji antygenu limfocytom T. Monocyty mają również receptory dla cytokin (IL-2, IL-4, IFN gamma). Cytokiny produkowane przez limfocyty T aktywują makrofagi, które z kolei rozpoczynają produkcję własnych cytokin (IFN, IL-1, TNF alfa, IL-6). IL-1 produkowana m.in. przez makrofagi stymuluje produkcję białek ostrej fazy w wątrobie, indukuje gorączkę (mniejszej ilości monocytów u wcześniaków przypisuje się brak odczynów gorączkowych w tej grupie dzieci w przebiegu infekcji). IL-1 aktywuje leukocyty oraz zwiększa ich adhezję do komórek śródbłonka. Produkowana między innymi przez monocyty IL-6 jest jednym z centralnych czynników regulujących mechanizmy obronne. Stymuluje syntezę białek ostrej fazy. Pobudza różnicowanie limfocytów T do limfocytów cytotoksycznych oraz limfocytów B do plazmocytów produkujących przeciwciała, podwyższa temperaturę ciała. Razem z IL-3, IL-6 stymuluje proliferację i różnicowanie pluripotencjalnych komórek macierzys-tych szpiku, pobudza krwiotworzenie. Ma szczególnie duży wpływ na CFU-GM, co prowadzi do neutrofilii w pierwszej fazie zakażenia. Jeśli nawet nie są w stanie usunąć intruzów z krwi i płynów tkankowych, wyzwalają odpowiedź immunologiczną przez prezentację antygenu limfocytom T. Makrofagi biorą również udział w regulacji procesów krwiotworzenia, produkując liczne hemopoetyczne czynniki wzrostu. Wykazano, że odgrywają istotną rolę w produkcji erytropoetyny. Podsumowując rolę monocytów można stwierdzić, że ich znaczenie w reakcjach immunologicznych jest ogromne.
Noworodek rodzi się z dużą liczbą fagocytów: granulocytów obojętnochłonnych i monocytów oraz komórek NK (natural killers). Selektywna leukocytoza jest m.in. wynikiem wzrostu we krwi poziomu katecholamin i kortyzolu w czasie porodu. Jest zjawiskiem dobroczynnym dla noworodka i ma wyrównać niedobory jakościowe procesu fagocytozy. Krew pępowinowa zawiera dużo komórek prekursorowych, głównie CFU-GM oraz CFU-G. Monocytoza krwi pępowinowej jest szczególnie wysoka między 38 a 39 tygodniem ciąży. W pobliżu terminu porodu można więc mówić o fizjologicznej monocytozie okresu noworodkowego. Być może wiąże się to z pewnymi zjawiskami immunologicznymi towarzyszącymi prawidłowemu porodowi. Niektórzy autorzy udowadniają, iż poród fizjologiczny związany jest z aktywacją procesów immunologicznych w obrębie płodu i łożyska. Aktywacja układu monocytomakrofagowego może być jednym z mechanizmów wywołujących poród (10). Wzrost IL-6 w krążeniu płodowym, której źródłem są głównie płodowe monocyty, ma prowadzić do indukcji porodu.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Roitt I. et al.: Immunologia, 1996. 2. Xanthon M.: Neonatal haematology and immunology II, 1993. 3. Bruinzeel-Koomen C.A.F.M.: Immunopharmacology of macrophages and other antigen presenting cells. 4. Steinborn A. et al.: Spontaneous labur at term is associated with fetal monocyte activation. Clin. Exp. Immunol., 1999, 117:147-152. 5. Rajadurai V.S. et al.: Monocytosis in preterm infants. Early Human Development, 1992, 223-229. 6. Witek-Janusek L., Mathews H.L.: Differential effects of glucocorticoids on colony stimulating factors produced by neonatal mononuclear cells. Pediatric Research, 1999, 45, 2:224-229. 7. Engle W.A. et al.: Neonatal white blood disorders. Seminars in perinatology 1983, 7, 3:184-198. 8. Ikeno K. et al.: Increased macrophage-colony stimulating factor levels in neonates with perinatal complications. Early Human Development 1996, 46:229-237. 9. Al.-Mulla Z.S., Christensen R.D.: Neutropenia in the neonate. Perinatal hematology Sept. 1995, 22, 3:711-734. 10. Southwick F.S., Purich D.L.: Mechanisms of disease: intracellular pathogenesis of listeriosis. The New England Journal of Medicine 1996, 334, 12:770-776. 11. Lanzkowsky Ph.: Manual of pediatric hematology and oncology 3 ed. 12. Sallas N.: Perinatal listeriosis: A population-based multicenter study in Barcelona, Spain (1990-1996). Obstet. Gynecological Surv. 1999, 54, 6:358-360.

