© Borgis - Postępy Nauk Medycznych 3/2012, s. 241-246
*Monika P. Kuźmińska
Witamina D a układ oddechowy
Vitamin D and respiratory tract
Klinika Medycyny Rodzinnej, Chorób Wewnętrznych i Chorób Metabolicznych Kości Centrum Medycznego Kształcenia Podyplomowego, Warszawa
Kierownik Kliniki: prof. dr hab. med. Ewa Marcinowska-Suchowierska
Streszczenie
Witamina D odgrywa istotną rolę w modulacji funkcji wrodzonego układu odpornościowego i w odpowiedzi organizmu na drobnoustroje. Bierze ona aktywny udział w produkcji naturalnych antybiotyków, zwanych też antydrobnoustrojowymi (PAD) z wykorzystaniem receptorów szlaku Toll (TRL) obecnych na monocytach i makrofagach. Do antybiotyków należą defensyny i katelicydyny. Antybiotyki naturalne w swoim genomie posiadają sekwencję (VDRE) łączącą się z receptorem dla witaminy D (VDR).
W piśmiennictwie publikowanych jest wiele prac, potwierdzających znaczenie witaminy D w różnych schorzeniach układu oddechowego zarówno w rozwoju choroby, jak i w leczeniu. Pierwszą jednostką chorobową badaną w tym kontekście była gruźlica, obecnie wiadomo, że witamina D ma znaczenie w leczeniu również innych infekcji układu oddechowego, zarówno bakteryjnych, jak i wirusowych. Publikowane są również prace na temat udziału witaminy D w terapii astmy, POChP, mukowiscydozy.
Wyniki badań naukowych brzmią obiecująco, ciągle jednak daleka jest droga do wyciągnięcia wniosków na temat dawek witaminy D, które można by stosować, i konkretnych zaleceń klinicznych. Tematyka dotycząca witaminy D w schorzeniach układu oddechowego ciągle jest więc w fazie eksperymentów klinicznych, a liczba badań, która nawiązuje do tej tematyki jest coraz większa.
Summary
Vitamin D plays an important role in the modulation of innate immune system function and the body’s response to microorganisms. It takes an active part in the production of natural antibiotics which are also called natural antimicrobial antibiotics (PAD) using Toll-like receptor pathway (TRL) present on monocytes and macrophages. The antimicrobial antibiotics produced through vitamin D include defensins and cathelicidins.
Natural antibiotics contain in its genome sequence VDRE linking the vitamin D receptor (VDR) on the basis of published studies effects of vitamin D in various respiratory diseases is well known. The first single disease research in this context was tuberculosis, we now know that vitamin D is important in the treatment of the other respiratory infections, both bacterial and viral. Many articles are published also on the involvement of vitamin D in the treatment of asthma, COPD, cystic fibrosis. The scientific results sound promising, but still a long way to draw conclusions about doses and use of vitamin D in diseases of the respiratory system and no the specific clinical recommendations. Vitamin D topics are therefore still in the phase of clinical experiments.

WPROWADZENIE
Oddziaływanie witaminy D na funkcję układu oddechowego sięga bardzo daleko, do poziomu komórkowego i modyfikacji z wykorzystaniem receptora dla witaminy D na poziomie genowym.
Pierwsze badania, jakie przeprowadzono w tej dziedzinie, dotyczyły wrodzonego układu odpornościowego i prątków gruźlicy.
Wykorzystując model prątków gruźlicy udało się dokładnie prześledzić, w jaki sposób witamina D reguluje reakcję organizmu na drobnoustrój. W chwili obecnej wiadomo, że podobne reakcje dotyczyć mogą innych zakażeń bakteryjnych i wirusowych (1-4).
W odpowiedź naszego organizmu na drobnoustroje włączone są tzw. antybiotyki naturalne, inaczej antydrobnoustrojowe (PAD), do których produkcji dochodzi z wykorzystaniem obecności na makrofagach i monocytach specjalnych receptorów szlaku Toll (toll like receptors – TLR) oraz modulacji tych reakcji za pomocą witaminy D.
ANTYBIOTYKI NATURALNE, ANTYDROBNOUSTROJOWE (PAD)
Defensyny i katelicydyny należą do tzw. antybiotyków antydrobnoustrojowych (PAD), nazywanych także antybiotykami naturalnymi. Strukturalnie są to oligo- i polipeptydy, które zabijają drobnoustroje lub hamują ich wzrost. Działają bakteriobójczo na bakterie Gram-ujemne i Gram-dodatnie, neutralizują toksyny, działają antywirusowo.
Działanie PAD polega m.in. na:
– działaniu chemotaktycznym na neutrofile, monocyty, kom. T,
– działaniu proangiogennym i naprawczym,
– indukcji cytokin w kk. nabłonkowych i monocytach,
– neutralizacji endotoksyn,
– degranulacji mastocytów i uwalnianiu histaminy,
– interakcji z komplementem,
– aktywacji komórek dendrytycznych,
– działaniu opsonizacyjnym,
– działaniu antagonistycznym na ACTH,
– zahamowaniu oksydazy neutrofili.
Katelicydyny i defensyny występujące u człowieka przedstawiono w tabeli 1.
Tabela 1. Katelicydyny i defensyny występujące u człowieka (5).
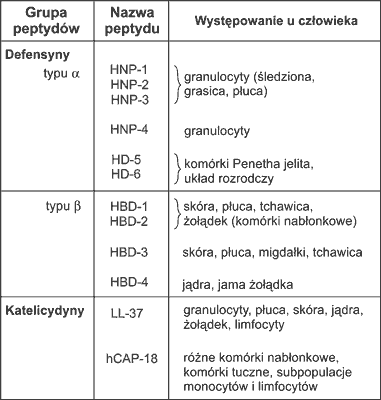
We wrodzonym systemie odpornościowym układu oddechowego istotną i dobrze już poznaną rolę odgrywają katelicydyna (IL-37) oraz defensyna B2 (HB2/DEFB4); właśnie ich działanie poznane zostało w kontekście regulacji systemu za pomocą witaminy D.
Za kodowanie defensyn odpowiadają geny trzyeksonowe, za katelicydynę czteroeksonowe.
Oba rodzaje peptydów mają w swoim genomie obszary VDREs, czyli vitamin D response elements, umożliwiające poprzez swoją sekwencję nukleotydów połączenie z VDR, czyli receptorem witaminy D.
RECEPTORY NA MAKROFAGACH I MONOCYTACH
Receptory rozpoznające drobnoustrój poznane zostały na modelu reakcji w przebiegu infekcji prątkami gruźlicy tbc. Badania te pokazały drogę rozpoznawania lipoprotein drobnoustroju przez receptory szlaku toll (TLR) i udział witaminy D w łańcuchu reakcji doprowadzających do powstania peptydów antydrobnoustrojowych. Receptory szlaku toll uznawane są za tzw. pierwszą linię obrony organizmu przed drobnoustrojami.
Wyróżniamy dwa typy receptorów TLR: TLR1 i TLR2. Są one zlokalizowane na monocytach i makrofagach i, jak wspomniano, reagują z lipoproteinami w błonie komórkowej, między innymi M. tuberculosis.
Oprócz nich istnieją jeszcze receptory NLR (NOD – like receptors) – receptory szlaku NOD; w odróżnieniu od receptorów TLR indukują one wrodzoną odpowiedź immunologiczną poprzez rozpoznanie substancji wydzielanych przez bakterie do cytosolu.
Receptory NOD1 rozpoznają peptydoglikany, a NOD2 – muramylo dipeptydy (MDP). Badania pokazują, że receptor NOD2 uczestniczy w powstawaniu IL-1B z pro-IL-1B przez aktywację kaspazy-1, co stymuluje powstawanie defensyny B2 przy udziale VDR (6).
Receptor dla witaminy D
Istnieje wiele badań opisujących genetyczne uwarunkowania podatności na gruźlicę, w tym również dotyczące receptora dla witaminy D (7-11). Wiadomo również, że receptor witaminy D, czyli VDR, po połączeniu ze swoim ligandem, którym jest aktywna forma witaminy D, czyli 1,25(OH)2D, pełni funkcję przełącznika genowego. Kompleks taki [VDR + 1,25(OH)2D] łączy się z sekwencją nukleotydów, która znajduje się w genomie peptydów antydrobnoustrojowych, a nazywana jest VDRE, czyli reagującą na VDR. W efekcie tego dochodzi do transkrypcji genu w mRNA i produkcji antybiotyków antydrobnoustrojowych.
Mechanizm produkcji peptydów antydrobnoustrojowych przy współudziale witaminy D
Detekcja drobnoustroju odbywa się na poziomie receptorów TLR1 i TLR2, znajdujących się na dwóch typach komórek – makrofagach i monocytach (ryc. 1).
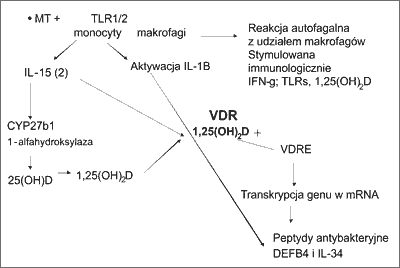
Ryc. 1. Produkcja peptydów antydrobnoustrojowych: defensyny B2 i katelicydyny.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Beser E, Cakmakci T: Factors affecting the morbility of vitamin D deficiency rickets and primary protection. East Afr Med 1994; 71: 358-362.
2. Muhe L, Luseged S, Mason KE, Simoes EA: Case-control study of the role of nutritional rickets in the risk of developing pneumonia in Ethiopian children. Lancet 1997; 349: 1801-1804.
3. Najada AS, Habashneh MS, Khader M: The frequency of nutritional rickets among hospitalized infants and its relation to respiratory diseases. J Trop Pediatr 2004; 50: 364-368.
4. Laaksi T, Ruohola JP, Tuohimaa P, Auvien A et al.: An association of serum vitamin D concentrations<40 nmol/l with acute respiratory tract infection in young Finnish men. Am J Clin Nutr 2007; 86: 714-717.
5. Witkowska D, Bartyś A, Gamian A: Defensyny i katelicydyny jako naturalne antybiotyki peptydowe. Postępy Hig Med Dośw 2008; 62: 694-707.
6. Yang Y, Yin C, Pandey D et al.: NOD2 pathway activation by MDP or Mycobacterium tuberculosis infection involves the stable polyubiquitination of Rip2. J Biol Chem 2007; 282: 36223-36229.
7. Bornam I, Campbell SJ, Fielding K et al.: Vitamin D receptor polymorphism and suspectibility to tuberculosis in West Africa: case-control and family study. J Infect Dis 2004; 190: 1631-1641.
8. Bellamy R, Ruwende C, Corrah T et al.: Tuberculosis and chronic hepatitis b virus infection in africans and variation in the vitamin D receptor gene. Infect Dis 1999; 179: 721-724.
9. Selvaraj P, Narayanan PR, Reetha AM: Association of vitamin D receptor genotypes with the suspectibility to pulmonary tuberculosis in female patients& resistance in female contacts. Indian J Med Res 2000; 111: 172-179.
10. Liu W, Cao WC, Zhang CY et al.: VDR and NRAMP1 gene polymorphisms in suspectibility to pulmonary tuberculosis among the Chinese Han population: a case – control study. Int J Tuberc Lung Dis 2004; 8: 428-434.
11. Wilkinson RJ, Llewelyn M, Toossi Z, Patel P et al.: Influence of vitamin D deficiency and vitamin D receptor polymorphism on tuberculosis among Guajarti Asians In West London: a case-control study. Lancet 2000; 355: 618-621
12. Morocos MM, Gabr AA, Samuel S, Kamel M et al.: Vitamin D administration to tuberculous children and its value. Boll Chim Farm 1998; 137: 157-164.
13. Nursyam EW, Amin Z, Rumende CM: The effect of vitamin D as supplementary treatment in patients with moderately advanced pulmonary tuberculous lesions. Acta Med Indones 2006; 38: 3-5.
14. Adams JS, Ren J, Liu PT, Chun RF et al.: Vitamin D-directed rheostatic regulation of monocytes antibacterial responses. J Immunol 2009; 182: 4289-4295.
15. Shin DM, Yuk JM, Lee HM, Lee SH, Son JW, Harding CV et al.: Mycobacterial lipoprotein activates autophagy via TLR2/1/CD14 and functional vitamin D receptor signaling. Cell Microbiol 2010; 12(11): 1648-1665.
16. Cannell JJ, Vieth R, Umahau JC, Holick MF, Grant S et al.: Epidemic influenza and vitamin D. Epidemiol Infect 2006; 134: 1129-1140.
17. Wayse W, Yousafzai K, Mogale K et al.: Association of subclinical vitamin D deficiency with severe acute lower respiratory infection in Indian children under 5 y. Eur J Clin Nut 2004; 58: 563-567.
18. Li-Ng M, Aloia JF, Pollack S, Cunha M et al.: A randomized controlled trial of vitamin D3 supplementation for the prevention of symptomatic upper respiratory tract infections. Epidemiol Infect 2009; 137: 1-9.
19. Urashima M, Segawa T, Okazaki M, Kurihara M et al.: Randomized trial of witamin D supplementation to present seasonal influenza in schoolchildren. Am J Clin Nutr 2010; 91: 1255-1260.
20. Brehm JM, Schuemann B, Fuhlbrigge AI et al.: Serum vitamin D levels and severe asthma exacerbations in the childhood. Asthma Management Program study. J Allergy Clin Immun 2010; 126: 52-58.
21. Black PN, Scragg R: Relationship between serum hydroxyvitamin D and pulmonary function in the third national health and nutrition examination survey. Chest 2005; 134: 3792-3798.
22. Burns JS, Dockery DW, Neas LM, Schwartz J et al.: Low dietary nutrient intakes and respiratory health in adolescents. Chest 2007; 132: 238-245.
23. Xystrakis E, Kusumakar S, Boswell S et al.: Reversing the defective induction of IL-10 secreting regulatory t cells in glucocotricoid-resistant asthma patients. J Clin Inves 2006; 116: 146-155.
24. Searing DA, Hang Y, Murphy JR et al.: Decreased serum vitamin D levels in children with asthma are associated with increased corticosteroid use. J Allergy Clin Immunol 2010; 125: 995-1000.
25. Hypponen E, Sovio U, Wjst M et al.: Infant vitamin D supplementation and allergic conditions in adulthood, northern Finland birth cohort 1966. Ann Ny Acad Sci 2004; 1037: 84-95.
26. Back O, Blomquist HK, Hernell O et al.: Does vitamin D intake during infancy promote the development of atopic allergy. Acta Derm Venerol 2009; 89: 28-32.
27. Gale CR, Robinson SM et al.: Maternal vitamin status during pregnancy and child outcomes. Eur J Clin Nutr 2008; 62: 68-77.
28. Camargo CA Jr, Rifas-Shiman SL, Litonjua AA, Rich-Edwards JW, Weiss ST, Gold DR et al.: Maternal intake of vitamin D during pregnancy and risk of recurrent wheeze in children at 3 y of age. Am J Clin Nutr 2007; 85: 788-795.
29. Devereux G, Litonjua AA, Turner SW, Craig LC, McNeill G, Martindale S et al.: Maternal vitamin D intake during pregnancy and early childhood wheezing. Am J Clin Nutr 2007; 85: 853-859.
30. Janssens W, Boullion R, Claes B et al.: Vitamin D deficiency is highly prevalent in COPD and correlates with variants in the vitamin D-binding gene. Thorax 2010; 65: 215-220.
31. Franco CB, Paz-Filho G, Gomes PE et al.: Chronic obstructive pulmonary disease is associated with osteoporosis and low levels of vitamin D. Osteoporos In 2009; 20: 1881-1187.
32. Biskobing DM: COPD and osteoporosis. Chest 2002; 121: 609-620.
33. Jorgensen NR, Schwarz P, Holme I et al.: The prevalence of osteoporosis in patients with chronic obstructive pulmonary disease: a cross sectional study. Respir Med 2007; 101: 177-185.
34. Ohara T, Hirai T, Muro S et al.: Relationship between pulmonary emphysema and osteoporosis assessed by CT in patients with COPD. Chest 2008;134: 1244-1249.
35. Ginde AA, Mansbach JM, Camargo CA et al.: Association between serum 25-hydroxyvitamin D level and upper respiratory tract infection. In the Third National Health and Nutrition Examination Survey. Arch Intern Med 2009; 169: 384-390.
36. Van Wetering S, Sterk PJ, Rabe KF, Hiemstra PS: Defensins: key players or bystanders in infection, injury, and repair in the lung? J Allergy Clin J 1999; 104: 1131-1138.
37. Kikkinen A, Knekt P, Heliovaara M et al.: Vitamin D status and the risk of lung cancer: a cohort study in Finland. Cancer Epidemiol Biomarkers Prev 2008; 26(34): 3274-3278.
38. Dogan I, Onen HI et al.: Polymorphisms in the vitamin D receptor gene and risk of lung cancer. Med Sci Monit 2009; 15: BR232-BR242.


