© Borgis - Postępy Nauk Medycznych 1/2016, s. 49-55
*Izabela Siemion-Szcześniak, Dorota Wyrostkiewicz
Mykobakteriozy – rozpoznawanie i leczenie
Mycobacteriosis – diagnosis and treatment
I Klinika Chorób Płuc, Instytut Gruźlicy i Chorób Płuc, Warszawa
Kierownik Kliniki: prof. dr hab. med. Jan Kuś
Streszczenie
Mykobakteriozy to choroby wywołane przez prątki kwasooporne inne niż prątki gatunku Mycobacterium tuberculosis complex i Mycobacterium leprae. Zapadalność na choroby wywołane przez prątki niegruźlicze (NTM) na całym świecie wzrasta. NTM mogą powodować choroby skóry, tkanek miękkich, węzłów chłonnych, układu kostno-stawowego, jednak najczęstszą manifestacją zakażenia jest choroba płuc. Zwiększone ryzyko zachorowania dotyczy pacjentów ze współistniejącymi chorobami układu oddechowego, jak rozstrzenie oskrzeli, przewlekła obturacyjna choroba płuc, pylica krzemowa, mukowiscydoza czy proteinoza. Wykrycie NTM w materiale od chorego nie jest dowodem choroby, ponieważ może wynikać jedynie z kolonizacji dróg oddechowych, dlatego muszą być dodatkowo spełnione kryteria kliniczne i radiologiczne. Zalecenia dotyczące leczenia mykobakterioz opracowano na podstawie opinii ekspertów oraz w oparciu o randomizowane badania kliniczne. Leczenie mykobakterioz jest trudne, wymaga długotrwałej i wielolekowej terapii. Wyniki leczenia są gorsze w porównaniu z wynikami leczenia gruźlicy, częściej również obserwowane są działania niepożądane stosowanych leków. W wybranych przypadkach może być uzupełnione leczeniem operacyjnym. Istnieje potrzeba opracowania skuteczniejszych schematów leczenia oraz prowadzenia badań mających na celu lepsze zrozumienie mechanizmów prowadzących do wystąpienia i postępu choroby.
Summary
Nontuberculosis mycobacteria (NTM) are mycobacterial species other than the Mycobacterium tuberculosis complex and Mycobacterium leprae. The incidence of NTM is increasing worldwide. A variety of manifestations of NTM infection have been described, but the lungs remain the most commonly involved site. Most individuals with disease have an underlying structural lung disease such as bronchiectasis, chronic obstructive pulmonary disease, pneumoconiosis, cystic fibrosis or proteinosis. NTM are frequent contaminants of clinical samples, and diagnosis not rest upon culture alone, but also clinical and radiographic findings. Current treatment guidelines are based on limited data derived mostly from expert opinion, case series, and few randomized clinical trials. Treatment for NTM varies between species but is usually with multiple antimycobacterial agents for a prolonged period of time. Drug intolerance is common and outcomes for many species are inferior to those seen in tuberculosis. Surgery may also be employed in selected cases. There is a need for the development of better treatment regimens and for research aimed at understanding the mechanisms leading to disease susceptibility and progression.

Wprowadzenie
Mykobakteriozy to choroby wywołane przez prątki kwasooporne inne niż prątki gatunku Mycobacterium tuberculosis complex (Mycobacterium tuberculosis, Mycobacterium bovis, Mycobacterium africanum) i Mycobacterium leprae, określane jako prątki niegruźlicze (ang. nontuberculosis mycobacteria – NTM), MOTT (ang. mycobacteria other than tuberculosis) lub atypowe (1). NTM są rozpowszechnione w środowisku, występują w glebie, w wodzie zarówno w zbiornikach naturalnych, jak również w wodzie wodociągowej i sztucznych zbiornikach wodnych (2, 3). Dzięki szczególnej budowie ściany komórkowej zawierającej kwasy mykolowe i woski, są oporne na działanie wysokiej temperatury i środków dezynfekcyjnych. Mycobacterium avium-intracelullare complex (MAC) przeżywa w temperaturze 55°C i jest oporna na stężenie chloru 500 razy większe niż potrzeba do zabicia Escherichia coli (3, 4). W literaturze do chwili obecnej opisano ponad 150 gatunków NTM, w większości przypadków mało patogennych dla człowieka, ale około 25 drobnoustrojów odpowiedzialnych jest za wywołanie choroby (5). Do zakażenia dochodzi w wyniku kontaktu z bakteriami w środowisku, na skutek inhalacji drobnoustroju wraz z wodą wodociągową na przykład podczas korzystania z prysznica (2, 3). Uważa się, że nie występuje zakażenie odzwierzęce ani między ludźmi, jednak opisane w ostatnich latach w literaturze epizody transmisji Mycobacterium abscessus subspecies massiliense między chorymi na mukowiscydozę wskazują na taką możliwość (6, 7). W przeciwieństwie do gruźlicy nie wykazano, aby bezobjawowe zakażenie NTM przeszło w utajoną postać choroby i obecnie nie ma dowodów, aby bezobjawowe zakażenie miało związek z reaktywacją choroby (2).
Epidemiologia
Mykobakteriozy nie należą do chorób zakaźnych, tym samym nie podlegają obowiązkowi rejestracji, dlatego dane epidemiologiczne dotyczące zapadalności i częstości ich występowania są szacunkowe. Z licznych publikacji wynika, że na całym świecie od dziesięcioleci obserwuje się tendencję wzrostową zachorowań na mykobakteriozy. Wpływ na to ma postęp w diagnostyce mikrobiologicznej, w tym rozwój badań molekularnych umożliwiających określenie gatunku prątków, upowszechnienie tomografii komputerowej wysokiej rozdzielczości (TKWR) wykrywającej zmiany w płucach niewidoczne na radiogramach klatki piersiowej. W krajach uprzemysłowionych wzrost zachorowań może mieć związek ze starzeniem się społeczeństwa (2, 5, 8, 9). Z badań przeprowadzonych w Oregonie w USA wynika, że zapadalność na mykobakteriozy w populacji ogólnej wynosiła 8,6/100 000, natomiast u osób powyżej 50. r.ż. wzrosła do 20,4/100 000 (10). Do grupy podwyższonego ryzyka zachorowania na mykobakteriozy należą pacjenci ze zmianami strukturalnymi w płucach w przebiegu przewlekłej obturacyjnej choroby płuc (POChP), rozstrzeni oskrzeli, mukowiscydozy, przebytej gruźlicy płuc, pylicy krzemowej, proteinozy pęcherzyków płucnych. Istotnie częściej chorują także osoby z uogólnionymi zaburzeniami odporności w przebiegu cukrzycy, niewydolności nerek, przewlekłej kortykoterapii, chorzy leczeni immunosupresyjne po przeszczepieniu narządów, zakażeni wirusem HIV oraz leczeni preparatami anty-TNF (infliksimab, adalimumab, etanercept) (9-13). Zapadalność na mykobakteriozy u chorych po przeszczepieniu narządów wynosi 4,9/100 000, a leczonych preparatami biologicznymi 10,7/100 000 (12). Częściej chorują także osoby z wrodzonym defektem wytwarzania IL-2 i IFN-gamma. Kolejną grupę ryzyka stanowią chorzy z deformacjami klatki piersiowe, takimi jak kifoskolioza, lejkowata klatka piersiowa współistniejąca z wypadaniem płatka zastawki dwudzielnej, nadmierna ruchomość w stawach. Do zachorowania predysponują także zaburzenia motoryki przełyku (achalazja przełyku, choroba refluksowa) (11, 12). Ostatnio wykazano także, że czynnikiem ryzyka zachorowania na mykobakteriozę mogą być zaburzenia przepływu krwi w płucach obserwowane w nadciśnieniu płucnym (14).
W Polsce pierwsze badania dotyczące zapadalności na mykobakteriozy przeprowadzono w latach 70. ubiegłego wieku. Analizując dane 700 tysięcy chorych zarejestrowanych w poradniach przeciwgruźliczych w województwach warszawskim, katowickim i mieście Łodzi określono częstość występowania mykobakteriozy na poziomie 1,4/100 000 w roku 1971, a trzy lata później, w roku 1974, wskaźnik ten wynosił 4,3/100 000 (15, 16).
Z badania przeprowadzonego w 2008 roku wynika, że częstość zakażeń poszczególnymi gatunkami NTM wykazuje wyraźne różnice geograficzne pomiędzy poszczególnymi rejonami świata, jak również znajdującymi się tam krajami. W większości rejonów najczęściej izolowano M. avium complex (MAC), kolejno M. gordonae, M. xenopi, M. fortuitum complex, M. abscessus oraz M. kansasii i stanowiły one 80% wszystkich zidentyfikowanych prątków atypowych. M. kansasii, które znalazło się na szóstym miejscu, najczęściej izolowano na Słowacji, w Polsce i w Wielkiej Brytanii, odpowiednio w 36, 35 i 11% przypadków (17).
Mykobakterie wywołują głównie choroby płuc, ale mogą także, zwłaszcza u dzieci, powodować zapalenie węzłów chłonnych (Mycobacterium haemophilum). U pracujących przy połowie ryb, chodzących na basen, płetwonurków może dochodzić do powstania zmian skórnych spowodowanych zakażeniem Mycobacterium marinum, a w wyniku urazów lub przeprowadzanych zabiegów chirurgicznych szybko rosnącymi gatunkami prątków: Mycobacterium fortuitum, M. abscessus czy M. chelonae. Postać uogólniona z zajęciem węzłów chłonnych, skóry, kości, stawów, tkanek miękkich występuje wyłącznie u chorych z ciężkimi zaburzeniami immunologicznymi w przebiegu nabytego zespołu niedoboru odporności (HIV/AIDS), nowotworów układu krwiotwórczego, pacjentów leczonych immunosupresyjnie po przeszczepieniu narządów oraz, w ostatnich latach, chorych otrzymujący leki biologiczne i wywołana jest najczęściej przez MAC, Mycobacterium xenopi i Mycobacterium abscessus (2, 4, 11). Ostatnio opisano także przypadki mykobakteriozy płuc u chorych na nadciśnienie płucne zakrzepowo-zatorowe i idiopatyczne tętnicze nadciśnienie płucne (14).
Obraz kliniczny mykobakteriozy płuc
Objawy kliniczne mykobakteriozy płuc są niecharakterystyczne. Większość pacjentów zgłasza ogólne osłabienie, męczliwość, przewlekły kaszel suchy lub z wykrztuszaniem ropnej plwociny, krwioplucie. Objawy ogólne – ubytek masy ciała, gorączka, nocne poty – są rzadziej obserwowane, stwierdza się je u około 30-50% chorych i świadczą o zaawansowaniu choroby (2, 13, 18, 19).
Obraz radiologiczny
Zmiany radiologiczne stwierdzane w badaniu TKWR są bardziej specyficzne i można je podzielić na cztery typy (2, 20, 21):
– z obecnością guzków i rozstrzeni oskrzeli (ryc. 1),
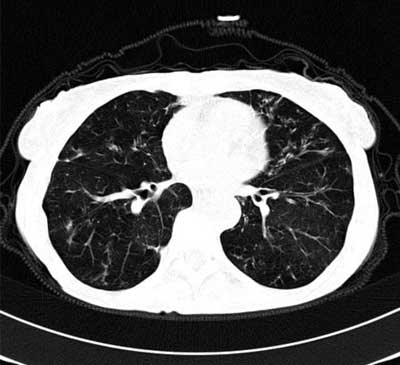
Ryc. 1. Mykobakterioza płuc wywołana przez Mycobacterium avium-intracellulare (postać rozstrzeniowo-guzkowa)
– włóknisto-jamiste ze zmianami w płatach górnych przypominającymi gruźlicę płuc (ryc. 2),
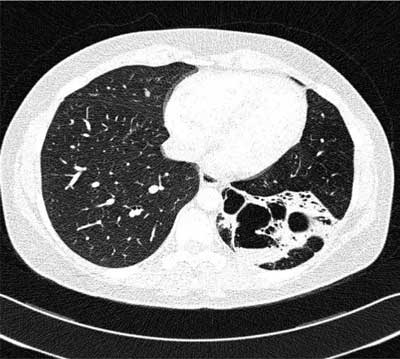
Ryc. 2. Mykobakterioza płuc wywołana przez Mycobacterium kansasii (postać włóknisto-jamista)
– przypominające alergiczne zapalenie pęcherzyków płucnych (AZPP) ze zmianami drobnoguzkowymi, drobnoplamistymi oraz obszarami matowej szyby,
– pojedynczy guzek nasuwający podejrzenie nowotworu.
Dzięki tomografii komputerowej wysokiej rozdzielczości możemy nie tylko stwierdzić obecność zmian w płucach niewidocznych na zdjęciu radiologicznym klatki piersiowej, ale także monitorować przebieg choroby i wyniki leczenia (22).
Postać guzkowa z rozstrzeniami oskrzeli najczęściej wywołana przez MAC została opisana w 1989 roku i nazwana zespołem Lady Windermere. Dotyczy kobiet, niepalących, po menopauzie, o smukłej budowie ciała, z defektami klatki piersiowej, często z występowaniem mutacji w genie CFTR (ang. cystic fibrosis transmembrane conductance regulator). Zmiany zlokalizowane są głównie w płacie środkowym i języczku. Przebieg choroby jest najczęściej powolny, pogarsza jakość życia, ale nie wpływa na jego długość. Biorąc pod uwagę konieczność przyjmowania przez długi okres czasu kilku leków przeciwprątkowych i toksyczność leczenia, trzeba rozważyć, czy i kiedy podjąć terapię oraz ocenić korzyści i ryzyko z nią związane (23, 24).
Postać włóknisto-jamista przypominająca gruźlicę najczęściej wywołana jest przez Mycobacterium kansasii, rzadziej MAC, M. xenopi, M. szulgai lub M. malmoense. Dominują w tej grupie mężczyźni w średnim wieku, palący papierosy, nadużywający alkoholu, u których stwierdzano już wcześniej przewlekłą chorobą płuc (POChP, pylicę, przebytą gruźlicą). Chorzy zwykle zgłaszają kaszel z wykrztuszaniem, duszność, krwioplucie, ogólne osłabienie, ubytek masy ciała, gorączkę, nocne poty. Z uwagi na wysokie ryzyko zgonu chorzy na tę postać mykobakteriozy wymagają leczenia (2, 25).
Choroba wywołana przez NTM może przypominać alergiczne zapalenie pęcherzyków płucnych (ang. hypersensitivity-like disease). Rozwija się u osób narażonych na inhalację antygenów prątków z aerozolu zanieczyszczonej wody w basenach, w wannach z hydromasażem, typu spa czy hot tub. Głównym czynnikiem etiologicznym w tych przypadkach jest Mycobacterium avium. Z kolei w przemyśle metalowym może dochodzić do wdychania aerozoli z płynu używanego podczas obróbki metali, gdzie głównym patogenem jest Mycobacterium immunogenum z grupy RGM. Prątki rosną w roztworach zawierających związki organiczne, takie jak parafiny, oleje drzewne i aromatyczne policykliczne wodorowęglany. Początek choroby jest zwykle podostry, występują: kaszel, duszność, gorączka, hipoksemia. W badaniu TKWR widoczne są zmiany drobnoguzkowe i drobnoplamiste, zacienienia o typie matowej szyby, mozaikowatość zmian. W badaniu histologicznym stwierdza się ziarniniaki, można także znaleźć mykobakterie w wycinkach pobranych podczas biopsji płuca. Leczenie polega przede wszystkim na przerwaniu ekspozycji na antygeny prątków. U chorych z niewydolnością oddechową należy zastosować prednizon w dawce 1-2 mg/kg/dobę w dawkach malejących w okresie 4-8 tygodni. Pacjenci z zaburzeniami odporności, z objawami choroby utrzymującymi się pomimo zaprzestania ekspozycji na antygen MAC (niezależnie od leczenia kortykosteroidami) lub z rozstrzeniami oskrzeli powinni otrzymywać leki przeciwprątkowe zgodnie z zaleceniami ATS, ale możliwe jest skrócenie okresu leczenia do 3-6 miesięcy (2, 3, 26).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Adjemian J, Olivier KN, Seitz AE et al.: Spatial clusters of nontuberculous mycobacterial lung disease in the United States. Am J Respir Crit Care Med 2012; 186: 553-558.
2. Griffith DE, Aksamit T, Brown-Elliott BA et al.: An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous Mycobacterial diseases. Am J Respir Crit Care Med 2007; 175: 367-416.
3. Falkinham JO III: Mycobacterial aerosols and respiratory disease. Emerg Infect Dis 2003; 9: 763-767.
4. Falkinham JO III: Ecology of nontuberculous mycobacteria – where do human infections come from? Semin Respir Crit Care Med 2013; 34: 95-102.
5. van Ingen J: Diagnosis of nontuberculous mycobacterial infections. Semin Respir Crit Care Med 2013; 34: 103-109.
6. Aitken ML, Limaye A, Pottinger P et al.: Respiratory outbreak of Mycobacterium abscessus subspecies massiliense in a lung transplant and cystic fibrosis center. Am J Respir Crit Care Med 2012; 185(2): 231-232.
7. Bryant JM, Grogono DM, Greaves D et al.: Whole-genome sequencing to identify transmission of Mycobacterium abscessus between patients with cystic fibrosis: a retrospective cohort study. Lancet 2013; 381: 1551-1560.
8. Kendall BA, Winthrop KL: Update on the epidemiology of pulmonary nontuberculous mycobacterial infections. Semin Respir Crit Care Med 2013; 34: 87-94.
9. Cassidy PM, Hedberg K, Saulson A et al.: Nontuberculous mycobacterial disease prevalence and risk factors: a changing epidemiology. CID 2009; 49: 124-129.
10. Winthrop KL, McNelley E, Kenddall B et al.: Pulmonary nontuberculous mycobacterial disease prevalence and clinical features: an emerging public health disease. Am J Respir Crit Care Med 2010; 182: 977-982.
11. Chan ED, Iseman MD: Underlying host risk factors for nontuberculous mycobacterial lung disease. Semin Respir Crit Care Med 2013; 34: 110-123.
12. Sexton P, Harrison AC: Susceptibility to nontuberculous mycobacterial lung disease. Eur Respir J 2008; 31: 1322-1333.
13. Wyrostkiewicz D, Skorupa W, Jakubowska L et al.: Mikobakterioza u chorych na mukowiscydozę – opis trzech przypadków. Pneumonol Alergol Pol 2014; 82: 561-567.
14. Wilińska E, Oniszh K, Augustynowicz-Kopeć E et al.: Mikobakterioza płuc u chorych na nadciśnienie płucne zakrzepowo-zatorowe i idiopatyczne tętnicze nadciśnienie płucne. Pneumonol Alergol Pol 2014; 82: 495-502.
15. Janowiec M, Mleczko H, Krychniak W et al.: Występowanie mykobakterioz atypowych w dobranych ośrodkach badawczych w latach 1971-1974. Analiza danych środowiskowych i klinicznych. Pneumonol Pol 1977; 45: 353-361.
16. Żbikowski H: Występowanie prątków atypowych u chorych z gruźlicą płuc na wybranych terenach w kraju w latach 1971-1974. Pneumonol Pol 1980; 48: 357-366.
17. Hoefsloot W, van Ingen J, Andrejak C et al.: The geographic diversity of nontuberculous mycobacteria isolated from pulmonary samples. Eur Respir J 2013; 42: 1604-1613.
18. van Ingen J, Bendien SA, de Lange WCM et al.: Clinical relevance of non-tuberculous mycobacteria isolated in the Nijmegen-Arnhem region, The Netherlands. Thorax 2009; 64: 502-506.
19. Gommans EPAT, Even P, Linssen CFM et al.: Risk factors for mortality in patients with pulmonary infections with non-tuberculous mycobacteria: a retrospective cohort study. Respir Med 2015; 109: 137-145.
20. Erasmus JJ, McAdams HP, Farrell MA et al.: Pulmonary nontuberculous mycobacterial infection: radiologic manifestation. Radiographics 1999; 19: 1487-1505.
21. Yonemori K, Tateishi U, Tsuta K et al.: Soliter pulmonary granuloma coused by Mycobacterium avium-intracellulare complex. Int J Tuberc Lung Dis 2007; 11: 215-221.
22. Lee G, Kim HS, Moon JW et al.: Serial CT findings of nodular bronchiectatic Mycobacterium avium complex pulmonary disease with antibiotic treatment. Am J Roentgenol 2013; 201: 764-772.
23. Reich JM, Johnson RE: Mycobacterium avium complex pulmonary disease presenting as an isolated lingular or middle lobe pattern. The Lady Windermere syndrome. Chest 1992; 101: 1825-1830.
24. Kitada S, Uenami T, Yoshimura K et al.: Long-term radiograhic outcome of nodular bronchiectatic Mycobacterium avium complex pulmonary disease. Int J Tuberc Lung Dis 2012; 16: 660-664.
25. Aksamit TR: Mycobacterium avium complex pulmonary disease in patients with pre-existing lung disease. Clin Chest Med 2002; 23: 643-653.
26. Embil J, Warren P, Yakrus M et al.: Pulmonary illness associated with exposure to Mycobacterium avium complex in hot tub water: hypersensitivity pneumonitis or infection? Chest 1997; 111: 813-816.
27. Hoefsloot W, van Ingen J, de Lange et al.: Clinical relevance of Mycobacterium malmoense isolation in The Netherland. Eur Respir J 2009; 34(4): 926-931.
28. Koh WJ, Kwon OJ, Jeon K et al.: Clinical significance of nontuberculous mycobacteria isolated from respiratory specimens in Korea. Chest 2006; 129: 341-348.
29. Korzeniewska-Koseła M: Mykobakteriozy: występowanie, postaci, rozpoznawanie i leczenie. http://www.mp.pl/pulmonologia/artykuly-wytyczne/pogladowe/show.html?id=116396.
30. Daley CL, Griffith DE: Pulmonary nontuberculosis mycobacterial infections. Int J Tuberc Lung Dis 2010; 14: 665-671.
31. van Ingen J, Boeree MJ, van Soolingen D et al.: Resistance mechannisms and drug susceptibility testing of nontuberculous mycobacteria. Drug Resist Update 2012; 15: 283-295.
32. Griffith DE, Aksamit TR: Therapy of refractory nontuberculous mycobacterial lung disease. Curr Opin Infect Dis 2012; 25: 218-227.
33. Jeong BH, Jeon K, Park HY et al.: Intermittent antibiotic therapy for nodular bronchiectatic Mycobacterial avium complex lung disease. Am J Respir Crit Care Med 2015; 191: 96-103.
34. Wallace RJ, Brown-Elliott BA, McNulty S et al.: Macrolide/azalide therapy for nodular/bronchiectatic Mycobacterium avium complex lung disease. Chest 2014; 146(2): 276-282.
35. Griffith DE, Brown-Elliott BA, Langsjoen B et al.: Clinical and molecular analysis of macrolide resistance in Mycobacterium avium complex lung disease. Am J Respir Crit Care Med 2006; 174: 354-360.
36. Davis KK, Kao PN, Jacobs SS et al.: Aerosolized amikacin for treatment of pulmonary Mycobacterium avium infections: an observational case series. BMC Pulm Med 2007; 7: 2.
37. Philley JV, Griffith DE: Management of nontuberculous mycobacterial (NTM) lung disease. Semin Respir Crit Care Med 2013; 34: 135-142.
38. Lyu J, Jang HJ, Song JW et al.: Outcomes in patients with Mycobacterium abscessus pulmonary disease treated with long-term injectable drugs. Respir Med 2011; 105: 781-787.
39. Cowman S, Loebinger M: Nontuberculous mycobacterial pulmonary disease. Clin Pulm Med 2015; 22: 8-14.
40. Jarand J, Levin A, Zhang L et al.: Clinical and microbiologic outcomes in patients receiving treatment for Mycobacterium abscessus pulmonary disease. CID 2011; 52: 565-571.


