© Borgis - Postępy Nauk Medycznych 1/2016, s. 11-15
*Dorota Wyrostkiewicz1, Monika Szturmowicz1, Izabela Siemion-Szcześniak1, Lilia Jakubowska2, Anna Zabost3, Jan Kuś1
Mikobakterioza płuc u chorej na przewlekłą obturacyjną chorobę płuc i rozstrzenie oskrzeli – opis przypadku
Nontuberculous mycobacterial lung disease in the patient with chronic obstructive pulmonary disease and bronchiectasis – case report
1I Department of Lung Diseases, National Tuberculosis and Lung Diseases Research Institute, Warszawa
Head of Department: prof. Jan Kuś, MD, PhD
2Department of Radiology, National Tuberculosis and Lung Diseases Research Institute, Warszawa
Head of Department: Iwona Bestry, MD
3Department of Microbiology, National Tuberculosis and Lung Diseases Research Institute, Warszawa
Head of Department: prof. Ewa Augustynowicz-Kopeć, MD, PhD
Streszczenie
Mikobakteriozy to choroby wywoływane przez prątki niegruźlicze (ang. nontuberculous mycobacteria – NTM), zwane również prątkami atypowymi. Prątki niegruźlicze występują dość powszechnie w środowisku, przede wszystkim w glebie i w wodzie. Do zakażenia układu oddechowego dochodzi przeważnie na skutek inhalacji aerozoli wodnych zawierających mikobakterie. Grupami ryzyka zachorowania na mikobakteriozy są chorzy na przewlekłe choroby płuc (takie jak: mukowiscydoza, przewlekła obturacyjna choroba płuc, przebyta gruźlica, rozstrzenie oskrzeli, pylica krzemowa, proteinoza pęcherzykowa) oraz pacjenci z obniżoną odpornością. Badania epidemiologiczne wskazują, że większość zakażeń prątkami niegruźliczymi u chorych na przewlekłe choroby płuc jest wywołanych przez szczepy: Mycobacterium avium complex, Mycobacterium kansasii i Mycobacterium abscessus. Obecność NTM w plwocinie pacjentów z przewlekłymi chorobami płuc może wskazywać na przejściowe zanieczyszczenie, kolonizację lub zakażenie. Różnicowanie tych stanów jest niekiedy bardzo trudne, dlatego istotne jest, aby rozpoznanie mikobakteriozy spełniało kryteria ATS/IDSA. W pracy opisujemy problemy diagnostyczne i terapeutyczne związane z rozwojem mikobakteriozy wywołanej przez Mycobacterium avium u chorej na przewlekłą obturacyjną chorobę płuc i rozstrzenie oskrzeli.
Summary
Mycobacterial lung disease is caused by nontuberculous mycobacteria (NTM), also known as atypical mycobacteria. NTM are widely distributed in the environment, particularly in soil and water. The NTM lung disease develops mostly due to inhalation of pathogens included in water aerosols.
The risk groups of NTM disease are patients with chronic lung diseases (such as cystic fibrosis, COPD, previous tuberculosis, bronchiectasis, silicosis, pulmonary alveolar proteinosis) or those with immunodeficiency. The most common species of NTM isolated in patients with chronic lung diseases are Mycobacterium avium complex (MAC), Mycobacterium kansasii and Mycobacterium abscessus.
In some patients the disease caused by NTM develops, in others – NTM are cultured intermittently from respiratory specimens without a significant lung disease. The differentiation between these conditions is often problematic, thus it is important to follow the recognition guidelines of ATS/IDSA. In this paper, we present mycobacterial lung disease caused by Mycobacterium avium in a patient with COPD (chronic obstructive pulmonary disease) and bronchiectasis.

Introduction
Mycobacterial lung disease is caused by nontuberculous mycobacteria (NTM), known also as atypical mycobacteria or mycobacteria other than tuberculosis (MOTT). NTM are widely distributed in the environment, they are present in soil, and in water, both from natural and artificial water reservoirs.
NTM are human saprophytes, colonizing the respiratory, alimentary and urinary tracts (1-3). The risk groups for NTMLD are among others (4-6):
– patients with chronic lung diseases such as chronic obstructive pulmonary disease, cystic fibrosis, silicosis, pulmonary alveolar proteinosis, bronchiectasis and patients with postuberculotic lesions in the lungs,
– immunocompromized patients (e.g. in the course of HIV infection, neoplastic disease) and those receiving immunosuppresive treatment due to solid organ or bone marrow transplantation, or due to autoimmunological disorders.
The higher prevalence of Mycobacterium avium complex (MAC) disease in non-smoking, postmenopausal, slim women was described as Lady Windermere’s disease (3).
The infection with NTM is caused by the inhalation of aerosols with water droplets contaminated with mycobacteria or by the skin contact. The data concerning the transmition of NTMLD between humans are scarse and concern M. abscessus transmition between the patients with cystic fibrosis (7).
Chronic obstructive pulmonary disease (COPD) is the common, chronic lung disease, characterized by the progressive decrease of peripheral airflow, due to inflammatory process taking place in the lungs, caused by toxic smokes and/or dusts. In Poland most cases of COPD are caused by cigarettes smoking. COPD course is influenced in the individual patient by the episodes of disease exacerbation and by the coexisting pathology (8).
Chronic inflammation of the bronchial tract, leads to functional and structural changes in the lungs of COPD patients. One of such complications is the development of bronchiectasis. Both COPD and bronchiectasis are the risk factors of NTMLD (9, 10).
In the present report, we present NTMLD in the patient with COPD and bronchiectasis and discuss the problems concerning NTMLD diagnosing and treatment in such population.
Case report
63-years old female, diagnosed with COPD and bronchiectasis, was admitted in February 2011 to the Ist Department of Lung Diseases, National Tuberculosis and Lung Diseases Research Institute in Warsaw, due to productive cough, low grade fever and dyspnea on exertion. First symptoms appeared 5 months before hospitalization, and they gradually increased. One week before the admittion to the hospital the patient noticed hemoptysis. As an outpatient she received several antibiotics with clinical improvement, nevertheless the symptoms of disease reappeared after the therapy was stopped. The sputum culture revealed the presence of Pseudomonas aeruginosa and Hemofilus influenzae. In June 2010 M. avium was cultured from sputum for the first time.
Upon admittion, the patient was in good performance status, body temperature was within normal limits, resting haemoglobin oxygen saturation was 94%, systemic blood pressure – 130/80, heart rate – 97 bpm. On auscultation, bilateral wheezing and rrhonchi were found. ESR was 50 mm/2 hours, WBC – 7.16 x 103 (N: 4.23-9.07 x 103), polymorphonuclears – 73% (N: 40-68%), Hgb – 12.6 g/dl (N: 12-16 g/dl), T – 293 x 103 (N: 130-400 x 103). CRP was 31 mg/dl (N < 5 mg/dl), GGTP – 133 U/l (N: 8-78 U/l), GPT-86 U/l (N: 9-52 U/l), D-Dimer – 1057 mcg/l (N: < 494 mcg/l). PaO2 was 62 mmHg, PaCO2 – 37 mmHg, pH – 7.45.
Chest X-ray examination revealed bilateral peribronchial opacities in the lower parts of the lungs (fig. 1).
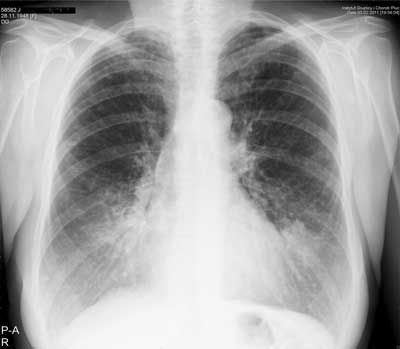
Fig. 1. Posteroanterior chest X-ray (03.02.2011). Tubular opacities in the lower zones represent dilated bronchi filled with impacted mucus, most evident on the left side
High resolution chest computed tomography of the lungs (HRCT) revealed the presence of multiple bronchiectasis, localized mostly in the middle lobe and lingula. The bronchial walls were thickened, with the signs of multiple mucous plugs. Ill defined centrilobular nodules were found in both lower lobes (fig. 2).
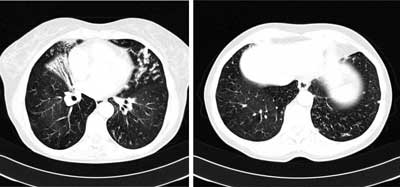
Fig. 2. High-resolution computed tomography of the lungs (05.02.2011). Partial loss of volume in middle lobe with bronchiectasis. Multiple mucous plugs in small lingular bronchi. Ill-defined centrilobular nodules are visible in both lower lobes
Fibreoptic bronchoscopy disclosed large amounts of purulent secretions. Antracotic incrustations and posttuberculotic changes. The deformations of the small bronchi were also described. The culture of sputum and bronchial washings revealed no bacterial and no fungal pathogens. Bacterioscopy was negative for acid-fast bacilli, genetic probe for M. tuberculosis complex was negative. Tuberculin skin test (TST) and interferon gamma releasing assay (IGRA) (Quantiferon-TB Gold) were also negative. NTM were cultured from both sputum and bronchial washings on the fifth week of observation, MAC strain was identified by high pressure liquid chromatography (HPLC).
Based on clinical, radiological and microbiological criteria, NTMLD was recognized.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Griffith DE, Aksamit T, Brown-Elliott BA et al.: An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous Mycobacterial diseases. Am J Respir Crit Care Med 2007; 175: 376-416.
2. Choroby wywoływane przez prątki niegruźlicze – rozpoznanie, leczenie i zapobieganie. Stanowisko American Thoracic Society i Infectious Diseases Society of America. Med Prakt 2008/09.
3. Wilińska E, Szturmowicz M: Mikobakteriozy płuc – obraz kliniczny, diagnostyka i leczenie. Pneumonol Alergol Pol 2010; 78: 138-147.
4. Hughes W: Mycobacterial infections in bone marrow transplant recipients. Biol Blood Marrow Transplant 2000; 6: 359-360.
5. Wallace RJ, Zhang Y, Brown BA et al.: Polyclonal Mycobacterium avium complex infection in patients with nodular bronchiectasis. Am J Respir Crit Care Med 1998; 158: 1235-1244.
6. Kubo K, Yamazaki Y, Hachiya T et al.: Mycobacterium avium-intracellulare pulmonary infection in patients without known predisposing lung disease. Lung 1998; 176: 381-391.
7. Rowińska-Zakrzewska E: Mikobakterioza płuc. Rzadka choroba czy narastający problem epidemiologiczny? Pneumonol Alergol Pol 2014; 82: 486-488.
8. Śliwiński P, Górecka D, Jassem E, Pierzchała W: Zalecenia Polskiego Towarzystwa Chorób Płuc dotyczące rozpoznawania i leczenia przewlekłej obturacyjnej choroby płuc. Pneumonol Alergol Pol 2014; 82: 227-263.
9. Andrejak C, Nielsen R, Thomsen VO et al.: Chronic respiratory disease, inhaled corticosteroids and risk of nontuberculous mycobacteriosis. Thorax 2013; 68: 256-262.
10. Andrejak C, Thomsen VO, Johansen IS et al.: Nontuberculous pulmonary mycobacteriosis in Denmark. Am J Respir Crit Care Med 2010; 181: 514-521.
11. Hojo M, Iikura M, Hirano S et al.: Increased risk of nontuberculous mycobacterial infection in asthmatic patients using long-term inhaled corticosteroid therapy. Respirology 2012; 17: 185-190.
12. Van Ingen J, Griffith DE, Aksamit TR, Wagner D: Pulmonary diseases caused by nontuberculous mycobacteria. Eur Respir Monogr Tuberculosis 2012; 58: 25-37.
13. Van Ingen J: Diagnosis of nontuberculous mycobacterial infections. Semin Respir Crit Care Med 2013; 34: 103-109.
14. Chu H, Zhao L, Xiao H et al.: Prevalence of nontuberculous mycobacteria in patients with bronchiectasis: a meta-analysis. Arch Med Sci 2014; 10: 661-668.
15. Dautzenberg B, Piperno D, Diot P et al.: Clarithromycin Study Group of France. Clarithromycin in the treatment of Mycobacterium avium lung infections in patients without AIDS. Chest 1995; 107: 1035-1040.
16. Griffith DE, Brown BA, Girard WM et al.: Azithromycin-containing regimens for treatment of Mycobacterium avium complex lung disease. Clin Infect Dis 2001; 32: 1547-1553.
17. Davis KK, Kao PN, Jacobs SS et al.: Aerosolized amikacin for treatment of pulmonary Mycobacterium avium infections: an observational case series. BMC Pulm Med 2007; 7: 1-6.
18. Glassroth J: Pulmonary disease due to nontuberculous mycobacteria. Chest 2008; 133: 243-251.


