*Bogdan Kędzia, Elżbieta Hołderna-Kędzia
Pinocembryna – flawonoidowy składnik krajowego propolisu o działaniu opóźniającym rozwój choroby Alzheimera
Pinocembrin – flavonoid component of domestic propolis with delaying effect of the development of Alzheimer’s disease
Instytut Włókien Naturalnych i Roślin Zielarskich w Poznaniu
Dyrektor Naukowy Instytutu: prof. dr n. techn. Ryszard Kozłowski
Streszczenie
Do leków najczęściej stosowanych w opóźnianiu rozwoju choroby Alzheimera należą inhibitory esterazy acetylocholinowej, a także antagoniści kwasu glutaminowego. Leki te, mimo korzystnych właściwości terapeutycznych, obarczone są jednak w dużym stopniu działaniami niepożądanymi, co ogranicza ich dłuższe stosowanie lub wręcz zmusza chorych do rezygnacji z terapii. Stąd poszukiwania innych preparatów skutecznych w leczeniu choroby Alzheimera, niewykazujących efektów ubocznych. Na podstawie przedstawionych badań można stwierdzić, że pinocembryna odznacza się działaniem ograniczającym gromadzenie się w tkance mózgowej amyloidu β, działaniem zmniejszającym przepuszczalność bariery krew-mózg, opóźnianiem apoptozy neuronów, działaniem przeciwutleniającym, a także wyraźnie zaznaczonym działaniem poprawiającym orientację przestrzenną i funkcje poznawcze. W tym kontekście omawiana substancja stwarza potencjalne możliwości zastosowania jej w zapobieganiu i leczeniu choroby Alzheimera. Ze względu na to, że krajowy propolis jest bogatym źródłem pinocembryny, może on stanowić dogodną formę dla wykorzystania tej substancji do celów leczniczych.
Summary
The most commonly used drugs for delaying the development of Alzheimer’s disease include acetylcholine esterase inhibitors and glutamic acid antagonists. These drugs, despite their beneficial therapeutic properties, are burdened to a large extent with undesirable effects, limiting their longer-term use or provoking patients to give up therapy. Hence the search for other formulations effective in treating Alzheimer’s disease, with no side effects not showing side effects.
Based on the studies presented, it is possible to assume, that pinocembrin has been shown to inhibit the accumulation of amyloid β in brain tissue, blood-brain barrier permeability reduction activity, retarded apoptosis, antioxidant activity, as well as a clearly marked improvement of spatial orientation and cognitive functions.
In this context, pinocembrin offers potential opportunities for its use in the prevention and treatment of Alzheimer’s disease. Due to the fact that domestic Polish propolis is a rich source of pinocembrine, it can be a convenient source for the use of this substance for therapeutic purposes.

Wstęp
Choroba Alzheimera jest postępującą chorobą neurodegeneracyjną, charakteryzującą się występowaniem płytek starczych, splotów neurowłókienkowych oraz ubytkiem neuronów w strukturach mózgu. Płytki starcze stanowią złogi zewnątrzneuronowe amyloidu β (Aβ), a szczególnie peptydu tego amyloidu o sekwencji β40-43, natomiast sploty neurowłókienkowe zlokalizowane są wewnątrz neuronów i stanowią kompleks hiperfosforylowanego białka tau. Zmiany chorobowe występują głównie w rejonie kory mózgowej i hipokampa i upośledzają procesy poznawcze, takie jak: pamięć, zdolność abstrakcyjnego myślenia, orientacja przestrzenna, a także funkcjonalne, a mianowicie mowę i umiejętności ruchowe. Prowadzą one stopniowo do otępienia, zobojętnienia na czynniki zewnętrzne, znieruchomienia i zaburzeń funkcji fizjologicznych (1, 2).
Do leków najczęściej stosowanych w opóźnianiu rozwoju choroby Alzheimera należą inhibitory esterazy acetylocholinowej (donepezil, rywastygmina, galantamina), a także antagoniści kwasu glutaminowego (memantyna). Leki te, mimo korzystnych właściwości terapeutycznych, obarczone są jednak w dużym stopniu działaniami niepożądanymi, co ogranicza ich dłuższe stosowanie lub wręcz zmusza chorych do rezygnacji z terapii (2).
Stąd poszukiwania innych preparatów skutecznych w leczeniu choroby Alzheimera, niewykazujących efektów ubocznych. W tym celu prowadzone są próby stosowania izolowanych substancji roślinnych (kwas γ-liponowy, hupercyna A, kwas rozmarynowy), ekstraktów roślinnych (Bacopa monnieri, Withania somnifera, Ginkgo biloba, Panax ginseng), izolowanych substancji zwierzęcych (acetylo-L-karnityna, fosfatydyloseryna, kwas dokozaheksaenowy), produktów spożywczych (olej kokosowy), witamin (witaminy z grupy B, witaminy D i E) oraz produktów pszczelich (mleczko pszczele, pyłek kwiatowy, propolis) (3-8).
Bardzo obiecujące są badania neurobiologiczne nad flawonoidowym składnikiem propolisu, a mianowicie nad pinocembryną (9, 10), dlatego wydawało się celowe bliższe omówienie tego związku, jako możliwego do wykorzystania w praktyce w leczeniu choroby Alzheimera.
Pinocembryna jako składnik propolisu
Propolis pozyskiwany przez pszczelarzy jest mieszaniną żywiczno-balsamicznych substancji, z domieszką innych produktów pszczelich (wosk, obnóże pszczele, pierzga) oraz zanieczyszczeń mechanicznych. Przyjmuje się, że surowy propolis zawiera ok. 60% substancji biologicznie aktywnych i ok. 40% substancji balastowych. W celu ich usunięcia, surowy propolis poddaje się zazwyczaj ekstrakcji za pomocą 70% etanolu (w stosunku 1:10). Po odparowaniu alkoholu uzyskuje się półpłynną pozostałość o zawartości ok. 67% suchej masy. Uzyskany w ten sposób zagęszczony etanolowy ekstrakt z propolisu (EEP) służy do sporządzania stałych form preparatów leczniczych (11).
W skład EEP, otrzymanego z surowego propolisu krajowego, zbieranego przez pszczoły głównie z pączków liściowych topoli czarnej, w największej ilości wchodzą związki flawonoidowe (ok. 45%). Dużą grupę związków stanowią także kwasy fenolowe (ok. 30%) i ich estry (ok. 10%) (12).
Badania Kalety (13) wykazały, że w 10% ekstraktach etanolowych z propolisu, pochodzącego z różnych rejonów kraju (badania obejmowały 15 próbek propolisu), zawartość związków flawonoidowych wahała się w zakresie od 6,2 do 18,8%. Wśród flawonoidów w największej ilości znajdowała się pinocembryna (śr. 4,7%). W mniejszych ilościach wykrywano pinobanksynę (śr. 3,1%), galanginę (śr. 2,2%) i chryzynę (śr. 2,1%).
Na tej podstawie można przyjąć, że propolis krajowy jest bogatym źródłem pinocembryny – związku należącego do grupy flawanonów (ryc. 1).
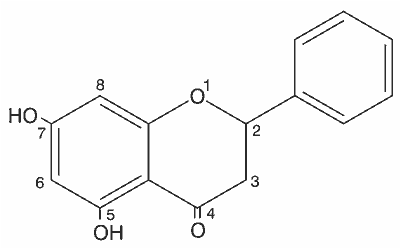
Ryc. 1. Struktura chemiczna pinocembryny (5,7-dihydro-ksyflawanonu)
Jeśli założyć, że wydajność ekstrakcyjna propolisu wynosi średnio 22% (14), to w zagęszczonym ekstrakcie etanolowym z propolisu (EEP) znajduje się od 8,4 do 31,0% pinocembryny (13).
Jest to stwierdzenie bardzo istotne, ponieważ propolis pochodzący z innych krajów świata może zawierać tylko śladowe ilości pinocembryny (propolis brazylijski) lub może wcale nie zawierać tego flawonoidu (propolis pochodzący z Wysp Kanaryjskich) (12).
Charakterystyka neurobiologiczna choroby Alzheimera
Istnieją co najmniej dwie teorie próbujące wyjaśnić powstawanie choroby Alzheimera. Jedna z nich zakłada gromadzenie się w tkance mózgowej amyloidu β (Aβ), co daje początek całej kaskadzie zmian prowadzących do rozwoju tej choroby (1, 2, 15). W myśl drugiej teorii początkiem choroby Alzheimera jest udar mózgu. Powstające w związku z tym zaburzenia przepuszczalności krew-mózg stanowią podstawę do gromadzenia się amyloidu β w strukturach mózgowych (9).
Pierwsza z wymienionych hipotez neurobiologicznych choroby Alzheimera zakłada, że w starzejącym się organizmie ludzkim dochodzi do stopniowego zwyrodnienia i obumierania neuronów mózgowych w następstwie zmian strukturalnych niektórych białek oraz uszkodzenia szlaków przekazywania sygnałów (1, 2). W strukturach mózgu, szczególnie kory mózgowej i hipokampa, zaczynają pojawiać się różnorodne formy patologiczne, m.in. zbudowane z amyloidu β blaszki starcze (przestrzenie pozaneuronowe) oraz sploty neurowłókienkowe złożone z nadmiernie ufosforylowanego białka tau (twory wewnątrzneuronowe). Powodują one stan zapalny komórek nerwowych. Dochodzi do zaburzeń poziomu wapnia, uwolnienia cytochromu C, gromadzenia chromatyny, uszkodzenia jąder komórkowych i fragmentacji DNA, a to w konsekwencji prowadzi do śmierci neuronów (15).
Ponadto stwierdzono, że przewlekły stan zapalny tkanki mózgowej powoduje aktywację komórek mikrogleju i astrocytów. W wyniku tego procesu następuje uwalnianie mediatorów zapalnych, takich jak cytokiny (TNF-α, IL-1β, IL-6), wolne rodniki tlenowe (ROS) i tlenek azotu (NO). Następstwem tych zmian jest zaburzenie ciągłości bariery krew-mózg, co umożliwia napływ komórek obwodowego układu odpornościowego (limfocyty) i powoduje dalsze pogłębianie się stanu zapalnego (1, 2).
Warto dodać, że peptydy amyloidu β mają zdolność wiązania się z różnymi receptorami zlokalizowanymi na komórce nerwowej. Jednym z najważniejszych jest receptor dla produktów zaawansowanej glikacji (ang. receptor for advanced glycation end products – RAGE). Liu i wsp. (15) wykazali, że pinocembryna blokuje receptor RAGE i uniemożliwia wiązanie się amyloidu β ze strukturami mózgowymi. A zatem jest to jedno z możliwych rozwiązań dotyczących zapobiegania odkładaniu się amyloidu β w tkance nerwowej w postaci blaszek starczych i usuwania go wraz z prądem krwi poza struktury mózgowe (15).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Zabłocka A. Choroba Alzheimera jako przykład schorzenia neurodegeneracyjnego. Post Hig Med Dośw 2006; 60:209-16.
2. Kubis AM, Janusz M. Choroba Alzheimera – nowe możliwości terapeutyczne oraz stosowane modele eksperymentalne. Post Hig Med Dośw 2008; 62:372-92.
3. Perlmutter D, Colman C. Księga zdrowia mózgu. Vital, Białystok 2014.
4. Aguiar S, Borowski T. Neuropharmacological review of the nootropic herb Bacopa monnieri. Rejuven Res 2013; 16(4):313-26.
5. Durg S, Dhadde SB, Vandal R i wsp. Withania somnifera (Ashwagandha) in neurobehavioural disorders induces by brain oxidative stress in rodents: a systematic review and metaanalysis. J Pharm Pharmacol 2015; 67(7):879-99.
6. Fernando WM, Martius IJ, Gozee CS i wsp. The role of dietary coconut for the prevention and treatment of Alzheimer’s disease: potential mechanisms of action. Br J Nutr 2015; 114(1):1-14.
7. Kędzia B, Hołderna-Kędzia E. Mleczko pszczele. Pozyskiwanie, skład chemiczny, właściwości biologiczne, działanie lecznicze. Humana Divinis, Toruń 2013.
8. Chen J, Long Y, Han M i wsp. Water-soluble derivative of propolis mitigates scopolamine-induced learning and memory impairment in mice. Pharm Biochem Behav 2008; 90:441-6.
9. Liu R, Li J-Z, Song J-K i wsp. Pinocembrin improves cognition and protects the neurovascular unit in Alzheimer related deficits. Neurobiol Aging 2014; 35:1275-85.
10. Saad MA, Salam RMA, Kenawy SA i wsp. Pinocembrin attenuates hippocampal inflammation, oxidative perturbations and apoptosis in a rat model of global cerebral ischemia reperfusion. Pharm Rep 2015; 67:115-22.
11. Kędzia B, Hołderna-Kędzia E. Powstawanie, pozyskiwanie i skład chemiczny propolisu. Pasieka 2016; (4):54-7.
12. Kędzia B. Skład chemiczny i aktywność biologiczna propolisu pochodzącego z różnych rejonów świata. Post Fitoter 2006; (1):23-35.
13. Kaleta J. Analiza fizykochemiczna propolisu i możliwość jego standaryzacji. Praca doktorska. Uniw Jagiel Coll Med, Kraków 2007.
14. Tichonov AI, Jarnych WP, Zypaniec IA i wsp. Teoria i praktyka wytwarzania leczniczych preparatów propolisowych. Apipol-Farma, Kraków 2006.
15. Liu R, Wu C-X, Zhow D i wsp. Pinocembrin protects against β-amyloid induced toxicity in neurons through inhibiting receptor for advanced glycation end products (RAGE) – independent signaling pathways and regulating mitochondrion – mediated apoptosis. BMC Med 2012; 10:105-25.
16. Jin X, Liu Q, Jia L i wsp. Pinocembrin attenuates 6-OHDA – induced neuronal cell death through Nrf2/ARE pathway in SH-SY5Y cells. Cell Mol Neurobiol 2015; 35:323-33.
17. Wang Y, Miao Y, Mir AZ i wsp. Inhibition of beta-amyloid – induced neurotoxicity by pinocembrin through Nrf2/HO-1 pathway in SH-SY5Y cells. J Neurol Sci 2016; 368:223-30.

