Tomasz Dangel
Leczenie bólu u dzieci. Mity i rzeczywistość
*Pain menagement in children. Miths and reality
z Warszawskiego Hospicjum dla Dzieci, Zakład Opieki Paliatywnej Instytutu Matki i Dziecka
Kierownik: lek. med. Artur Januszaniec

Wstęp
Problem bólu dzieci – pomimo szybkiego rozwoju takich dziedzin jak chirurgia, anestezjologia, intensywna terapia i onkologia dziecięca, a także wielu innych działów pediatrii – był i niestety jest ignorowany przez większość przedstawicieli tych dyscyplin. Polscy autorzy, Pawłowska-Wójcik i Rawicz w artykule (1) opublikowanym w 1989 roku, zauważają: zaskakującym jest bardzo niewielkie, wręcz znikome, zainteresowanie problemem leczenie bólu u dzieci. Przykładem dobrze ilustrującym tę tezę jest aktualny podręcznik pediatrii (2), który całkowicie pomija problem bólu u dzieci.
Badania ankietowe przeprowadzone w 1991 roku przez Tędziagolską i Ziółkowskiego (3) oraz w 1996 roku przez Dangla (4) wykazały, że:
– u najmłodszych dzieci (noworodki) ból leczony jest mniej skutecznie niż u dzieci starszych,
– najczęściej stosowaną metodą leczenia bólu pooperacyjnego u dzieci pozostają nadal domięśniowe wstrzyknięcia petydyny,
– większość anestezjologów nie stosuje metod znieczulenia przewodowego u dzieci,
– w większości przypadków pielęgniarka nie może samodzielnie decydować o podaniu kolejnej dawki leku przeciwbólowego u dziecka po zabiegu operacyjnym,
– prawdopodobnie w znacznym odsetku ośrodków pediatrycznych leczenie bólu u dzieci nie jest prowadzone właściwie, wskazuje na to opinia badanych lekarzy i
pielęgniarek: w przypadku bólu pooperacyjnego (37% respondentów), bólu nowotworowego (43% respondentów) i bólu jatrogennego (47% respondentów),
– główne przyczyny złej sytuacji w leczeniu bólu nowotworowego i jatrogennego u dzieci są następujące: brak wiedzy, brak standardów postępowania, negatywna postawa personelu, zła organizacja, brak środków finansowych, brak środków i sprzętu medycznego, lęk przed stosowaniem morfiny,
– morfina w leczeniu bólu nowotworowego stosowana jest w większości ośrodków onkologii i hematologii dziecięcej (87% respondentów); niestety równocześnie większość ośrodków (62% respondentów) nadal stosuje petydynę w leczeniu bólu nowotworowego,
– większość ośrodków hematologii i onkologii dziecięcej nie stosuje skutecznych metod zabezpieczenia przed bólem jatrogennym.
Opracowanie standardów postępowania, prowadzenia badań oraz szkolenie personelu są elementami, które w sposób pozytywny mogą zmieniać opisaną sytuację.
Artykuł 2 Kodeksu Etyki Lekarskiej (5) mówi, że powołaniem lekarza jest (...) niesienie ulgi w cierpieniu, a artykuł 3, że lekarz (...) winien wypełniać swoje obowiązki z poszanowaniem człowieka bez względu na wiek (...) czy inne uwarunkowania. Nie ulega więc wątpliwości, że zapobieganie i leczenie bólu u dzieci powinno należeć do podstawowych obowiązków lekarza, szczególnie wtedy, gdy właśnie on zadaje dziecku ból stosując agresywne metody diagnostyczne i terapeutyczne. Artykuł 73 Kodeksu mówi, że lekarz nie może uczestniczyć w (...) poniżającym traktowaniu człowieka. Nie może też wykorzystywać swej wiedzy i umiejętności dla ułatwienia stosowania jakich- kolwiek form okrutnego postępowania. Zadawanie niepotrzebnego i niezrozumiałego dla dziecka bólu, z jednoczesnym stosowaniem przymusu fizycznego, we wszystkich przypadkach, gdy można zastosować środki przeciwbólowe, należy uznać za postępowanie poniżające i okrutne. Lekarz powinien dołożyć starań by wykorzystać całą dostępną mu wiedzę w celu ograniczenia takiego postępowania do sytuacji wyjątkowych. Lekarz, który nie potrafi zastosować zalecanych metod zapobiegania i leczenia bólu jatrogennego, nie powinien wykonywać bolesnych zabiegów u dzieci.
Metody terapeutyczne w postępowaniu przeciwbólowym dzieli się tradycyjnie na: farmakologiczne, psychologiczne, chirurgiczne, anestezjologiczne i inne np. fizykoterapia, akupunktura, elektryczna stymulacja nerwów obwodowych. Poniżej zostaną omówione jedynie wybrane metody farmakologiczne z uwagi na ograniczone ramy artykułu.
Paracetamol
Paracetamol (acetaminofen), wprowadzony do praktyki klinicznej w 1893 roku (6), jest najbardziej popularnym lekiem przeciwbólowym i przeciwgorączkowym stosowanym u dzieci (7, 8). Niestety zalecenia kolportowane przez producentów, ograniczające dobową dawkę paracetamolu u dzieci do 60 mg/kg m.c., a następnie bezkrytycznie publikowane w poradnikach terapeutycznych dla lekarzy, utrudniają prawidłowe tzn. skuteczne i bezpieczne stosowanie tego leku u dzieci. Przyczyną tych zaleceń jest z jednej strony obawa przed zatruciem i ewentualnymi skutkami prawnymi, zaś z drugiej strony brak wiedzy na temat farmakokinetyki tego leku. Ich następstwem jest oczywiście stosowanie dawek subterapeutycznych, które nie zapewniają analgezji. Także wysokość pojedynczej dawki i częstość jej podawania powoduje szereg kontrowersji. Staje się zatem konieczne zrewidowanie dotychczasowych poglądów dotyczących sposobu dawkowania paracetamolu u dzieci w oparciu o dostępną wiedzę z dziedziny farmakologii i toksykologii (9).
Kuriozalną informację opublikował swego czasu poradnik „Leki Współczesnej Terapii” (10): zgodnie z decyzją Światowej Organizacji Zdrowia Komisja Leków Instytutu Leków w Warszawie zabroniła podawania dzieciom doustnie paracetamolu i preparatów zawierających paracetamol. Ponieważ stwierdzenie to nie znajduje potwierdzenia w żadnych materiałach źródłowych, trudno je skomentować. Można przypuszczać, że pomylono kwas acetylosalicylowy z paracetamolem. Niestety szerzone w ten sposób przesądy zastępują rzetelną wiedzę i prowadzą do dyskryminacji najmłodszych pacjentów, którzy nigdy sami nie upomną się o swoje prawa.
Paracetamol może być stosowany w bólu ostrym i przewlekłym, słabym lub o umiarkowanym nasileniu (w silniejszych bólach np. bólu nowotworowym (11, 12) może być podawany razem z kodeiną, tramadolem lub morfiną).
Doustne podanie dawki 10 mg/kg powoduje działanie przeciwgorączkowe, które zaczyna się po 30 minutach, osiąga szczyt pomiędzy 2-3 h i trwa przez 4-6 h. Zwiększanie dawki powoduje większe obniżenie temperatury oraz wydłużenie efektu (tab. 1).
Tabela 1. Działanie przeciwgorączkowe paracetamolu w zależności od dawki (13).
| Dawka doustna (mg/kg) | Obniżenie temperatury (°C) | Czas działania (h) |
| 10 | 1,6 | 4 |
| 20 | 2,0 | 7 |
Dożylne jednorazowe podanie propacetamolu (prekursor paracetamolu) w dawce 30 mg/kg (dawka równoważna 15 mg/kg paracetamolu), u dzieci z temperaturą ciała powyżej 39°C, obniża stopniowo temperaturę, która osiąga najniższe wartości 2-3,5 h po podaniu (14). Rycina 1 przedstawia efekt propacetamolu po 15 i 30 minutach od podania.
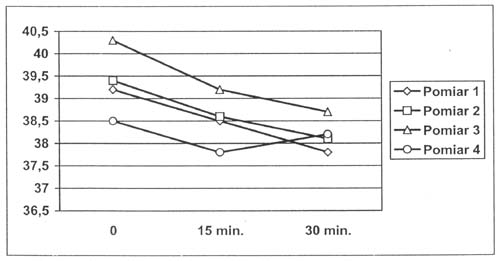
Ryc. 1. Wpływ propacetamolu (Pro-Efferalgan) na temperaturę ciała podanego w jednorazowej dawce dożylnej 25 mg/kg u 6-letniego chłopca. Temperaturę ciała mierzono pod pachą przed podaniem propacetamolu (0), 15 minut po podaniu (15 min.) i 30 minut po podaniu (30 min.). Poszczególne pomiary wykonywano w różnych dniach.
Dożylne podanie propacetamolu powoduje wystąpienie działania przeciwbólowego osiągającego szczyt po 2 h i utrzymującego się przez 4 h. Poziom efektu przeciwbólowego koreluje ze stężeniem paracetamolu w płynie mózgowo-rdzeniowym (15).
Okres półtrwania eliminacji paracetamolu u dorosłych wynosi 3,6 h, u dzieci 1,4-4,5 h, i donoszonych noworodków 1,2-4,9 h (9). Po podaniu dożylnym propacetamolu, u dorosłych okres półtrwania eliminacji paracetamolu w osoczu wynosi 2,4 h, a w płynie mózgowo-rdzeniowym 3,2 h (16).
Paracetamol podany doustnie lub dożołądkowo ulega wchłanianiu w jelicie cienkim. Biodostępność paracetamolu podanego doustnie wynosi 82% w porównaniu z preparatem podanym dożylnie. Z kolei biodostępność paracetamolu w formie czopków doodbytniczych wynosi 80% biodostępności preparatów doustnych.
Nahata i wsp. (17) wykazali, że podawanie paracetamolu u dzieci w dawce 12-14 mg/kg co 4 h może prowadzić u niektórych pacjentów do niewielkiej kumulacji leku. Maksymalne stężenia paracetamolu w osoczu po pierwszej dawce wynosiły 9,96-19,6 µg/ml, zaś po uzyskaniu stanu równowagi (po 48-72 h) 13,2-25,9 µg/ml. Obserwowany niewielki wzrost stężenia paracetamolu w osoczu mieścił się w zakresie wartości bezpiecznych, zaś uzyskane wyniki potwierdzają skuteczność badanego sposobu dawkowania. Zdaniem autora potwierdzają także bezpieczeństwo tego sposobu dawkowania (porównaj z wartościami stężeń toksycznych podanymi w tabeli 2). Jednak większość zaleceń (18) ogranicza możliwość tego sposobu dawkowania do pierwszych 72 godzin terapii. Wyjaśnienie tego problemu będzie możliwe po przeprowadzeniu dalszych badań farmakokinetycznych.
Tabela 2. Zależność pomiędzy doustną dawką a maksymalnym stężeniem paracetamolu w osoczu u dzieci.
| Dawka (mg/kg) | Wiek | C max (µg/ml)** | T max (min | Autor |
| 12-14 | 0,5-6,4 lat | 9,96-19,6 | ? | 17 |
| 16* | 7-17 dni | 9-13,4 | 70 | 19 |
| 20* | 2-6 mies. | 6,6-12,8 | 66 | 19 |
| 15* | 1-4 lat | 9-12 | 114 | 19 |
| 22-27 | 0,5-6,4 lat | 13,9-40,1 | ? | 17 |
Objaśnienia: C max – maksymalne stężenie w osoczu;
T max – średni czas od podania leku do wystąpienia maksymalnego stężenia;
* Lek był podawany przez sondę do żołądka w okresie pooperacyjnym;
** Poziom terapeutyczny w osoczu wynosi 10-20 µg/ml.
Propacetamol, dożylny prekursor paracetamolu, w ciągu 7 minut po wstrzyknięciu ulega hydrolizie przez esterazy osoczowe: 2 g propacetamolu uwalniają 1 g paracetamolu. U dorosłych po podaniu dożylnym 2 g propacetamolu maksymalne stężenie paracetamolu w osoczu występuje po 30 min., osiągając średnią wartość 13 µg/ml; maksymalne stężenie w płynie mózgowo-rdzeniowym występuje po 4 h, osiągając średni poziom 6 µg/ml (16).
Działanie przeciwbólowe zapewniają okresowe (co 4 h) wzrosty stężenia paracetamolu w osoczu, uzyskiwane przez podawanie pojedynczych dawek (w odróżnieniu od równoważnej dawki dobowej podawanej w ciągłej infuzji) (25). Szybkie podanie dożylne propacetamolu powoduje efekt przeciwbólowy, który osiąga maksimum po 2 h i trwa około 4 h.
U dzieci jednorazowe podanie propacetamolu w dawce 15 mg/kg nie zapewnia poziomu terapeutycznego. Natomiast po podaniu dawki 30 mg/kg stężenie paracetamolu w soczu wynosi średnio 15 µg/ml po 1 h i 5 µg/ml po 4 h (14). Z niezrozumiałych powodów propacetamol (Pro-Efferalgal?) zalecany jest przez producenta dopiero u dzieci w wieku powyżej 13 lat.
Tabela 3. Zależność pomiędzy doodbytniczą dawką paracetamolu a maksymalnym stężeniem paracetamolu w osoczu u dzieci.
| Dawka (mg/kg) | Wiek | C max
(µg/ml)* | T max (min) | Autor |
| 10 | 7-12 lat | 4,0 ? 1,6 | 73,3 ? 37,1 | 20 |
| 18 | 7-17 dni | 7,9 | 58 | 19 |
| 18 | 2-5 mies. | 5,7 | 78 | 19 |
| 15 | 1-5 lat | 5,3 | 153 | 19 |
| 20 | 4,4 ? 1,4 lat | 10,92 ? 1,71 | 120 | 21 |
| 20 | 2-7 lat | 11,2-13,3 | 73-78 | 22 |
| 20 | 36-42 Hbd | 8,31 | ? | 23 |
| 20 | 28-32 Hbd | 11,86 ? 3,74 | 240 | 24 |
Objaśnienia: C max – maksymalne stężenie w osoczu;
T max – średni czas od podania leki do wystąpienia maksymalnego stężenia;
* Poziom terapeutyczny w osoczu wynosi 10-20 µg/ml.
Zasady dawkowania paracetamolu
1. Sposób dawkowania powinien zapewnić poziom terapeutyczny w osoczu, który wynosi 10-20 µg/ml. Cykliczne osiąganie tego poziomu umożliwia przejście leku do oun i wywołanie efektu przeciwbólowego trwającego ok. 4 h.
2. Utrzymanie regularnych 4-godzinnych odstępów czasu pomiędzy kolejnymi dawkami zapewnia analgezję i zapobiega kumulacji leku. Nie należy podawać leku „na żądanie”, ani w ciągłym wlewie dożylnym.
3. Ze względu na bezpieczeństwo pacjenta nie należy przekraczać maksymalnej dawki dobowej, która dla podaży doustnej wynosi 90 mg/kg/24 h lub 4 g/24 g. Zgodnie z brytyjskimi zaleceniami (18) dawkę maksymalną można stosować przez 72 godziny.
4. W celu przyspieszenia efektu farmakologicznego można zastosować dawkę wstępną, która jest wyższa od dawki podtrzymującej.
5. Dawki doodbytnicze powinny być o 20-30% wyższe od doustnych, z uwagi na niższą biodostępność.
6. Nie ma żadnych podstaw by sądzić, że dawki przeciwgorączkowe powinny być niższe od przeciwbólowych.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Pawłowska-Wójcik M. i wsp.: Monitorowanie bólu pooperacyjnego u dzieci. Anest. Int. Ter., 1989, 21:265-270. 2. Pediatria. Red. Górnicki B., Dębiec B., Baszczyński J. PZWL Warszawa, 1995. 3. Tędziagolska M., Ziółkowski J.: Postępowanie przeciwbólowe w okresie pooperacyjnym w ośrodkach pediatrycznych. IV Sympozjum Sekcji Pediatrycznej Polskiego Towarzystwa Anestezjologii i Intensywnej Terapii, Sobieszewo 1992. 4. Dangel T.: Ankieta przeprowadzona wśród uczestników kursu CMKP. Leczenie bólu i opieka paliatywna u dzieci, Marzec 1996, Dane nie- publikowane. 5. Kodeks Etyki Lekarskiej (znowelizowany), III Krajowy Zjazd Lekarzy 1993. 6. Von Meyring J.: Beiträge zur Kenntniss der Antipyretica. Ther Mschr. 1893m 7:577. 7. Radzikowski A., Mrożewska M.: Paracetamol w zakażeniach dróg oddechowych. Wydawnictwo Czelej 1997. 8. Ziółkowski J.J., Ziółkowska H.: Ból i zastosowanie paracetamolu u dzieci. Wydawnictwo Czelej 1997. 9. Dangel T.: Paracetamol: farmakologia i toksykologia u dzieci. Trzecie Francusko-Polskie Spotkania Pediatryczne 1994, 38-43. 10. Podlewski J.K., Chwalibogowska-Podlewska A.: Leki Współczesnej Terapii. PZWL Warszawa 1986. 11. Dangel T.: Leczenie bólu nowotworowego u dzieci. [W:] Leczenie bólu i opieka paliatywna u dzieci. Instytut Matki i Dziecka & Warszawskie Hospicjum dla Dzieci 1997. 12. Dangel T.: Chronic pain in children. Part. I Cancer and phantom pain. Paediatric Anaesthesia 1998, 8:5-10. 13. Temple A.R.: Review of comparative antipyretic activity in children Am. J. Med. 1983, 14:38-46. 14. Granry J.C. et al.: Pharmacokinetics and antipyretic effects of an injectable pro-drug of paracetamol (proparacetamol) in children. Paediatric Anaesthesia 1992, 2:291-295. 15. Luthy C.S. et al.: Administration profile controls acetaminophen analgesia. Clin. Pharmacol. Ther. 1993, (53), 2, 171 Abstr P II-3. 16. Bannwarth B. et al.: Plasma and cerebrospinal fluid concentrations of paracetamol after a single intravenous dose of proparacetamol. Br. J. Clin. Pharmac. 1992, 34:79-81. 17. Nahata M.C. et al.: Acetaminophen accumulation in pediatric patients after repeated therapeutic doses. Eur. J. Clin. Pharmacol. 1984, 27:57-59. 18. Royal College of Paediatrics and Child Health: Prevention and control of pain in children. A manual for health care professionals. BMJ Publishing Group, London 1997. 19. Hopkins C.S. et al.: Pharmacokinetics of paracetamol after cardiac surgery. Archives of Disease in Childhood 1990, 65:971-976. 20. Keinanen-Kiukaanniemi S. Et al.: Antipyretic effect of plasma concentrations of rectal acetaminophen and diazepam in children. Epilepsia 1979, 20:607-612. 21. Gaudreault P. Et al.: Pharmacokinetics and clinical efficacy of intrarectal solution of aceraminophen. Can J. Anaesthesiol 1988, 35:149-152. 22. Sponheim S. Et al.: Plasmaconcentrations of paracetamol in children: analgesic effect of two different rectal formulations compared with placebo. Proceedings and Abstracts of the Second European Congress of Paediatric Anaesthesia 144 Rotterdam 1989. 22. Quak J.M.E. et al.: Pharmacokinetics of rectally administered multiple dose acetaminophen in term infants. Fourth International Symposium on Pediatric Pain 30 Helsinki 1997. 24. van Lingen R.A., Deinum J.T.: Pharmacokinetics of rectally administered single dose aceraminophen in preterm infants. Third International Symposium on Pediatric Pain 141 Philaelphia 1994. 25. Luthy C.S. et al.: Administration profile controls aceraminophen analgesia. Clin. Pharmacol Ther 1993, (53) 2, 171, Abstr P II-3. 26. Miller R.P. et al.: Acetaminophen elimination kinetics in neonates, children and adults. Clinical Pharmacology and Therapeutics 1976, 19:284-294. 27. Rumack B.H., Matthew H.: Acetaminophen poisoning and toxicity. Pediatrics 1975, 55:871-873. 28. Lynn A.M. et al.: Respiratory effects of intravenous morphije infusions in neonates, infants and children after cardiac surgery. Anesth Analg. 1993, 77:695-701. 29. Lynn A.M.: Clinical pharmacology of opioid analgesics in children. Fourth International Symposium on Pediatric Pain. Helsinki 1997. 30. Lynn A. et al.: Clearance of morphine in postoperative infants during intravenous infusion: the influence of age and surgery. Anesth Analg 86, 1998 (w druku) dane udostępnione dzięki uprzejmości autorki. 31. Piekarczyk A.: Farmakologia opioidów u dzieci. [W:] Leczenie bólu i opieka paliatywna u dzieci. Instytut Matki i Dziecka & Warszawskie Hospicjum dla Dzieci 1996. 32. Doyle E. Et al.: Patient – controlled analgesia with low dose background infusions after lower abdominal surgery in children. British Journal of Anaesthesia 1993, 71:818-822.


