© Borgis - Postępy Fitoterapii 1/2007, s. 7-11
*Edyta Kwiatkowska
Izotiocyjaniany wasabi (Wasabia japonica)
Isothiocyanates in wasabi (Wasabia japonica)
Katedra Organizacji i Ekonomiki Konsumpcji SGGW w Warszawie
Summary
The Wasabia Japonica (Wasabi) is aromatic herb used as spices and condiments due to their characteristic flavour. The flavour comes from the liberation of volatile isothiocyanates by the hydrolysis of precursor glucosinolates. Wasabi contained about 2000 mg/kg total isothiocyanate. Glucosinolates are responsible for the secretion of detoxifying enzymes that remove carcinogens from the organism. Furthermore, they activate proteins and II phase detoxifying enzymes. Scientist reported that isothiocyanates – chemical compounds found in wasabi - inhibited the growth of Streptococcus mutans, the bacteria that cause dental caries, during test-tube studies. Wasabi has antimicrobial properties – which may account for its popularity as food additives to raw fish. The food additives are very important that is why scientists are still investigating their beneficial note in cancer prevention and management.

Wprowadzenie
Wasabi – botaniczna nazwa Wasabia japonica (ryc. 1), jest rośliną z rodziny krzyżowych, czyli należy do rodziny tzw. roślin kapustnych. Wasabi naturalnie występuje wzdłuż górskich dolin rzecznych w Japonii. Prowadzi się również sztuczne uprawy tej rośliny w Kanadzie, USA (w stanie Oregon), Australii i Nowej Zelandii. Uprawia się ją głównie dla jej kłączy, które są używane do przygotowywania wysokiej jakości pasty wasabi.

Ryc. 1. Wygląd rośliny Wasabia japonica.
Wasabi było już znane w Japonii w erze Nara (710-793) jako medyczne ziele i jako antidotum na zatrucia pokarmowe. Wasabi nazywany jest często chrzanem japońskim. Jest zielonego koloru i charakteryzuje go bardzo ostry, „gorący” smak i „kłujący” aromat, który jednak daleki jest od chrzanu europejskiego. Wasabi jest popularną przyprawą w kuchni japońskiej, ale ostatnio również gości w Europie i w Polsce wraz z rozwojem nowych „gorących” smaków.
Ten ostry, unikalny smak wasabi zawdzięcza dużej zawartości lotnego związku – izotiocyjanianu. Nie występuje on bezpośrednio w roślinie, ale jest uwalniany ze związków siarkowych – glukozynolanów. Glukozynolany są charakterystycznymi metabolitami roślin z rodziny krzyżowych. Glukozynolany (GLS) są produktami metabolizmu czterech aminokwasów: metioniny (GLS alifatyczne), fenyloalaniny lub tyrozyny (GLS arylowe) oraz tryptofanu (GLS indolowe) (1). Glukozynolany są związkami o niewielkiej aktywności biologicznej, natomiast wysoką aktywnością charakteryzują się produkty ich enzymatycznej hydrolizy. Pod wpływem enzymu mirozynazy (ryc. 3), uruchamianej w trakcie uszkodzeń tkanek roślin, glukozynolany są hydrolizowane do wolnej glukozy i niestabilnego aglikonu (jonu tiohydroksymo-O-sulfonowego), degradowanego następnie do jonu siarczanowego oraz wielu biologicznie czynnych produktów, głównie izotiocyjanianów, nitryli i tiocyjanianów (2) (ryc. 3).

Ryc. 2. Wzór chemiczny glukozynolanu.
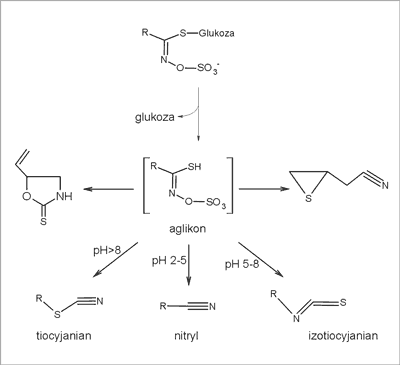
Ryc. 3. Schemat hydrolizy glukozynolanów do izotiocyjanianów pod wpływem enzymu mirozynazy (3).
Według badań naukowych zawartość izotiocyjanianów w świeżym wasabi wynosi ok. 2000 mg/kg. Dlatego tak istotne jest odpowiednie preparowanie kłączy tej rośliny. W tradycyjnej kuchni japońskiej, kłącze wasabi jest uważnie obierane, szorowane miękką szczotką a następnie tarte na tarce (ryc. 4). Niektórzy japońscy Mistrzowie Sushi używają tylko tarki ze skóry rekina, inni posługują się tarkami metalowymi. Ale podobno, tylko ścieranie na tarce ze skóry rekina nadaje utartemu wasabi gładkie, miękkie i aromatyczne wykończenie.

Ryc. 4. Wygląd kłącza wasabi po roztarciu na tarce.
Oryginalne i świeże wasabi nazywane jest „Hon Wasabi”, co oznacza prawdziwe wasabi, aby odróżnić je od imitacji. Prawdziwe wasabi jest bardzo drogie i mało dostępne. Wszędzie, gdzie kuchnia japońska cieszy się popularnością, są dostępne imitacje wasabi w proszku, lub w postaci gotowej pasty w tubce. Takie wasabi produkowane jest z chrzanu i gorczycy oraz barwione na zielono, np. spiruliną, aby nadać zbliżony kolor do prawdziwego wasabi. Proszek wasabi należy rozprowadzić wodą do konsystencji gęstej papki, natomiast pastę z tubki też najczęściej trzeba rozrzedzić wodą.
Wasabi jest niezbędne do przygotowania sushi i sashimi, czyli dań japońskich przygotowywanych ze świeżej ryby oraz jako dodatek do sosów, zup i dań z makaronu w kuchni japońskiej oraz sporządzania marynat. Używanie wasabi do potraw z surowej ryby nie jest przypadkowe, gdyż już w starożytnej Japonii używano tej rośliny do leczenia zatruć pokarmowych. Wasabi ma własności środka przeciwdrobnoustrojowego i dlatego tłumaczy to popularność stosowania wraz z surową rybą (4).
Najczęściej konsumenci restauracji sushi mieszają pastę wasabi z sosem sojowym i w takiej mieszaninie maczają porcję sushi lub sashimi. Jednak wytworni smakosze wolą rozprowadzić niewielką ilość wasabi na rybie, a następnie zanurzyć ją w sosie sojowym, w taki sposób, aby sos nie stykał się z wasabi.
Przegląd badań
Oprócz walorów smakowych i aromatycznych oraz wspomnianej roli jako antidotum w zatruciach pokarmowych, wasabi tak jak inne rośliny z rodziny krzyżowych ma duże znaczenie w zapobieganiu chorobom nowotworowym.
Szczególnie wysoką zawartość glukozynolanów mają warzywa należące do rodziny Cruciferae (2). Zaliczane są do nich: kapusta (biała, czerwona, włoska, pekińska), brukselka, kalafior, rzodkiewka i rzodkiew, rzepa, brokuły, jarmuż, rzeżucha i oczywiście wasabi i chrzan (tab. 1). Najwyższe ilości glukozynolanów znajdują się w rzeżusze (do 658 mg/100 g), a jedne z najniższych w kapuście pekińskiej (19 mg/100 g) (5). Również surowe warzywa wykazują wyższą zawartość glukozynolanów niż warzywa przetwarzane (gotowane, mrożone) (tab. 1).
Tabela 1. Źródła glukozynolanów i ich zawartość w wybranych produktach roślinnych (5, 6).
| Produkt | Forma produktów | Średnia zawartość glukozynolanów (mg/100 g) |
| Rzeżucha | surowa | 20-658 |
| Wasabi | surowe | 165-281 |
| Chrzan | surowy | 12-160 |
| Brokuły | surowe | 19-127 |
| Brokuły | gotowane | 20-37 |
| Kapusta, kapusta pekińska | surowa | 19-84 |
| Kapusta czerwona | surowa | 62-76 |
| Kapusta czerwona | gotowana | 54-80 |
| Kapusta włoska | surowa | 76-99 |
| Kapusta biała | surowa | 10-51 |
| Kalafior | surowy | 23-43 |
| Kalafior | gotowany | 00-42 |
| Kalarepa | surowa | 40-52 |
| Gorczyce | surowe | 09-118 |
| Rzodkiewka czarna | surowa | 81-92 |
| Rzodkiewka europejska | surowa | 44-79 |
| Rzodkiewka biała | surowa | 70-95 |
| Rzepa | surowa | 00-93 |
Izotiocyjanianom obficie występującym w roślinach z rodziny krzyżowych, a w szczególnie dużej zawartości w wasabi, przypisuje się właściwości przeciwnowotworowe oraz rolę wspomagającą syntezę enzymów odtruwających, odpowiedzialnych za szybkie wydalanie z organizmu substancji rakotwórczych.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Fenwick G.R., Heaney R.K., Mullin W.J.: Glucosinolates and their breakdown products in food and food plants. CRC Crit. Rev. Food Sci. Nutr. 1983, 18, 123. 2. Huang M.T., Ferraro T., Ho C-T.: Cancer chemoprevention by phytochemical in fruits and vegetables. An overview. W: Food phytochemicals for cancer preventon. T. I. Fruits and Vegetables (red. M.T. Huang i wsp.). Am. Chem. Soc., Washington 1994, 2-16. 3. Chen S., Andreasson E.: Update on glucosinolate metabolism and transport. Plant Physiol. Biochem. 2001, 39, 743. 4. www.sciencedaily.com/releases/2000/12/00125082049.htm. 5. Mc Naughton S.A., Marks G.C.: Development of food composition database for the estimaton of dietary intake of glucosinolates, the biologically active constituents of cruciferous vegetables. Br. J. Nutr. 2003, 90, 687. 6. Sultana T., Savage G.P., Mc Neil D.L. i wsp.: Comparison of flavour compounds in wasabi and horseradish. Food Agric. Environ. 2003, 1, 117. 7. Smith T.J., Yang CH.S.: W: Food phytochemicals for cancer prevention. T. I. Fruits and Vegetables (red. M.T. Huang i wsp.). Am. Chem. Soc., Washington 1994, 18. 8. Fuke Y., Haga Y., Ono H. i wsp.: Biomedical and Life Sciences. Cytotechnology 1997, 25, 197. 9. Talalay P. Fahey J.W.: Phytochemicals from cruciferous plants protect against cancer by modulating carcinogen metabolism. J. Nutr. 2001, 131, 3027. 10. Troszyńska A., Honke J., Kozłowska H.: Naturalne substancje nieodżywcze (NSN) pochodzenia roślinnego jako składniki żywności funkcjonalnej. Post. Fitoter. 2000, Nr 2, 17. 11. Van Poppel G., Verhoeven D.T., Verhagen H. i wsp.: Brassica vegetables and cancer prevention. Epidemiology and mechanism. Adv. Exp. Med. Biol. 1999, 472, 159. 12. Giovannucci E., Rimm E., Yan L. i wsp.: A prospective study of cruciferous vegetables and prostate cancer. Cancer Epidemiol. Biomark. Prevent. 2003, 12, 1403. 13. Kampman E., Arts I., Hollman P.: Plant foods versus compounds in carcinogenesis; observational versus experimental human studies. Int. J. Vitam. Nutr. Res. 2003, 73, 70. 14. Michaud D.S., Spiegelman D., Clinton S.K. i wsp.: Fruit and vegetable intake and incidence of bladder cancer in male prospective cohort. J. Nat. Cancer Inst. 1999, 91, 61. 15. Jain M.G., Hislop G.T., Howe G.R. i wsp.: Plant foods, antioxidants and prostate cancer risk: findings from case-control studies in Canada. Nutr. Cancer 1999, 34, 173. 16. Kolonel L.N., Hankin J.H., Whittemore A.S. i wsp.: Vegetables, fruits, legumes and prostate cancer: a multicancer case-control study. Cancer Epidemiol. Biomark. Prevent. 2000, 9, 795.




