© Borgis - Postępy Fitoterapii 1/2007, s. 39-45
*Tadeusz Wolski1, Dariusz Matosiuk2, Tomasz Baj1, Agnieszka Ziewiec2
Szanta zwyczajna ( Marubium vulgare L.) – roślina lecznicza o wielokierunkowym działaniu farmakologicznym
White/common horehound (Marubium vulgare L.) – medical plant with multidirectional pharmacological activity
1Katedra i Zakład Farmakognozji z Pracownią Roślin Leczniczych Akademii Medycznej im. prof. F. Skubiszewskiego w Lublinie
Kierownik Katedry i Zakładu: prof. dr hab. Kazimierz Głowniak
2Katedra i Zakład Syntezy i Technologii Chemicznej Środków Leczniczych Akademii Medycznej im. prof. F. Skubiszewskiego w Lublinie
Kierownik Katedry i Zakładu: dr hab. Dariusz Matosiuk, prof. AM
Summary
The main goal for this work is presentation of the scientific literature describing biological activity of the White/Common Horehound (Marrubium wulgare L., F. Lamiaceae). Biological activity of the Horehound were known for years, with beginning of its use reaching the time of the ancient Egypt. Extracts of the Horehound induce excretion process of the liver, because bile acts also on the mucous membrane of the upper respiratory tract and enhance secretion of the mucus. Additionaly they act also as relaxant on smooth muscles. Raw matterial and its preparations affect the cardio-vascular system acting as antiarrhythmic, similar to quinidine. Active substances present in the Horehound, especially marrubine, marrubenic acid and marrubenol exhibit antinociceptive, cholagogic and hypotensive activities respectively.

Szanta zwyczajna ( Marrubium vulgare L.) należy do rodziny wargowych ( Lamiaceae). Literatura podaje, iż rodzaj Marrubium liczy około 40 gatunków, z których najbardziej znane są: Marrubium alternidens, M. alysson., M. cylleneum, M. friwaldskyanum, M. incanum, M. kotschyi, M. leonuroides, M. libanoticum, M. peregrinum, M. pestalozzae, M. rotundifolia, M. supinum, M. thessalum, M. velutinum, M. vulgare (White Horehound lub Common Horehound) (l). Szanta zwyczajna jest rośliną znaną od tysięcy lat. Egipscy kapłani doceniali jej właściwości lecznicze i zwali ją: nasieniem Horusa, krwią byka lub okiem gwiazdy (2-4).
Starożytni Rzymianie uważali szantę za cenny lek ziołowy, jej nazwa łacińska „marrubium” pochodzi prawdopodobnie od Maria urbus, nazwy antycznego miasta Cesarstwa Rzymskiego (2). Inne źródła podają, że nazwa rośliny pochodzi od hebrajskiego słowa „marrob ” (gorzkie ziele), będącego jednym z gorzkich ziół używanych przez Izraelitów w obchodach święta Paschy (l, 3). Starożytni Grecy używali szanty do leczenia chorych pogryzionych przez wściekłe psy, co prawdopodobnie odzwierciedla w angielskiej nazwie „Horehound” obecność słowa „hound” (z ang. zły pies) (5). W Polsce szanta nazywana jest: krzeciną, krzeszyną, gojnikiem (6, 8).
Szanta występuje w Europie, Ameryce Południowej, Afryce i Australii (7-10). W Polsce spotyka się ją jako roślinę dziko rosnącą na przydrożach, rumowiskach, pastwiskach, ubogich łąkach i polach (6, 11).
Budowa morfologiczna i anatomiczna
Szanta zwyczajna jest wieloletnią byliną, wysokości od 30 do 80 cm, o łodygach wzniesionych, gałęzistych w części górnej, czterokanciastych, pokrytych kutnerowym owłosieniem. Roślina posiada prosty, biały, drewniejący korzeń. Dolne liście są sercowatookrągławe, górne jajowate, wszystkie ogonkowe, naprzeciwległe, pomarszczone, brzegami grubo i nierówno ząbkowane. Górna powierzchnia liści jest ciemnozielona, dolna pokryta szarym kutnerem, co nadaje liściom kształt wełnisty. Liście mają charakterystyczny smak i zapach piżma, który zanika podczas suszenia (12, 13, 73).
Kwiaty białe, drobne, dwuwargowe, zrosłopłatkowe, zebrane w nibyokółki wyrastające w kątach liści, tworzące kuliste kwiatostany. Kielich drobny, dziesięcioząbkowy do 0,8 cm długości, korona biała dwuwargowa do 0,6 cm długości, kutnerowata. Owocem jest czterodzielna rozłupnia, rozpadająca się na 4 podługowate rozłupki z nasionami. Mają one kształt jajowaty, lekko trójkanciasty, powierzchnia ich jest lekko matowa, chropowata o barwie szarobrunatnej. Długość rozłupki wynosi 1,8-2,3 mm, szerokość 0,7-1,2 mm, zaś grubość 0,7-0,9 mm. Masa 1000 rozłupek waha się w granicach 0,95-1,00 g. Nasiona dojrzewają w końcu lipca lub na początku sierpnia i zachowują zdolność kiełkowania w okresie 4 lat. (12, 14-16).
Uprawa
Szanta jest rośliną średnio wymagającą odnośnie gleby. Odporna na mróz, toleruje szeroki zakres warunków klimatycznych. Warunki klimatyczne Polski są odpowiednie do jej uprawy, wskazane są gleby żyzne, średniozwięzłe, jednak odpowiednio wilgotne, o odczynie lekko kwaśnym do obojętnego. Najbardziej przydatne są gleby płowe, brunatne, rędziny, czarne ziemie i lekkie mady. Szanta uprawiana jest najczęściej z nasion. Materiał siewny stanowią owoce suche – niełupki. Nasiona dojrzewają w końcu lipca lub na początku sierpnia. Zdolność kiełkowania nasiona zachowują przez 4 lata. Plantacje można zakładać przez siew nasion do gruntu lub siew na rozsadniku. Do gruntu wysiewa się szantę w kwietniu w rzędy, co 40 cm na głębokość 1 cm. W sprzyjających warunkach atmosferycznych nasiona kiełkują po dwóch tygodniach. Rozsadę wysadza się do gruntu, gdy ma już 2-3 pary liści. Wysadzając rozsadę w rozstawie 40 x 30 cm na 1 hektar potrzeba ok. 84 tys. sztuk. Na założenie plantacji potrzeba przy wysiewie do gruntu około 8 kg nasion na hektar, natomiast przy wysiewie do rozsadnika 3 kg (17-20).
Surowcem zielarskim jest ziele szanty zebrane w czasie pełni kwitnienia; co zwykle przypada na czerwiec. Ziele ścina się ręcznie lub kosiarkami, suszy się w suszarniach powietrznych w cieniu i przewiewie lub suszarniach ogrzewanych do temp. 35°C. Na 1 kg suszu potrzeba 4-5 kg świeżej masy. Dobrze wysuszony surowiec umieszcza się w wielowarstwowych papierowych torbach szczelnie zawiązanych, które przechowuje się w suchych pomieszczeniach.
Plon ziela w pierwszym roku uprawy wynosi 1,5-2 t/ha, zaś w drugim i następnych latach 2-3 t/ha, zaś plon nasion 100-200 kg/ha. Ziele ma gorzki, ściągający smak, po roztarciu przypominający jabłka (19-21).
Skład chemiczny
Głównym składnikiem ziela szanty jest mieszanina związków diterpenowych: marubina w ilości od 0,3-1%, premarubina 0,1%, alkohole diterpenowe: marubenol, premarubenol, peregrinol, vulgarol (21-23); sterole i triterpeny: kwas ursolowy 0,l%; pochodne fenolokwasów z grupy fenylopropanoidów (24-26); flawonoidy: apigenina, luteolina, kwercetyna i ich glikozydy (27); taniny i garbniki 7%; alkaloidy typu pirolidyny: betonicyna 0,3%, truicyna, cholina; olejek eteryczny w ilościach 0,05%, i inne związki w mniejszych ilościach, takie jak kwasy organiczne, sole mineralne, saponiny, śluzy (25, 28-30).
Najważniejszą grupą związków biologicznie czynnych występujących w zielu szanty są pochodne diterpenów.
Diterpeny stanowią grupę związków zbudowanych z czterech reszt hemiterpenowych. Do diterpenów należą związki o różnorodnej funkcji i budowie, takie jak hormony wzrostu (gibereliny), witaminy (grup A, E, K), chromoforowe składniki purpury wzrokowej (retinina), alkoholowy składnik chlorofilów (fitol), kwasy żywiczne (np. kwas abietynowy), alkaloidy (koniina), czynniki słodzące (stewiozyd) i szereg innych związków o nieustalonej dotychczas funkcji. Diterpeny są szczególnie szeroko rozpowszechnione w świecie roślin. Biogeneza tej grupy związków wywodzi się od geranylogeraniolu, który powstaje w reakcji przedłużenia łańcucha prenylowego z udziałem pirofosforanu farnazylu (FPP) oraz pirofosforanu izopentynylu (IPP). Reakcję katalizuje transferaza prenylowa. Substancje z tej grupy są nielotne z parą wodną i stanowią składniki żywic i tzw. balsamów, które są bardzo złożonymi mieszaninami związków terpenowych, pochodnych fenylopropanu i wielu innych (31-33). Schemat przemian biogenetycznych izoprenoidów, ze szczególnym uwzględnieniem: mono-, seskwi-, di-, tri- oraz tetraterpenów przedstawia rycina 1.
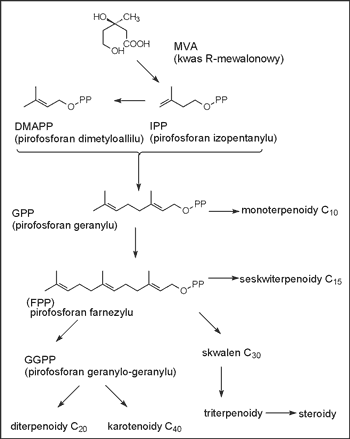
Ryc. 1. Schemat przemian biogenetycznych izoprenoidów (32).
Niecykliczne składniki pirofosforanu geranylu (GGPP) mogą ulegać cyklizacji przechodząc w izomeryczny pirofosforan geraniolu, który cyklizuje do dicyklicznego pirofosforanu labdanylu, a ten zaś w wyniku dalszych przemian może tworzyć furanolabdany i ich pochodne, co przedstawia rycina 2.

Ryc. 2. Etapy cyklizacji diterpenów i powstawanie struktury furanolabdanu.
Na rycinie 3 przedstawiono struktury furanolabdanów: premarubiny, premarubenolu, marubiny, marubenolu oraz kwasu marubenowego. Rozdział tych związków i otrzymywanie marubiny opisali Rodrigez i wsp. (34), zaś warunki analizy ekstraktów metodą TLC podaje piśmiennictwo (56).

Ryc. 3. Struktury furanolabdanów występujących w zielu szanty (22).
Kumulację furanolabdanów, ich przemiany i właściwości, opisano w piśmiennictwie (35-37). W grupie steroli występujących w zielu szanty wyróżniamy fitosterole np.: beta-sitosterol, zaś wśród triterpenów: kwas ursolowy w ilości 0,1%. Szczególnie często związek ten występuje w rodzinach: Rosaceae i Lamiaceae. Ma on właściwości cytotoksyczne, przeciwzapalne i zmniejszające stężenie cholesterolu we krwi (36-38). Strukturę tego kwasu przedstawia rycina 4. Właściwości steroli i triterpenów opisano we wcześniejszej pracy (39).

Ryc. 4. Struktura kwasu ursolowego.
Olejek eteryczny wydzielany jest intensywnie w okresie kwitnienia. W gatunku Marrubium vulgare występuje on w ilości ok. 0,05% (22, 23).
Badania przeprowadzone nad składem olejku wykazały, że głównym składnikiem są seskwiterpeny, które stanowią 82% całkowitej ilości olejku. Wśród nich występują: b-bisabolen 25,4%, b-kariofilen 5,6%, germakren D 9,7%, b-farnezen. Ponadto stwierdzono we frakcji monoterpenowej, która wynosi ok. 8,8%, obecność: b-pinenu, p-cymenu i limonenu (40-44).
W surowcu stwierdzono występowanie związków fenolowych i polifenolowych w częściach nadziemnych i korzeniu, wśród nich można wymienić fenylopropanoidy. Są to estry kwasu kawowego i ferulowego z cukrami związanymi glikozydowo z 3,4-dihydroksyfenyloetanolem. W gatunku Marrubium vulgare występują cztery pochodne glikozydowe: akteozyd, forsytiozyd B, arenariozyd, ballotetrozyd i pochodna nieglikozydowa – kwas (+) (E)-kawoilo-L-jabłkowy, a ich struktury podaje rycina 5 (45).
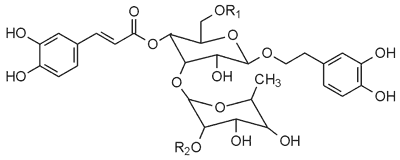
| Nr związku | Nazwa związku | R1 | R2 |
| 1 | Akteozyd | H | H |
| 2 | Forsytozyd | b-D-epioza | H |
| 3 | Arenariozyd | b-D-ksyloza | H |
| 4 | Ballotetrozyd | b-D-apioza | a-L-akabinoza |
Ryc. 5. Struktury pochodnych glikozydowych występujących w zielu szanty.
Właściwości farmakologiczne i zastosowanie
Zainteresowanie szantą jako surowcem leczniczym wzięło swój początek z medycyny tradycyjnej, w której wykorzystywano ziele. Surowiec ten powszechnie stosowano w dolegliwościach żołądkowo-jelitowych, utracie apetytu, jako środek żółciopędny i żółciotwórczy (21, 23, 28, 30, 46, 47, 69, 70, 72).
Od tysięcy lat szanta była uważana za najlepszy lek łagodzący kaszel i wszystkie problemy związane z drogami oddechowymi. Egipcjanie uważali ją za doskonały lek wykrztuśny (48). Ekstrakty z ziela używane były w leczeniu kokluszu oraz zewnętrznie na rany spowodowane ugryzieniem węży (49, 50). Grecki lekarz Hipokrates oraz inni lekarze na przestrzeni wieków również cenili ziele tej rośliny, jako lek na wiele chorób, takich jak gruźlica, zapalenie oskrzeli, gardła i zatok, tyfus i żółtaczka (51), a także w leczeniu niepłodności u kobiet, braku menstruacji oraz jako środek zwiększający laktację (48). Mieszkańcy Meksyku stosowali herbaty z ziela szanty w leczeniu infekcji dróg oddechowych, chorób serca, gorączki, bólów głowy i w bólach menstruacyjnych (52). Ekstrakty wodne z liści obniżały nieznacznie poziom glukozy, a także triglicerydów i cholesterolu, przynosiły ulgę w bólach i działały rozkurczająco (53, 54). Napary z ziela szanty używane są także jako środek napotny usuwający gorączkę, działają również lekko diuretycznie, zaś napar z liści w postaci aerozolu zwalcza gąsienice „miernikowca” (21, 46, 55).
Jak już wspomniano, główną grupą związków, występującą w zielu szanty, są diterpeny, pochodne furanolabdanu, które działają wykrztuśnie wskutek pobudzenia sekrecji błon śluzowych górnych dróg oddechowych oraz w pewnym stopniu dzięki właściwościom rozkurczającym obejmującym oskrzela (47, 54-56). Działanie wykrztuśne i rozkurczające potęgowane jest obecnością olejków eterycznych (57). Napary z ziela szanty stosuje się jako lek wykrztuśny w astmie oskrzelowej i schorzeniach dróg oddechowych, tj. nieżycie gardła i oskrzeli. Właściwości wykrztuśne, potwierdzone w badaniach na zwierzętach, były zbliżone do działania korzenia wymiotnicy ( Radix Ipecacuanhae) (54). Przetwory z ziela szanty wchodzą m.in. w skład syropów na kaszel dla dzieci i dorosłych, mieszanek ziołowych, cukierków do ssania Ricola (29).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. http://pl.wikipedia.org./wiki/Szanta_zwyczajna. (Tekst z dnia 23.02.2007). 2. http://dieta-metaboliczna.com/szantazwyczajna%20.htm (tekst z dnia 23.02.2007). 3. http://health.enotes.com/alternative-medicine-encyclopedia/horehound. (Tekst z dnia 23.02.2007). 4. Bremness L.: Wielka encyklopedia ziół. Wiedza i życie, Warszawa 1991, 92. 5. Andersen-Parrado P.: Horehound: this ´old dog´ knows some neat tricks. 1997. http://www.findarticles.comp/p/articles/mi-mOFKA/is_n4_v59/ai_19273653. (Tekst z dnia 23.02.2007). 6. Podbielkowski Z.: Słownik roślin użytkowych. PWRiL, Warszawa 1985, 349. 7. http://en.wikipedia.org/wiki/marrubium. (Tekst z dnia 23.02.2007). 8. Poprzędzki W.: Ziołolecznictwo, SPAR, Warszawa 1989, 175. 9. Seitz P.: Apteka ogrodowa. Multico. Warszawa 1993, 51. 10. Mayer J.G. i wsp.: Zioła Ojców Benedyktynów. Świat Książki, Warszawa 2004, 129. 11. Lewkowicz-Mosiej T.: Domowe porady ziołowe. Świat Książki, Warszawa 2006, 232. 12. Podlech D.: Rośliny lecznicze. Muza SA., Warszawa 1997, 178. 13. Schaffner W.: Rośliny lecznicze, chemizm, działanie, zastosowanie. Multico, Warszawa 1996, 162. 14. Sarwa A.J.: Tajemnice czterystu ziół. Karat, Tarnów 1995, 408. 15. Gruenwald J.: PDR for Herbal Medicines. Medical Economics, Company Montvale, New Jersey 2000, 401. 16. Broda B., Mowszowicz J.: Przewodnik do oznaczania roślin leczniczych, trujących i użytkowych. PZWL, Warszawa 1985, 580. 17. Hoffmann D.: Natura i zdrowie. Zioła, Pascal, London 1996, 112. 18. Formanowiczowa H., Kozłowski J.: Nasiona gatunków z rodziny wargowych ( Labiatae) - szanta zwyczajna ( Marrubium vulgare L.). Herba Pol. 1966, 12, 123. 19. Nowiński M.: Dzieje upraw roślin leczniczych. PWRiL, Warszawa 1980, 146. 20. Rumińska A.(red): Poradnik plantatora ziół. PWRiL, Warszawa 1991, 376. 21. Rumińska A., Ożarowski A.(red): Leksykon roślin leczniczych. PWRiL, Warszawa 1990, 481. 22. Bruneton J.: Pharmacognosy. Phytohemistry. Medicinal Plants, Lavoisier Londres, Paris, New York 1999, 650. 23. Newal C.A. i wsp.: A Guide for Healthcare Professionals. Herbal Medicine, The Pharmaceutical Press, London, 1996, 165. 24. Martin-Nizard F. i wsp.: Natural phenylopropanoids inhibit lipoprotein-induced endothelin-1 secretion by endothelial cells. J. Pharm. Pharmacol. 2004, 56, 1607. 25. Roth L. i wsp.: Giftpflanzen Pflanzengifte. Nikol. Hamburg 1994, 487. 26. Martin-Nizard F. i wsp.: Natural phenylopropanoids protect endothelial cells against oxidized LDL-induced cytotoxity. Planta Med. 2003, 69, 207. 27. Kowalewski Z., Matławska J.: Flavonoid compounds in the herb of Marrubium vulgare L. Herba Pol. 1978, 24, 183. 28. Ożarowski A.: Ziołolecznictwo - poradnik dla lekarzy. PZWL, Warszawa 1982, 179. 29. Wawrzyniak E.: Leczenie ziołami - kompendium fitoterapii. I.W.Z.Z., Warszawa 1992, 464. 30. Borkowski B.(red).: Rośliny lecznicze w fitoterapii. Inst. Rośl. i Przetw. Ziel., Poznań, 1994, 396. 31. Kączkowski J.: Biochemia roślin. PWN, Warszawa 1982, T.1, 349, 1985; T.2, 114. 32. Siemion J.Z.: Biostereochemia. PWN, Warszawa 1985, 311. 33. Kopcewicz J., Lewak S. (red): Fizjologia roślin. PWN, Warszawa 2005, 365. 34. Rodrigues C.A. i wsp.: An improve extraction of marrubium from Marrubium vulgare. Chromatographia. 1998, 47, 449. 35. Knoss W., Zapp J.: Acumulation of furanic labdane diterpens in Marrubium vulgare and Leonurus cardiaca. Planta Med. 1998, 64, 357. 36. Kohlmünzer S.: Farmakognozja. PZWL, Warszawa 2000, 309, 341. 37. Strzelecka H., Kowalski J.: Encyklopedia zielarstwa i ziołolecznictwa. PWN, Warszawa 2000, 645. 38. Różański H., 2007. Naturalne substancje anaboliczne. http://luskiewnik.strefa.pl/fitosterole/sterole/pages/p6.htm (tekst z dnia, 23.02.2007). 39. Wolski i wsp.: Rzepień pospolity ( Xanthium strumarium L.) - analiza steroli i triterpenów. Postępy Fitoterapii 2006, 7, 170. 40. Khanavi M. i wsp.: Chemical composition of essential oils of Marrubium parviflorum Fish.& C. A. Mey and Marrubium vulgare L. from Iran. Flav. Fragr. J. 2005, 20, 324. 41. Baher Nik Z. i wsp.: Essential oil of Marrubium cuneatum Russell and its secretory elements. Flav. Fragr. J. 2004, 19, 233. 42. Nagy M., Svajdlenka E.: Comparison of essential oils from Marrubium vulagre L. and M. peregrinum L. J. Essent. Oil Res. 1998, 10, 585. 43. Bal Y. i wsp.: Composition of essential oil of Marrubium parviflorum Fisch. et Mey. ssp. oligodon (Boiss.) Seybold. J. Essent. Oil Res. 1999, 11, 300. 44. Lazari D.M. i wsp.: Essential oils of Marrubium velutinum Sm. and Marrubium peregrinum L., growing wild in Greece. Flav. Fragr. J. 1999, 14, 290. 45. Sahpaz S. i wsp.: Isolation and pharmacological activity of phenylpropanoid esters from Marrubium vulgare. J Ethnopharmacol. 2002, 79, 389. 46. Bown D.: Wielka encyklopedia ziół, Muza S.A., Warszawa 1999, 308. 47. Ożarowski A. i wsp.: Leki roślinne - informator. Herbapol, Warszawa, 1978, 203. 48. http://www.nml.nih.gov/medlineplus/druginfo/natural/patient-whithorehound.html., (tekst z dnia, 23.02.2007). 49. Karnik C.R.: Pharmacological Standards of Herbal Plants. 1994, Vol. 1, 235; Vol. 2, 140. 50. Nadkarni K.M.: Indian Materia Medica. Popular Prakashan Put. Ltd., Bombay 1976, 771. 51. http://www.herbaflos.com/baza_ziolo.php?id=221, (tekst z dnia, 23.02.2007). 52. VanderJagt T.J. i wsp.: Comparison of the total antioxidant content of 30 widely used medicinal plants of New Mexico. Life Sci. 2002, 70, 1035. 53. Herrera-Arellano A. i wsp.: Clinical trial of Cecropia obtusifolia and Marrubium vulgare leaf extracts on blood glucose and serum lipids in type 2 diabetics. J. Phytomed. 2004, 11, 561. 54. Schlemper V. i wsp.: Antispasmodic effects of hydroalcoholic extract of Marrubium vulgare on isolated tissues. Phytomed. 1996, 3, 211. 55. Ożarowski A., Jaroniewski W.: Rośliny lecznicze i ich zastosowanie, IWZZ, Warszawa 1987, 365. 56. Wagner H., Bladt S.: Plant Drug Analysis, Springer-Verlag, Berlin-Heidelberg-New York 2001, 92. 57. Saleh M.M., Glombitza K.W.: Volatile oil of Marrubium vulgare and its anti-schistosomal activity. Planta Med., 1989, 55, 105. 58. Matławska I. (red.): Farmakognozja. AM, Poznań 2005, 214. 59. El Bardai S. i wsp.: Comparative study of the antihypertensive activity of Marrubium vulgare and of the dihydropyridine calcium antagonist amlodipine in spontaneously hypertensive rat. Clin. Exp. Hypertens. 2004, 26, 465. 60. El Bardai S. i wsp.: Pharmacological evidence of hypotensive activity of Marrubium vulgare and Foeniculum vulgare in spontaneously hypertensive rat. Clin. Exp. Hypertens., 2001, 23, 329. 61. El Bardai S. i wsp.: Characterisation of marrubenol, a diterpene extracted from Marrubium vulgare, as an L-type calcium channel blocker. Br. J. Pharmacol. 2003, 140, 1211. 62. El Bardai S. i wsp.: The vasorelaxant activity of marrubenol and marrubin from Marrubium vulgare. Planta Med. 2003, 69, 75. 63. Novaes A.P. i wsp.: Preliminary evaluation of the hypoglycemic effect of some Brazilian medicinal plants. Therapie. 2001, 56, 427. 64. Roman R.R. i wsp.: Hypoglycemic effect of plants used in Mexico as antidiabetics. Arch. Med. Res. 1992, 23, 59. 65. http://www.centerchem.com/PDFs/Marrubium%20AO%20Product%20Literature%205704.pdf, (tekst z dnia, 23.02.2007). 66. De Souza M.M. i wsp.: Analgesic profile of hydroalkoholic extract obtained from Marrubium vulgare. Phytomedicine 1998, 5, 103. 67. Meyre-Silva C. i wsp.: Analgesic potential of marrubin derivatives, a bioactive diterpene present in Marrubium vulgare ( Lamiaceae). Il Farmaco. 2005, 60, 321. 68. De Jesus R.A. i wsp.: Analysis of antinociceptive properties of marrubin isolated from Marrubium vulgare. Phytom. 2000, 7, 111. 69. Macku J., Krejca J.: Atlas roślin leczniczych, Ossolineum, Wrocław-Warszawa 1989, 286. 70. Biegański J.: Ziołolecznictwo, (Wyd.) Jemiołkowski i Evert Sp. z o.o., Łódź 1949, 130. 71. Ożarowski A.: Wątroba - zapobieganie chorobom i leczenie sposobami naturalnymi. Portal Farmaceutyczno-Medyczny Pl S.A., Warszawa 2006, 45. 72. Kowalewski Z.: (red.) Farmakognozja - leki roślinne. AM Poznań 1997, 141. 73. Wichtl M.: (red.) Herbal Drugs and Phytopharmaceuticals. Medpharm, Boca Raton, Am. Arbor, London, Tokyo 1994, 317.





