© Borgis - Postępy Fitoterapii 3-4/2005, s. 71-79
Justyna Ostrowska, Elżbieta Skrzydlewska
Aktywność biologiczna flawonoidów
The biological activity of flavonoids
Zakład Chemii Nieorganicznej i Analitycznej Akademii Medycznej w Białymstoku
Kierownik Zakładu: prof. dr hab. Elżbieta Skrzydlewska
Summary
Flavonoids are benzo-g-pirone compounds occuring in plants – in fruit and vagetables in particular – as well as in tea. Due to polyphenol structure of its particle, these compounds may protect cells against the toxic action of reactive oxygen species (ROS). Their antioxidative properties are connected with their ability to scavenge free radicals and the other oxidants, to chelate cupper and iron ions, to inhibit prooxidative enzymes activity, to induce enzymatic antioxidants and to protect non-enzymatic ones (preventing oxidation of small molecular antioxidant – a-tocophetol, ascorbic acid). Therefore flavonoids reveal properties to protect biological membranes against ROS action through prevention enzymatic and non-enzymatic lipid peroxidation and direct interaction with biological membrane. In addition to their proved antioxidative actions, flavonoids can influence the intensification of ROS generation in the presence of transitions metal ions, revealing prooxidative action in this way. Flavonoids also modify metabolism of xenobiotics, including carcinogens, through results of studies dealing with this problem are unonimous. Due to modification of cellular redox status as well as xenobiotics metabolism and inhibition of kinase activity, flavonoids slow down cancerogenic process.

Flawonoidy (nazywane też związkami flawonowymi) to duża grupa (około 7000) związków chemicznych, powszechnie występujących w roślinach. Ich obecność stwierdzono m.in. w owocach (szczególnie cytrusowych), warzywach (np. pomidorach, brokułach, papryce, sałacie), roślinach strączkowych, a także w licznych roślinach leczniczych. Dużą ilość flawonoidów zawierają też takie napoje jak herbata, zwłaszcza zielona i wino, głównie czerowne (1, 2). Związki te często są barwne i odpowiadają m.in. za czerwone i granatowe zabarwienie owoców jagodowych oraz pomarańczowe i żółte – owoców cytrusowych. Flawonoidy odgrywają znaczącą rolę w fizjologii roślin, wykazując działanie hormonów roślinnych i regulatorów wzrostu, przenośników energii w systemach fotosyntezy, inhibitorów i prekursorów enzymatycznych, a także barwników (1). Ponadto chronią komórki roślinne przed szkodliwym działaniem słońca, grzybów i owadów (3). Wprowadzone do organizmu człowieka lub zwierząt mogą pełnić podobną rolę jak witaminy. W związku z powyższym wiele roślin, w których występują flawonoidy (np. Ginkgo biloba, Camelia sinensis), jest obecnie wszechstronnie wykorzystywanych w profilaktyce i leczeniu rozmaitych schorzeń (4, 5).
Budowa i metabolizm flawonoidów
Podstawową strukturę cząsteczki flawonoidów stanowią dwa pierścienie benzenowe (A i B), pomiędzy którymi znajduje się heterocykliczny pierścień piranu lub pironu (C) (ryc. 1). Ogromna różnorodność flawonoidów wynika z faktu, że atomy węgla pierścieni A, B i C mogą ulegać hydroksylacji, metoksylacji oraz glikozydacji za pomocą mono- lub oligosacharydów, a także acylacji w różnych pozycjach (6). Stwierdzono, że na przykład kwercetyna (3,5,7,3´,4´-pentahydroksyflawon) występuje w materiale roślinnym w postaci ponad 140 różnych strukturalnie pochodnych (7).
W cząsteczkach większości naturalnych flawonoidów pierścień A zawiera dwie grupy hydroksylowe w pozycji 5 i 7, a pierścień B grupę hydroksylową w pozycji 3 (zwaną grupą katecholową). W związku z tym związki te należą do polifenoli. Flawonoidy mogą występować w dwóch postaciach izomerycznych – flawonoidowej i izoflawonoidowej (ryc. 1 a, b). W cząsteczce flawonoidów przy atomie węgla w pozycji 2 pierścienia heterocyklicznego, znajduje się zwykle grupa hydroksylowa lub podstawnik fenylowy, w izoflawonoidach są one usytuowane przy atomie węgla w pozycji 3. W zależności od obecności lub nieobecności grupy karbonylowej w pozycji 4 pierścienia C, obecności lub nieobecności wiązania podwójnego pomiędzy atomami węgla w pozycji 2 i 3 pierścienia C oraz liczby grup hydroksylowych, wśród flawonoidów można wyróżnić flawony, flawanony, flawan-3-ole (zwane inaczej katechinami), flawon-3-ole oraz chalkony (ryc. 1, tab. 1).
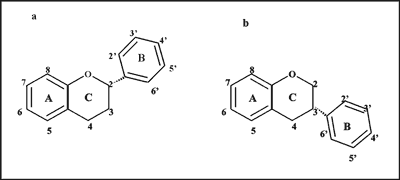
Ryc. 1. Podstawowe struktury cząsteczek flawonoidów: a – postać flawonoidowa, b – postać izoflawonoidowa; gl – reszta glukozowa; ru – reszta rutynozowa, me – grupa metylowa
Tabela 1. Klasy i budowa powszechnie występujących flawonoidów.
| Klasa | Flawonoidy | Pozycja substytucji |
| 3 | 5 | 7 | 3´ | 4´ | 5´ |
| Flawan-3-ole | (+) Katechina | OH | OH | OH | OH | OH | H |
| Antycyjanidyny | Cyjanidyna
Pelargonidyna | OH
OH | OH
OH | OH
OH | OH
OH | OH
H | H
H |
| Flawony | Apigenina
Diosmina
Luteolina | H
H
H | OH
OH
OH | OH
Oru
OH | H
OH
OH | OH
Ome
OH | H
H
H |
| Flawanony | Naryngenina
Naryngina
Hesperetyna
Hesperedyna | H
H
H
H | OH
OH
OH
OH | OH
Oru
OH
Oru | H
H
OH
OH | OH
OH
Ome
Ome | H
H
H
H |
| Chalkony | Floretyna
Aflorydzyna | OH
Ogl | OH
H | OH
OH | H
H | H
H | OH
OH |
| Flawon-3-ole | Kwercetyna
Kemferol
Myrycetyna
Fisteina
Moryna | OH
OH
OH
OH
OH | OH
OH
OH
H
OH | OH
OH
OH
OH
OH | H
H
OH
OH
H | OH
OH
OH
OH
OH | H
H
OH
H
H |
Ze względu na obecność w cząsteczce znacznej liczby grup hydroksylowych, flawonoidy wykazują właściwości antyoksydacyjne. Siła ich antyoksydacyjnego działania zależy od liczby i położenia grup hydroksylowych (6). Zdolności antyoksydacyjne związków obdarzonych większą liczbą grup hydroksylowych są silniejsze. Wykazano, że myrycetyna (mająca 6 grup hydroksylowych) wykazuje większe zdolności antyoksydacyjne niż np. kemferol – mający 4 grupy hydroksylowe (8). Spośród obecnych w cząsteczce grup hydroksylowych szczególnie istotna jest obecność dwóch grup w pierścieniu B w pozycji orto (tab. 2) (9). Mimo, iż wykazano, że cząsteczka zawierająca grupy hydroksylowe w położeniu para wykazuje wyższą aktywność antyoksydacyjną niż struktura zawierająca ugrupowanie orto, jednak struktura taka występuje tylko w niektórych, rzadko spotykanych flawonoidach (6). Obecność grup hydroksylowych w położeniu meta nie wpływa natomiast na właściwości antyoksydacyjne związku. Obecność dodatkowo trzeciej grupy hydroksylowej w położeniu 5´ nasila zdolności antyoksydacyjne flawonoidów (9). Hydroksylacja pierścieni benzenowych w pozycji 5 i 7 może podwyższać właściwości antyoksydacyjne flawonoidu, co wykazano porównując zdolności antyoksydacyjne kwercetyny, flawonoidu, który ma grupy hydroksylowe w tych pozycjach, z właściwościami antyoksydacyjnymi 3,3´,4´-trihydroksyflawanonu (10). Izoflawony, izoflawanony i izoflawany, mające w swej cząsteczce ugrupowanie 6,7,4´-trihydroksy- oraz 6,7-dihydroksylowe, wykazują bardzo wysoką aktywność antyoksydacyjną, zwłaszcza w fazie lipidowej. W badaniach in vitro wykazano, że obecność grupy metoksylowej w cząsteczce flawonoidu, ze względu na jej znaczne rozmiary przestrzenne oraz zablokowanie grupy hydroksylowej, wpływa na obniżenie właściwości antyoksydacyjnych związku. Istnieją jednak dane wykazujące, że metylacja grupy hydroksylowej atomu węgla C7 w izoflawonoidach nie obniża zdolności do hamowania procesu peroksydacji (11-13).
Tabela 2. Ugrupowania obecne we flawonoidach, które nadają im największą aktywność antyoksydacyjną.
| Ugrupowanie aktywne | Działanie antyoksydacyjne |
| Grupa (o-dihydroksylowa) katecholowa w pierścieniu B | wykazuje dużą zdolność wychwytywania rodników tlenowych, jednak nie przyczynia się przez swe reakcje do ochrony przed peroksydacją lipidów w mitochondriach mózgu szczura |
| Ugrupowanie pirogalolowe (trihydroksylowe) w pierścieniu B | nadaje cząsteczce wyższą aktywność antyoksydacyjną. Podwójne wiązanie pomiędzy węglem C2 i C3 w pierścieniu C przyczynia się do wzrostu zdolności wychwytywania rodników, ponieważ po reakcji z rodnikiem powstaje stabilny rodnik fenoksylowy |
| Ugrupowanie 4-okso (grupa ketonowa, podwójne wiązanie pomiędzy węglem C4 pierścienia C i atomem tlenu) | szczególnie w obecności podwójnego wiązania pomiędzy C2 i C3, wzrasta zdolność wychwytywania rodników dzięki zdelokalizowanym elektronom pierścienia B |
| Grupa hydroksylowa przy węglu C3 pierścienia C | wykazuje szczególnie silne zdolności wychwytywania rodników spotęgowane obecnością podwójnego wiązania pomiędzy węglem C2 i C3 oraz grupowania 4-okso (jest to najbardziej korzystne połączenie dla nadania cząsteczce zdolności wychwytywania rodników) |
| Grupy hydroksylowe przy węglu C5 i C7 | mogą także zwiększać zdolności do wychwytywania wolnych rodników w wielu reakcjach wolnorodnikowych. |
W roślinach flawonoidy występują najczęściej w postaci sacharydów, takich jak glikozydy, ramnozydy, glukoramnozydy, galaktozydy i arabinozydy (14). Reszta sacharydowa przyłączona jest zazwyczaj do atomu węgla w pozycji 3 lub 7. W badaniach in vitro stwierdzono, że ze względu na zablokowanie przez resztę cukrową grup hydroksylowych, glikozydy wykazują słabsze właściwości antyoksydacyjne w porównaniu do odpowiednich aglikonów (14). Wykazano ponadto, że różnice we właściwościach antyoksydacyjnych zależą również od rodzaju reszty sacharydowej obecnej w cząsteczce. Stwierdzono, że glikozydacja grupy hydroksylowej przy węglu w pozycji 3 cząsteczką monosacharydu nie obniża zdolności antyoksydacyjnych flawonoidów, natomiast aktywność antyoksydacyjna jest istotnie niższa w przypadku glikozydacji resztą disacharydową (14).
Jednak badania przeprowadzone w warunkach in vivo wskazują na brak zależności pomiędzy obecnością grupy metoksylowej lub reszty węglowodanowej w cząsteczkach flawonoidów, a ich działaniem antyoksydacyjnym w organizmie zwierząt (15). Przypuszcza się, że spowodowane jest to faktem, iż w jelitach obecne są bakterie zawierające glikozydazy, enzymy katalizujące reakcje hydrolizy reszt cukrowych z glikozydów flawonoidów (15). Powstałe w wyniku ich działania aglikony ulegają następnie metabolizmowi w sposób właściwy dla flawonoidów. Wprowadzone do przewodu pokarmowego, pod wpływem transferazy urydyno-5´-difosfoglukurozynylowej zawartej w śluzówce jelita, tworzą koniugaty z kwasem glukuronowym i w tej formie są wchłaniane przez śluzówkę jelita, przy czym wykazano, że np. b-glukozyd kwercetyny jest wchłaniany łatwiej niż w formie aglikonu (16). Istnieją jednak doniesienia wskazujące na brak wchłaniania aglikonów, czy też ich metabolitów z układu trawiennego do krwiobiegu (17). Koniugaty flawonoidów po wchłonięciu przez żyłę wrotną przenoszone są do wątroby, gdzie pod wpływem fenolosulfotransferazy tworzą koniugaty z jonami siarczanowymi (18). Pod wpływem O-metylotransferazy katecholowej, w wątrobie i nerce, flawonoidy ulegają metylacji i w takiej postaci rozprowadzane są z krwiobiegiem po całym organizmie oraz wydalane są do żółci i moczu (18).
Stwierdzono, że we krwi katechiny występują głównie w postaci koniugatów, a istnienie glukuronianów i siarczanów wykazano w moczu szczura i człowieka (18). Nie wszystkie jednak flawonoidy wydalane są do moczu – np. kwercetyna i jej koniugaty, po jej przyjęciu doustnym zostały zidentyfikowane tylko w osoczu krwi (19). Oprócz tworzenia koniugatów flawonoidy ulegają w organizmie także innym przemianom, np. większość galusanu epigalokatechiny zanim zostanie wchłonięta z jelit, ulega przemianom pod wpływem esterazy katecholowej bakterii jelitowych, w których pierwszym etapem jest hydroliza cząsteczki galusanu epigalokatechiny z odłączeniem reszty kwasu galusowego (20). Powstająca epigalokatechina pod wpływem mikroflory bakteryjnej ulega degradacji z utworzeniem związków typu hydroksyfenylowalerolaktonu (20). Powstałe metabolity, podobnie jak niezmienione flawonoidy, ulegają następnie glukuronidacji, sulfatacji i metylacji, a produkty ich metabolizmu – głównie glukuroniany i siarczany, zostały zidentyfikowane we krwi i moczu zarówno ludzi, jak i zwierząt (20). Wykazano, że powstające w powyższych procesach metabolity mają niezmienioną strukturę ugrupowań odpowiedzialnych za aktywność antyoksydacyjną tych związków i wykazują właściwości antyoksydacyjne podobne do właściwości niezmienionych flawonoidów.
Antyoksydacyjne właściwości flawonoidów
Podczas oddziaływania na organizm różnych drobnoustrojów oraz podczas rozwoju zakażenia dochodzi do aktywacji fagocytów, wytwarzających duże ilości anionorodnika ponadtlenkowego, który podczas dalszych przemian stanowi źródło innych reaktywnych form tlenu (RFT) (9). Powstające RFT mogą być przyczyną uszkodzenia składników komórek, w wyniku czego może dochodzić do wytworzenia się stanów zapalnych i licznych uszkodzeń tkankowych.
Dzięki strukturze polifenolowej flawonoidy wykazują silne właściwości antyoksydacyjne. W licznych eksperymentach wykazano, że mogą one charakteryzować się następującymi właściwościami:
1) hamowaniem powstawania RFT (21),
2) chelatowaniem oraz redukowaniem jonów metali przejściowych (22),
3) wychwytywaniem RFT (anionorodnika ponadtlenkowego) (22, 23), rodników nadtlenowych (24), hydroksylowych (10, 25) i wygaszaniem tlenu singletowego (24),
4) przerywaniem kaskady reakcji wolnorodnikowych (poprzez wychwyt rodników lipidowych oraz alkoksylowych (10, 26)) prowadzących do peroksydacji lipidów,
5) ochranianiem antyoksydantów – askorbinianu w cytozolu (działanie ochronne jest wzajemne gdyż askorbinian może również wpływać ochronnie na flawonoidy narażone na uszkodzenia oksydacyjne) oraz tokoferoli w błonach biologicznych.
Flawonoidy zapobiegają tworzeniu się rodników tlenowych poprzez hamowanie aktywności enzymów biorących udział w ich wytwarzaniu (10, 25, 27). Wykazano, że flawonoidy obniżają aktywność oksydazy ksantynowej, enzymu katalizującego powstawanie anionorodnika ponadtlenkowego, przy czym ich sposób działania jest różny (28). Stwierdzono, że 7-hydroksyflawony hamują aktywność tego enzymu kompetycyjnie, natomiast 3´,4´- lub 3´,4´,5´-hydroksyflawony są inhibitorami niekompetycyjnymi (29). Flawonoidy obniżają także aktywność uczestniczącej w generowaniu anionorodnika ponadtlenkowego błonowej oksydazy NADPH (30). Również aktywność mieloperoksydazy, enzymu katalizującego wytwarzanie anionu tlenochlorowego, jest obniżana przez flawonoidy (31). Wykazano, że działanie flawonoidów może prowadzić nawet do całkowitej inaktywacji tego enzymu (10). Flawonoidy zapobiegają powstawaniu RFT również poprzez chelatowanie jonów metali przejściowych (głównie miedzi i żelaza), będących katalizatorami reakcji prowadzących do powstania RFT, głównie rodnika hydroksylowego (32, 33).
Antyoksydacyjne właściwości flawonoidów przejawiają się również ich zdolnością do unieczynniania już wytworzonych rodników tlenowych. Do rodników, które najłatwiej są wychwytywane przez flawonoidy, zaliczyć możemy anionorodnik ponadtlenkowy, rodnik hydroksylowy, tlen singletowy oraz rodniki lipidowe (25). Szczególnie efektywna jest reakcja flawonoidów z rodnikiem hydroksylowym, który łatwo reaguje ze związkami aromatycznymi. Flawanole, a przede wszystkim katechiny izolowane z zielonej herbaty, wykazują zdolność do wychwytywania nadtlenku wodoru i anionorodnika ponadtlenkowego, generowanego w układzie ksantyna-oksydaza ksantynowa (10). Wykazano, że w wyniku wychwytywania anionorodnika ponadtlenkowego i tlenu singletowego flawonoidy ulegają przekształceniu w stabilne produkty (34-36), natomiast wychwyt innych rodników prowadzi do powstania produktów niestabilnych, ulegających dalszym reakcjom rodnikowym (37).
Właściwości antyoksydacyjne flawonoidów potwierdzono także w badanich in vivo. Stwierdzono, że spożywanie flawonoidów wraz z dietą przyczynia się do wzrostu zdolności antyoksydacyjnych organizmu. Przejawia się to przede wszystkim wzrostem aktywności enzymów antyoksydacyjnych (dysmutazy ponadtlenkowej, peroksydazy glutationowej i katalazy), obserwowanym głównie w wątrobie, jelicie cienkim i płucach oraz wzrostem stężenia antyoksydantów niskocząsteczkowych (askorbinianu oraz a-tokoferolu) (10).
Przyczyniając się do obniżenia poziomu RFT, flawonoidy zmniejszają ich wpływ na składniki komórki, takie jak lipidy, białka i kwasy nukleinowe. Stwierdzono, że flawonoidy wykazują zdolność do hamowania peroksydacji lipidów zarówno w warunkach in vitro, jak i w warunkach in vivo, w licznych komórkach i organellach komórkowych – w mitochondriach, mikrosomach (38, 39). Wykazano że lokalizują się one w warstwie błonowej pomiędzy dwuwarstwą lipidową i fazą wodną (40). Modelują one zarówno nieenzymatyczną, jak i enzymatyczną peroksydację lipidów. Nieenzymatyczną peroksydację flawonoidy mogą hamować na etapie:
– inicjacji – poprzez wychwyt rodnika powodującego proces peroksydacji:
FL-OH + OH? (r) H2O + FL-O?,
– propagacji – poprzez wychwytanie rodnika nadtlenkowego lipidów (LOO?) przez cząsteczkę flawonoidu – FL-OH):
LOO? + FL-OH (r) LOOH + FL-O?,
– terminacji – poprzez wychwytywanie rodników nadtlenkowych lipidów (LOO?), lipidowych (L?) oraz alkoksylowych (LO?), które powstają w wyniku reinicjacji procesu peroksydacji lipidów indukowanego jonami metali:
LOO?/L?/LO? + FL-OH (r) LOOH/LH/LOH + FL-O?,
FL-OH – flawonoid,
FL-O? – rodnik fenoksylowy.
W badaniach in vitro wykazano, że sylimaryna (3-hydroksyflawon) zapobiega peroksydacji lipidów w mitochondriach i mikrosomach hepatocytów szczura, indukowanej w układzie Fe2+-askorbinian oraz NADPH-Fe3+-ADP. Stwierdzono jednocześnie, że flawonoid ten wykazuje aktywność antyoksydacyjną do ok. 10 razy wyższą niż b-tokoferol (10). Liczne izoflawony i ich zredukowane pochodne, zwłaszcza mające w swej cząsteczce ugrupowanie 4-metoksylowe, również hamują peroksydację lipidów w mikrosomach hepatocytów szczura (41). Związki te wykazują znacznie wyższą zdolność do hamowania peroksydacji niż a-tokoferol. Wykazano ponadto, że izoflawony mające strukturę 6,7-dihydroksylową są około 80 razy silniejszymi inhibitorami peroksydacji lipidów w porównaniu z a-tokoferolem (10).
Efektywność działania flawonoidów zależy także od sposobu indukcji procesu peroksydacji. Wogonina w około 90% hamuje w mikrosomach hepatocytów szczura peroksydację lipidów indukowaną w układzie ADP-NADPH, podczas gdy tylko w 19% hamuje peroksydację indukowaną w układzie ADP-askorbinian (42). Wykazano, że myrycetyna i kwercetyna hamują peroksydację lipidów indukowaną jonami żelaza (III) w układzie Fe3+-askorbinian, Fe3+-EDTA lub Fe3+-ADP/NADPH (43), przy czym działanie flawonoidów jest najbardziej efektywne w przypadku stymulowania peroksydacji w układzie Fe3+-askorbinian. Uważa się, że flawonoidy te wykazują zdolność do wychwytywania głównie rodników nadtlenkowych i alkoksylowych (43).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Timberlake C.F., Henry B.S.: Plant pigments as natural foods colors. Endeavour 1986, 10, 31. 2.Brouillard R., Cheminant A.: Flavonoids and plant color, in Plant flavonoids in biology and medicine: biochemical, cellular and medicinal properties (Cody V., Middleton E.I. Harborne J.B. eds.). Alan R. Liss Inc., New York 1988, 93. 3.Smith D.A., Banks S.W.: Formation and biological properties of isoflavonoid phytoalexins in Plant flavonoids in biology and medicine: biochemical, cellular and medicinal properties (Cody V., Middleton E.I., Harborne J.B eds.). Alan R. Liss Inc., New York 1988, 113. 4.Carroll K.K., et al.: Anticancer properties of flavonoids with emphasis on citrus flavonoids, in Flavonoids in health and disease (Rice-Evans C., Packer R. eds.). Marcel Dekker Inc., New York 1998, 437. 5.Hertog M.G.L., et al.: Dietary antioxidanst flavonoids and risk of coronary heart disease. Lancet 1998, 342, 10071. 6.Rice-Evans C.A., et al.: Structure-antioxidant activity relationships of flavonoids and phenolic acids, Free Radic. Biol. Med. 1996, 20, 933. 7.Manach C., et al.: Bioavability, metabolism and physiological impact of 4-oxoflavonoids. Nutr. Res. 1996, 16, 517. 8.Acker S.A., et al.: Influence of iron chelation on the antioxidant activity of flavonoids. Biochem. Pharmacol. 1998, 56, 935. 9.Ratty A.K., Das N.P.: Effects of flavonoids on nonenzymatic lipid peroxidation: strucuture, activity relationship. Biochem. Met. Metab. Biol. 1988, 39, 69. 10.Middleton E,. et al.: The effects of plant flavonoids on mammalian cells: implications for inflammation, heart disease and cancer. Pharmacol. Rev. 2000, 52, 673. 11.Feldman E.B.: The scientific evidence for a beneficial health relationship between walnuts and coronary heart disease. J. Nutr. 2002, 132, 1062. 12.Parejo I., et al.: Investigation of Lepechinia graveolens for its antioxidant activity and phenolic composition. J. Ethnopharmacol. 2004, 94, 175. 13.Heijnen C.G., et al.: Protection of flavonoids against lipid peroxidation: the structure activity relationship revisited. Free Radic. Res. 2002, 36, 575. 14.De Groot H., Rauen U.: Tissue injury by reactive oxygen species and the protective effects of flavonoids. Fundam. Clin. Pharmacol. 1998, 12, 249. 15.Bokkenheuser V.D., Winter J.: Hydrolysis of flavonoids by human bacteria. In: Alan R. editor. Plant flavonoids in biology and medicine: biochemical, cellular and medical properties. Liss, New York NYUSA 1988, 143. 16.Hollman P.C., Katan M.B.: Bioavailability and health effects of dietary flavonols in man. Arch. Toxicol. Suppl. 1998, 20, 237. 17.Gugler R., et al.: Disposition of quercetin in man after single oral and intravenous doses. Eur. J. Clin. Pharmacol. 1975, 9, 229. 18.Terao J.: Dietary flavonoids as antioxidants in vivo: Conjugated metabolites of (-)-epicatechin and quercetin participate in antioxidative defense in blood plasma. J. Med. Inv. 1999, 46, 159. 19.Shali N.A., et al.: Sulphatation of the flavonoids quercetin and catechin by rat liver. Xenobiotica 1991, 21, 881. 20.Kohri T., et al.: Metabolic fate of (-)-(4-(3)H)epigallocatechin gallate in rats after oral administration. J. Agric. Food Chem. 2001, 49, 4102. 21.Colette N., et al.: Antioxidant properties of hydroxyflavones. Free Radic. Biol. Med. 1996, 20, 35. 22.Nakayama T., et al.: Suppresion of active oxygen-induced cytotoxicity by flavonoids. Biochem. Pharmacol. 1993, 45, 265. 23.Sichel G., et al.: In vitro scavenger activity of some flavonoids and melanins against O2-. Free Radic. Biol. Med. 1991, 11, 1. 24.Jovanovic S.V., et al.: Flavonoids as antioxidants. J. Am. Chem. Soc. 1994, 116, 4846. 25.Harborne J.B., Williams C.A.: Advances in flavonoid research since 1992. Phytochemistry 2000, 55, 481. 26.Arora A., et al.: Modulation of liposomal membrane fluidity by flavonoids and isoflavonoids. Arch. Biochem. Biophys. 2000, 373, 102. 27.Higdon J.V., Frei B.: Tea catechins and polyphenols: health effects, metabolism and anitoxidant functions. Crit. Rev. Food Sci. Nutr. 2003, 43, 89. 28.Nagao A., et al.: Inhibition of xanthine oxidase by flavonoids. Biosci. Biotechnol. Biochem. 1999, 63, 1787. 29.Aucamp J., et al.: Inhibibition of xantine oxidase by catechins from tea ( Camelia sinensis). Anticancer Res. 1997, 17, 4381. 30.Hodnick W.F., et al.: Inhibition of mitochondrial respiration and cyanide-stimulated generation of ROS by selective flavonoids. Biochem. Pharmacol. 1994, 47, 573. 31.Pincemail J., et al.: Human myeloperoxidase activity is inhibited in vitro by quercetin. Comparison with three related compounds. Experientia 1988, 44, 450. 32.Guo Q., et al.: Studies on protective mechanism of four components of green tea polyphenols against lipid peroxidation in synaptosomes. Biochim. Biophys. Acta. 1996, 1304, 210. 33.Abu-Amsha R., et al.: Phenolic contetnt of various beverages determines the extent of inhibition of human serum and LDL oxidation in vitro: identification and mechanism of action of some cinnamic acid derivatives from red wine. Clin. Scien. 1996, 91, 449. 34.El Sukkary M.M.A., Speier G.: Oxygenation of 3-hydroxyflavones by superoxide anion. J. Chem. Soc. Chem. Comm. 1981, 745. 35.Takahama U.: Oxidation products of kaempferol by superoxide anion radical. Plant Cell Physiol. 1987, 28, 953. 36.Takahama U., et al.: Transformation of quercetin by singlet oxygen generated by a photosensitized reaction. Photobiochem. Photobiophys. 1984, 7, 175. 37.Kano K., et al.: Superoxide anion radical-induced dioxygenolysis of quercetin as a mimic of quercetinase. J. Chem. Soc. Chem. Comm. 1994, 583. 38.Bindoli A., et al.: Inhibitory action of silymarin on lipid peroxide formation in rat liver mitochondria and microsomes. Biochem. Pharmacol. 1977, 26, 2405. 39.Sorata Y., et al.: Protective effect of quercetin and rutin on photosensitized lysis of human erythrocytes in the presence of hematoporphyrin 1984, 799, 313. 40.Terao J., et al.: Protective effect of epicatechin, epicatechin gallate, and quercetin on lipid peroxidation in phospholipid bilayers. Arch. Biochem. Biophys. 1994, 308, 278. 41.Jha H.C., et al.: Inhibition of in vitro microsomal lipid peroxidation by isoflavonoids. Biochem. Pharmacol. 1985, 34, 1367. 42. Kimura Y., et al.: Studies on Scutellariae radix. IX. New component inhibiting lipid peroxidation in rat liver. Planta Med. 1984, 50, 290. 43.Laughton M.J., et al.: Antioxidant and prooxidant actions of the plant phenolics quercetin gossypol and myricetin. Effects on lipid peroxidation, hydroxyl radical generation and bleomycin-dependent damage to DNA. Biochem. Pharmacol. 1989, 38, 2859. 44.Decharneux T., et al.: Effect of various flavonoids on lysosomes subjected to an antioxidative or an osmotic stress. Biochem. Pharmacol. 1984, 44, 1243. 45.Cherubini A., et al.: Black tea increases the resistance of human plasma to lipid peroxidation in vitro, but not ex vivi. Free Rad. Biol. Med. 1999, 27, 381. 46.Block G., et al.: Vitamin C: a new look. Ann. Intern. Med. 1991, 114, 909. 47.Clemetson C.A.B.: Bioflavonoids. In: Vitamin C (Clemetson C.A.B ed.) CRC Press, Inc. Boca Raton, FL, 1980, 101. 48.Hughes R.E., Wilson HK.: Flavonoids: some physiological and nutritional consideration. Prog. Med. Chem. 1977, 14, 285. 49. Lee T.P., et al.: Effect of quercetin on human polymorphonuclear leukocyte lysosomal enzyme release and phospholipid metabolism. Life Sci. 1982, 31, 2765. 50. Lanni C., Becker E.L.: Inhibition of neutrophil phospholipase A2 by p-bromophenylacyl bromide, nordihydroguaiaretic acid, 5, 8 ,11, 14-eicosatetrayenoic acid and quercetin. Int. Arch. Allergy Appl. Immunol. 1985, 76, 214. 51.Gil B., et al.: Effects of flavonoids on Naja naja and human recombinant synovial phospholipase A2 and inflammatory responses in mice. Life Sci. 1994, 54, PL333. 52.Laughton M.J., et al.: Inhibition of mammalian 5-lipoxygenase and cyclooxygenase by flavonoids and phenolic dietary additives: relationship to antioxidant activity and to iron ion-reducing ability. Biochem. Pharmacol. 1991, 42, 1673. 53. Hoult J.R.S., et al.: Action of flavonoids and coumarins on lipoxygenase and cyclooxygenase. Methods Enzymol. 1994, 23, 443. 54.Wheeler E.L., Berry D.L.: In vitro inhibiotion of mouse epidermal cell lipoxygenase by flavonoids: structure-activity relationships. Carcinogenesis 1986, 7, 33. 55.Moroney M.A., et al.: Selectivity of neutrophil m5-lipoxygenase and cyclooxygenase inhibition by an antiinflammatory flavonoid glycoside and related aglycone flavonoids. Pharm. Pharmacol. 1988, 40, 787. 56.Kalkbrenner F., et al.: In vitro inhibition and stimulation of purified prostaglandin endoperoxide synthase by flavonoids: structure, activity relationship. Pharmacology 1992, 44, 1. 57.Sato T., et al.: Mechanism of antioxidant action of pueraria glycoside (PG-1) (an isoflavonoid) and maniferin (a xanthonoid). Chem. Pharm. Bull 1992, 40, 721. 58. Yoshino M., et al.: Prooxidant activity of flavonoids: copper-dependent strand breaks and the formation of 8-hydroxy-2´-deoxyguanosine in DNA. Mol. Genet. Metab. 1999, 68, 468. 59.Galati G., O´Brien P.J.: Potential toxicity of flavonoids and other dietary phenolics: significance for their chemopreventive and anticancer properties. Free Radic. Biol. Med. 2004, 37, 287. 60.Liu T.T., et al.: Effects of long-term tea polyphenols consumption on hepatic microsomal drug-metabolizing enzymes and liver function in Wistar rats. World J. Gastroenterol. 2003, 9, 2742. 61.Kishida T., et al.: Lack of an inducible effect of dietary soy isoflavones on the mRNA abundance of hepatic cytochrome P-450 isozymes in rats. Biosci. Biotechnol. Biochem. 2004, 68, 508. 62.Kishida T., et al.: Soy isoflavonoids aglycones genistein and daidzein do not increase cytochrome P-450 content of the liver microsomes of mice. J. Agric. Food Chem. 2000, 48, 3872. 63.Ren W., et al.: Flavonoids: promising anticancer agents. Med. Res. Rev. 2003, 23, 519. 64.Galati G., et al.: Cancer chemoprevention and apoptosis mechanisms induced by dietary polyphenolics. Drug Metab. Drug Interact. 2000, 17, 311. 65.Ahn D., et al.: The effect od dietary ellagic acid on rat hepatic and esophageal mucosal cytochromes P-450 and phase II enzymes. Carcinogenesis 1996, 17, 821. 66.Eaton E.A., et al.: Flavonoids, potent inhibitors of the human P-form phenolosulfotransferase: potential role in drug metabolism and chemoprevention. Drug Metab. Dispos. 1996, 24, 232. 67.Steele V.E., et al.: Comparative chemopreventive mechanisms of green tea, black tea and selected polyphenol extracts measured by in vitro bioassays. Carcinogenesis 2000, 21, 213. 68.Weisburger J.M.: Tea and health: the underlying mechanisms. Proc. Soc. Exp. Biol. Med. 1999, 220, 271. 69.Nordman R.: Alcohol and antioxidant system. Alcohol 1994, 29, 513. 70.Keung W.M., Vallee B.L.: Daidzin and daidzein suppress free-choice ethanol intake by Syrian golden hamsters. Proc. Natl. Acad. Sci. USA 1993, 90, 1008. 71. Ferriola P.C., et al.: Protein kinase C inhibition by plant flavonoids kinetic mechanism and structure-activity relationships. Biochem. Pharmacol. 1989, 38, 1617. 72.Cochet C., et al.: Selective inhibition of a cyclic nucleotide independent protein kinase (G type kasien kinase) by quercetin and related polyphenols. Biochem. Pharmacol. 1982, 31, 1357. 73.Kakeya H., et al.: Isolation of novel substrate-competitive tyrosine kinase inhibition desmal, from the plant Desmos chinensis. FEBS Lett. 1993, 320, 169. 74.Kyriakidis S.N., et al.: Interaction of flavonoids with rabbit muscle phosphorylase kinase. Biochim. Biophys. Acta 1986, 871, 121. 75.Jinsart W., et al.: Inhibition of rat liver cAMP-dependent protein kinase by flavonoids. Biol. Chem. Hoppe-Seyler 1992, 373, 205. 76. Hadi S.M., et al.: Putative mechanism for anticancer and apoptosis-inducing properties of plant-derived polyphenolic compounds. IUBMB Life 2000, 50, 167. 77.Kaufman S.H.: Induction of endonucleolytic DNA cleavage in human acute myelogenous leukemia cells by etoposide, camptothecin and other cytotoxic anticancer drugs: a cautionary note. Cancer Res. 1989, 49, 5870. 78.Rahman A., et al.: Complexes involving quercetin, DNA and Cu(II). Carcinogenesis 1990, 11, 2001. 79.Ahmad A., et al.: DNA breakage by resveratrol and Cu(II): reaction mechanism and bacteriophage inactivation. Cancer Lett. 2000, 154, 29. 80. Dunnick J.K., Hailley J.R.: Toxity and carcinogenicity studies of quercetin, a natural component of foods. Fundam. Appl. Toxicol. 1992, 19, 423. 81.Pennie W.D., Campo M.S.: Synergism between bovine papillomavirus type 4 and the flavonoid quercetin in cell transformation in vitro. Virology 1992, 190, 861. 82.Ito N., et al.: Drug and food additives and natural products as promoters in rat urinary bladder carcinogenesis. IARC Sci. Pub. 1984, 56, 399.

