© Borgis - Postępy Fitoterapii 4/2008, s. 225-232
*Bogdan Kędzia, Elżbieta Hołderna-Kędzia
Występowanie związków fenolowych w miodzie pszczelim
PRESENCE OF PHENOLIC COMPOUNDS IN BEE HONEY
Instytut Roślin i Przetworów Zielarskich w Poznaniu
Dyrektor Instytutu: dr hab. n. med. Przemysław M. Mrozikiewicz
Summary
To phenolic compounds occuring in bee honey belong free phenols (volatile compounds), phenolic acids also polyphenols in the form of flavonoids, distinguishing anthocyanins, procyanidins and pigments. Their total contents depends from species of plant from which bees collect nectar and it amounts 5-1260 mg/kg. In bright honeys the contents of phenolic compounds is usually lower than in the dark honeys.
The presented work discussed the qualitative and quantitative composition of phenolic acids and flavonoids which are the largest group of phenolic compounds occuring in bee honey. To the phenolic acids most often occuring in honey of Polish origin belong: chlorogenic acid, caffeic acid and ferulic acid and among of flavonoids such compounds like: chrysine, apigenin, luteolin (flavone), quercetin, kaempferol, myricetin, isorhamnetin (flavonols) also pinobanxine (flavanolol) and pinocembrine (flavonon). The total amount of phenolic acids in European honeys ist not higher than 100 mg/kg and in the Polish honeys is many times higher.

Związki fenolowe stanowią dużą grupę substancji występujących w świecie roślinnym. Są one pochodnymi fenolu (ryc. 1). W miodzie mogą one występować jako wolne fenole (substancje lotne miodu), w formie glikozydów fenolowych (w świeżych miodach), kwasów fenolowych, a także polifenoli, w postaci flawonoidów, wśród których wyróżnia się także antocyjany, procyjanidyny i garbniki. Z danych piśmiennictwa wynika, że w miodzie pszczelim istotna jest całkowita zawartość związków fenolowych, a także kwasów fenolowych i flawonoidów. Omawiane związki w dużym stopniu odpowiedzialne są za aktywność przeciwutleniającą tego produktu.
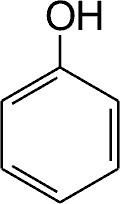
Ryc. 1. Budowa chemiczna fenolu.
Całkowita zawartość związków fenolowych
Polskie dane (1) wskazują, że całkowita zawartość związków fenolowych wynosi od 267 do 1260 mg/kg miodu (tab. 1).
Tabela 1. Całkowita zawartość związków fenolowych w miodach krajowych (wg 1).
| Odmiana miodu | Średnia zawartość związków fenolowych
(mg/kg)1 |
Akacjowy
Rzepakowy
Lipowy
Ze spadzi iglaste
Wrzosowy
Gryczany
Ze spadzi liściastej |
267
355
390
645
760
953
1260
|
1W przeliczeniu na kwas galusowy
W miodach jasnych, takich jak miód akacjowy, rzepakowy i lipowy, była ona wyraźnie niższa (267-390 mg/kg) w porównaniu do miodów ciemnych ze spadzi iglastej, wrzosowego, gryczanego i ze spadzi liściastej (645-1260 mg/kg).
Wysoką zawartość związków fenolowych odnotowują także badacze amerykańscy (3). Podobnie jak w przypadku miodów polskich, niższą zawartością odznaczały się miody jasne (wierzbówkowy, akacjowy, nostrzykowy, sojowy), natomiast miód gryczany, zaliczany do miodów ciemnych, odznaczał się wysoką zawartością związków fenolowych (456-796 mg/kg) (tab. 2).
Tabela 2. Całkowita zawartość związków fenolowych w miodach amerykańskich (wg 3).
| Odmiana miodu | Średnia zawartość związków fenolowych
(mg/kg)1 |
Akacjowy
Wierzbówkowy
Nostrzykowy
Sojowy
Gryczany |
46
62
128
296
456-796
|
1W przeliczeniu na kwas galusowy
Hiszpanie podają (4), że średnia zawartość związków fenolowych w 27 próbkach miodu nektarowego 6 odmian wynosiła 670 mg/kg, a średnia zawartość związków fenolowych w 19 próbkach miodu spadziowego wynosiła 1010 mg/kg.
Według późniejszych badań krajowych (2) ogólna zawartość związków fenolowych w miodach odmianowych kształtowała się w granicach od 166 do 291 mg/kg (średnio 226±30 mg/kg). Najwięcej związków fenolowych stwierdzono w miodzie gryczanym – średnio 242±24 mg/kg, a najmniej w miodzie lipowym – średnio 204±32 mg/kg. Wyniki przeliczane były na kwas galusowy.
Dość wysoką zawartością związków fenolowych odznaczały się miody jemeńskie (5) (tab. 3).
Tabela 3. Całkowita zawartość związków fenolowych w miodach amerykańskich (wg 3).
| Odmiana miodu | Średnia zawartość związków fenolowych
(mg/kg)1 |
Kwiaty tropikalne
Acacia edeworhi
Zizyphus spina-christi
Acacia ehrenbergina |
75
100
115
246
|
1W przeliczeniu na katechinę
Zawartość omawianych związków mieściła się w miodzie różnych odmian w granicach 75-246 mg/kg.
Natomiast zawartość związków fenolowych badana w innych krajach europejskich i azjatyckich, a także oceniana przez innych badaczy amerykańskich była znacznie niższa. Całkowita zawartość tych związków w krajach europejskich (Niemcy, Włochy, Francja, Hiszpania, Portugalia, Holandia, Wielka Brytania, Dania, Szwajcaria (5, 6) mieściła się granicach 5-69 mg/kg, w miodach tunezyjskich i irańskich mieściła się w granicach 1-56 mg/kg (5, 7) i w amerykańskich wynosiła od 11 do 79 mg/kg (5, 8). Wśród badanych miodów nie udało się zauważyć zależności pomiędzy zawartością związków fenolowych i przynależnością do odmian miodów jasnych i ciemnych.
Z badań tych wynika, że najwięcej omawianych związków (powyżej 20 mg/kg) zawierają miody: rzepakowy, słonecznikowy, wrzoścowy, gryczany, sojowy, nostrzykowy i akacjowy europejski, irański z kwiatów tropikalnych oraz większość odmian miodu amerykańskiego. Najmniej związków fenolowych (poniżej 5 mg/kg) stwierdzono natomiast w miodach tunezyjskich (tymiankowym, rozmarynowym i wielokwiatowym).
Jak można zorientować się z powyższego przeglądu, zawartość związków fenolowych w miodzie może być bardzo wysoka (nawet powyżej 1200 mg/kg), jak i bardzo niska (poniżej 5 mg/kg). Wiąże się to prawdopodobnie także z dużą różnicą w aktywności przeciwutleniającej tych miodów, ponieważ właściwość ta w dużym stopniu zależna jest od obecności w miodzie związków fenolowych.
Warto jednak podkreślić, że polskie miody, zarówno ciemne, jak i jasne, wyróżniają się wysoką zawartością związków fenolowych, w granicach od 204 do 1260 mg/kg, podczas gdy większość miodów europejskich, afrykańskich i amerykańskich zawiera poniżej 100 mg/kg omawianych substancji.
Kwasy fenolowe
Kwasy fenolowe, nazywane często fenolokwasami, mają w swojej cząsteczce grupę hydroksylową (-OH), często jest ich więcej, a także grupę karboksylową (-COOH).
Z danych amerykańskich wynika (8), że miód zawiera następujące kwasy fenolowe: p-hydroksybenzoesowy, wanilinowy, syryngowy, p-kumarowy i cynamonowy (ryc. 2). Ich obecność badano w miodzie akacjowym, wierzbówkowym, nostrzykowym, sojowym i gryczanym. Najwięcej kwasów fenolowych stwierdzono w miodzie gryczanym (30,1 mg/kg), najmniej w miodzie akacjowym (1,5 mg/kg). Z kolei w największej ilości występował kwas p-hydroksybenzoesowy (14,8 mg/kg), a w najmniejszej ilości kwas syryngowy (0,60 mg/kg).
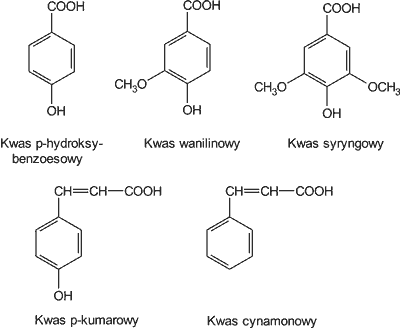
Ryc. 2. Budowa chemiczna niektórych kwasów fenolowych występujących w miodzie.
Badania krajowe (9) wskazują, że w miodach dominują kwasy: chlorogenowy, kawowy i ferulowy (ryc. 3) (tab. 4). Ich zawartość w miodach krajowych jest dość zróżnicowana (od 0,3 do 103,2 mg/kg). Najbardziej zasobne w wymienione kwasy fenolowe okazały się miody: lipowy, gryczany i wrzosowy, które zawierały średnio 36,6; 17,3 i 20,3 mg/kg powyższych kwasów fenolowych. Najmniej kwasu chlorogenowego, kawowego i ferulowego zawierały miody: wielokwiatowy, rzepakowy i akacjowy (od 0,7 do 2,2 mg/kg).
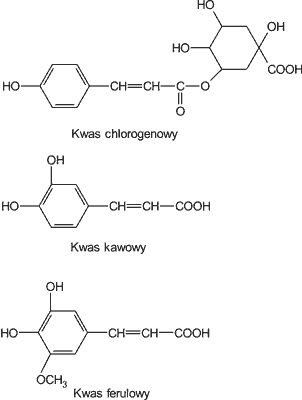
Ryc. 3. Budowa chemiczna kwasów fenolowych występujących w miodach krajowych.
Tabela 4. Zawartość dominujących kwasów fenolowych (chlorogenowego, kawowego i ferulowego) w miodach krajowych (wg 9).
| Odmiana miodu | Liczba prób | Zawartość dominujących kwasów fenolowych (mg/kg) |
| zakres | średnia |
Lipowy
Gryczany
Wrzosowy
Wielokwiatowy
Rzepakowy
Akacjowy | 4
3
1
6
1
2 | 9,9-103,2
1,7-39,4
20,3
0,3-2,2
2,2
0,7-0,8 | 36,6
17,3
20,3
0,7
2,2
0,8 |
| Łącznie | 17 | 0,3-103,2 | 11,1 |
Natomiast w innej polskiej publikacji (10) znajdujemy jedynie wzmiankę o wykryciu w jednym z 15 badanych miodów kwasu galusowego (ryc. 4). Pozostałych kwasów fenolowych nie zidentyfikowano.
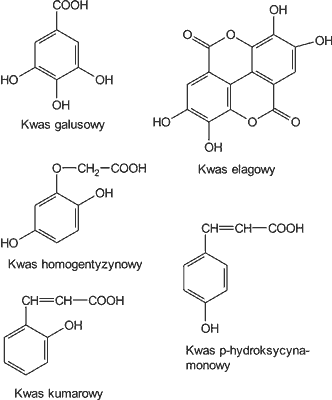
Ryc. 4. Budowa chemiczna kwasów fenolowych występujących w miodach nektarowych.
Piśmiennictwo zagraniczne przynosi wiele interesujących danych na temat występowania kwasów fenolowych w miodzie.
Andrade i wsp. (11) w miodach portugalskich z nektaru lawendy ( Lavandula stoechas L.) oraz różnych gatunków wrzośca ( Calluna sp.) wykryli i oznaczyli zawartość 11 kwasów fenolowych (tab. 5). Dużym zaskoczeniem dla badaczy była bardzo duża zawartość kwasu galusowego w miodzie lawendowym (średnio 2109 mg/kg), a także w miodzie wrzoścowym kwasów: p-hydroksybenzoesowago, syryngowego, p-kumarowego i elagowego, a także brak kwasu galusowego, co pozwala na chemiczne różnicowanie obu miodów odmianowych.
Tabela 5. Zawartość kwasów fenolowych w miodach portugalskich z nektaru Lavandula stoechas i Erica sp. (wg 9).
| Kwasy fenolowe | Zawartość (mg/kg) |
| miód lawendowy | miód |
wrzoścowy
Galusowy
p-Hydroksybenzoesowy
Wanilinowy
Chlorogenowy
Kawowy
Syryngowy
p-Kumarowy
Ferulowy
m-Kumarowy
o-Kumarowy
Elagowy | 2109,0*
0
5,0
5,0
0,6
0
0,4
1,9
0,6
0
0 | 0*
3,3
3,5
4,6
0,5
1,2
14,9
5,4
1,1
0,6
2,9 |
| Łącznie | 2123,3 | 40,1 |
| *Średnie z 20 próbek miodu |
W innych badaniach Andrade i wsp. (12) w miodach pochodzących z Portugalii, Francji, Grecji, Hiszpanii i Chin wykryli obecność 12 kwasów fenolowych (tab. 6). Kwas p-hydroksybenzoesowy i kawowy występowały we wszystkich 11 badanych miodach, kwas p-kumarowy w 10 miodach. Dość często występowały także kwasy: chlorogenowy (7 miodów), syryngowy (7 miodów), wanilinowy (7 miodów), m-kumarowy (6 miodów) i ferulowy (6 miodów). Rzadko wykrywano kwasy: o-kumarowy (4 miody), rozmarynowy (2 miody), galusowy (2 miody). Natomiast kwas elagowy wykryto tylko w miodzie wrzoścowym z Portugalii.
Tabela 6. Występowanie kwasów fenolowych w miodach pochodzących z różnych rejonów świata (wg 12).
| Rodzaj miodu | Kraj pochodzenia | Kwasy fenolowe |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
Wrzoścowy
Lawendowy
Słonecznikowy
Rozmarynowy
Kasztanowy
Rzepakowy
Rododendronowy
Tymiankowy
Pomarańczowy
Wrzosowy
Akacjowy | Portugalia
Portugalia
Francja
Francja
Francja
Francja
Francja
Grecja
Hiszpania
Hiszpania
Chiny | +
+
+
+
+
+
+ | +
+
+
+
+
+ | +
+
+
+
+
+
+ | +
+
+
+
+
+ | +
+
+
+ | +
+
+
+
+
+
+
+
+
+ | +
+
+
+
+
+
+ | + |
+
+ | +
+
+
+
+
+
+
+
+
+
+ | +
+
+
+
+
+
+
+
+
+
+ |
+
+ |
| Kwasy fenolowe: 1 - chlorogenowy, 2 - m-kumarowy, 3 - syryngowy, 4 - ferulowy, 5 - o-kumarowy, 6 - p-kumarowy, 7 - wanilinowy,
Kwasy fenolowe: i8 - elagowy, 9 - rozmarynowy, 10 - p-hydroksybenzoesowy, 11 - kawowy, 12 - galusowy |
Martos i wsp. (7) z miodów tunezyjskich: eukaliptusowego, tymiankowego i wielokwiatowego, wyizolowali kwas elagowy (ryc. 4) w ilościach 3,3; 0,4 i 0,03 mg/kg. Cabras i wsp. (13) w miodzie z drzewa truskawkowego ( Arbutus unedo) wykazali dużą zawartość kwasu homogentyzynowego (ryc. 4). Jego ilość w 23 próbkach tego miodu wahała się w granicach 197-540 mg/kg (średnio 378 mg/kg).
Tomâs-Barberân i wsp. (6) określali zawartość kwasów fenolowych w 52 miodach europejskich pochodzących z Niemiec, Włoch, Francji, Hiszpanii, Portugalii, Holandii, Wielkiej Brytanii i Danii. Stwierdzili oni występowanie w miodzie lipowym, kasztanowym, wrzoścowym, rozmarynowym, słonecznikowym, lawendowym i akacjowym czterech kwasów fenolowych: p-kumarowego w ilości 0,11-1,02 mg/kg, ferulowego w ilości 0,23-0,65 mg/kg, elagowego w ilości 0,25-7,16 mg/kg i kwasu kawowego w ilości 0,43-1,24 mg/kg (tab. 7).
Tabela 7. Zawartość kwasów fenolowych w miodach europejskich (wg 6).
| Odmiana miodu | Średnia zawartość kwasów fenolowych (mg/kg) |
| p-kumarowy | ferulowy | elagowy | kawowy |
Lipowy
Kasztanowy
Wrzoścowy
Rozmarynowy
Słonecznikowy
Lawendowy
Akacjowy | 1,02
0,30
0,38
0,11
0,81
0,78
0,45 |
0,53
0,23
0,65
0,25
0,54 |
7,16
0,25 |
0,87
0,81
0,48
1,24
0,80
0,43 |
Schramm i wsp. (14) podają, że w miodzie gryczanym wykryli kwas p-hydroksybenzoesowy (ryc. 2) w średniej ilości 11,3 mg/kg i kwas p-hydroksycynamonowy (ryc. 4) w średniej ilości 3 mg/kg.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Zujko ME, Witkowska AM, Łapińska A. Właściwości antyoksydacyjne miodów pszczelich. Bromat Chem Toksykol 2005; 38:7-11. 2. Borawska MH, Piekut J. Wartość liczby diastazowej, potencjału antyoksydacyjnego i zawartość polifenoli w miodach pszczelich z regionu Podlasia. XLIII Nauk Konf Pszczel, Puławy 2006; 214-5. 3. Gheldof N, Engeseth NJ. Antioxidant capacity of honeys from various floral sources based on the determination of oxygen radical absorbance capacity and inhibition of in vitro lipoprotein oxidation in human serum samples. J Agric Food Chem 2002; 50:3050-5. 4. Iglesias MT, Lorenzo de C, Carmen-Polo del M et al. Usefulness of amino acid composition to discriminate between honeydew and floral honeys. Application to honeys from a small geographic area. J Agric Food Chem 2004; 52:84-9.4. Siess M-H, Le Bon A-M, Canivenc-Lavier M-C et al. Flavonoids of honey and propolis: characterization and effects on hepatic drug-metabolizing enzymes and benzo(a)pyrene – DNA binding in rats. J Agric Food Chem 1996; 44:2297-301. 5. Al-Mamary M, Al-Meeri A, Al-Habori M. Antioxidant activities and total phenolics of different types of honey. Nutr Res 2002; 22:1041-7. 6. Tomâs-Barberân FA, Martos I, Ferreres F et al. HPLC flavonoid profiles as markers for the botanical origin of European unifloral honeys. J Sci Food Agric 2001; 81:485-96. 7. Martos I, Cossentini M, Ferreres F et al. Flavonoid composition of Tunisian honeys and propolis. J Agric Food Chem 1997; 45:2854-2829. 8. Gheldof N, Wang X-H, Engeseth NJ. Identification and quantification of antioxidant components of honeys from various floral sources. J Agric Food Chem 2002; 50:5870-7. 9. Kołoczek H, Kaszycki P, Świderski A i wsp. Wsparcie produkcji i zbytu miodu – ocena zawartości antyutleniaczy w miodach polskich. Projekt badawczy. Apipol-Farma w Myślenicach, Kraków 2005. 10. Wilczyńska A, Rój A., Przybyłowski P. Próba identyfikacji związków fenolowych w miodach pszczelich. Przegl Pszczel 2005; Nr 2:69-72. 11. Andrade P, Ferreres F, Amaral MT. Analysis of honey phenolic acids by HPLC its application to honey botanical characterization. J Liq Chrom Rel Technol 1997; 20:2281-8. 12. Andrade P, Ferreres F, Gil I et al. Determination of phenolic compounds in honeys with different floral origin by capilarry zone electrophoresis. Food Chem 1997; 6:79-84. 13. Cabros P, Angioni A, Tuberoso C et al. Homogentisic acid: a phenolic acid as a marker of strawberry-tree ( Arbutus unedo) honey. J Agric Food Chem 1999; 47:4064-7. 14. Schramm DD, Karim M, Schrader HR et al. Honey with high levels of antioxidants can provide protection to healthy human subjects. J Agric Food Chem 2003; 51:1732-5. 15. Yao L, Jiang Y, Singanusong Ret al. Phenolic acids and abscisic acid in Australian Eucalyptus honeys and their potential for floral authentication. Food Chem 2004; 86:169-77. 16. Dimitrova B, Gevrenova R, Anklam E. Analysis of phenolic acids in honeys of different floral origin by solid-phase extraction and high-performance Liquid chromatography. Photochem Anal 2007; 18:24-32. 17. Ferreres F, Ortiz A, Silva C et al. Flavonoids of "La Alcarria” honey. Z Lebensm Unters Forsch 1992; 194:139-43. 18. Soler C, Gil MI, Garcia-Viguera C et al. Flavonoid patterns of French honeys with different floral origin. Apidologie 1995; 26:53-60. 19. Ferreres F, Juan T, Perez-Arguillue C et al. Evaluation of pollen as a source of kaempferol in rosemary honey. J Sci Food Agric 1988; 77:506-10. 20. Martos I, Ferreres F, Yao L et al. Flawonoids in monospecific Eucalyptus honeys from Australia. J Agric Food Chem 2000; 48:4744-8. 21. Martos I, Ferreres F, Tomâs-Barberân FA. Identification of flavonoid markers for the botanical origin of Eucalyptus honey. J Agric Food Chem 2000; 48:1498-502. 22. Serra-Bonrechi J, Soliva-Torrento M Centelles-Lorente E. Evaluation of polyphenolic and flavonoid compounds in honeybee-collected pollen produced in Spain. J Agric Food Chem 2001; 49:1848-53. 23. Yao L, Jiang Y, D´Arcy B et al. Quantitative high-performance liquid chromatography analyses of flavonoids in Australian Eucalyptus honeys. J Agric Food Chem 2004; 52:210-4. 24. Yao L, Jiang Y, Singanusong R et al. Flavonoids in Australian Melaleuca, Guioa, Lophostemon, Banksia and Helianthus honeys and their potential for floral authentication. Food Res Int 2004; 37:166-74. 25. Hołderna-Kędzia E, Kędzia B. Antybiotyczne działanie miodu pszczelego. IX Kraj Nauk-Techn Konf Pszczel, Częstochowa 2003; 83-94. 26. Siess M-H, Le Bon A-M, Canivenc-Lavier M-C et al. Flavonoids of honey and propolis: characterization and effects on hepatic drug-metabolizing enzymes and benzo(α)pyrene-DNA binding in rats. J Agric Food Chem 1996; 44:2297-301.




