© Borgis - Postępy Nauk Medycznych 7-8/2007, s. 298-303
*Jacek Nowak, Elżbieta Graczyk-Pol, Renata Mika-Witkowska, Małgorzata Zajko,
Marta Rogatko-Koroś, Jadwiga Sak-Budzisz
Skuteczność poszukiwania przez Ośrodek Instytutu Hematologii i Transfuzjologii niespokrewnionych dawców komórek krwiotwórczych w krajowych i zagranicznych rejestrach w latach 2001-2006 dla pacjentów z ostrymi i przewlekłymi białaczkami
Efficacy of bone marrow donor searches performed by Institute
of Haematology and Blood Transfusion in domestic and foreign registries in 2001-2006 for the patients with acute and chronic leukemia
Samodzielna Pracownia Immunogenetyki Instytutu Hematologii i Transfuzjologii w Warszawie
Dyrektor Instytutu: prof. dr hab. n. med. Krzysztof Warzocha
Streszczenie
Wstęp. Przeprowadzenie transplantacji komórek krwiotwórczych (TKK) u chorych z ostrymi lub przewlekłymi białaczkami uzależnione jest od dostępności dawcy o wysokim stopniu zgodności immunogenetycznej, najczęściej w zakresie 10/10 alleli loci A, B, Cw, DRB1 i DQB1 głównego kompleksu zgodności tkankowej HLA (human leukocyte antigen). Niektóre cechy biologiczne dawcy, takie jak wiek, płeć, status CMV i in. wpływające na przebieg potransplantacyjny mogą stanowić dodatkowe kryterium doboru dawcy tylko w przypadkach, gdy chory posiada wielu dawców zgodnych w zakresie HLA.
Materiał i metody. Analizie poddano 360 procedur doboru niespokrewnionego dawcy szpiku przeprowadzonych w Instytucie Hematologii i Transfuzjologii w latach 2001-2006.
Wyniki. W przedstawionych badaniach jednoośrodkowych ukończono 322 procedury. W latach 2001-2006 przeważały następujące rodzaje wskazań do TKK: przewlekła białaczka szpikowa (PBSz) – 94 (26%), ostra białaczka limfoblastyczna – 86 (24%) i ostra białaczka szpikowa – 85 (24%). Nastąpił stopniowy spadek odsetka chorych kwalifikowanych z PBSz (z 43% w 2001 r. do 13% w 2006 r.) i wzrost odsetka chorych z ostrymi białaczkami (z 38% do 56% w tych samych latach). Lekarze ośrodków przeszczepowych zaakceptowali dobranego dawcę dla 226 (70%), w tym zgodnego w zakresie 10/10 alleli dla 148 (46%), a częściowo niezgodnego (7-9/10 alleli) dla 79 (25%) chorych. Dla 47 (20,8%) chorych dawca pochodził z rejestrów polskich. Wzrost odsetka polskich dawców skorelowany był silniej ze wzrostem całkowitej liczby dawców (ABDR + AB) w polskich rejestrach (r = 0,87; p = 0,024; df = 4), niż ze wzrostem liczby dawców ABDR (r = 0,82; p = 0,046; df = 4), co oznacza ich równoważną przydatność przy zastosowaniu algorytmu doboru obejmującego wybranych dawców AB. U zaakceptowanych w latach 2001-2006 dawców częściowo niezgodnych zmniejszeniu (z 63% do 13%) uległ odsetek niezgodnych alleli HLA klasy I z niekorzystną substytucją aminokwasu w pozycji 116. Nie uległ natomiast zmianie odsetek niezgodności HLA związanych z niezgodnością ligacji KIR, uważanych za korzystniejsze od niezgodnych HLA związanych ze zgodnością KIR.
Wnioski. Ponad 70% polskich chorych z ostrymi i przewlekłymi białaczkami ma szansę doboru do TKK niespokrewnionego dawcy zgodnego lub z dopuszczalną niezgodnością HLA. Liczebny rozwój krajowych rejestrów niespokrewnionych dawców szpiku może poprawić przydatność dobieranych dawców i zwiększyć odsetek polskich chorych mogących skorzystać z tej formy leczenia. W doborze dawców dla chorych nie posiadających w pełni zgodnego dawcy istnieje możliwość wyboru niezgodnych alleli o najmniejszej szkodliwości.
Summary
Introduction. Availability of therapeutic stem cell transplantation (SCT) for patients with chronic and acute leukemia depends on selection of HLA acceptable donor.
Materials and methods. The analysis comprised 360 procedures including 322 procedures completed of bone marrow donor search performed at Institute of Haematology and Transfusion Medicine in 2001-2006.
Results. Chronic myeloid leukemia (CML) – 94 (26%), acute lymphoblastic leukemia – 86 (24%) and acute myeloid leukemia – 85 (24%) were the most frequent indications for SCT in 322 donor search procedures. In the peroid of 2001-2006 a significant reduction of CML and elevation of acute leukemia patient percentages were noted. An acceptable donor was selected, for 226 (70%) patients including 148 (46%) perfectly matched and 79 (25%) donors with acceptable mismatch. For 47 (20,8%) patients the donor was selected from the Polish registry. The correlation of the number of Polish patients for whom a Polish donor was selected with the total number of potential donors (ABDR + AB) in Polish registries (r = 0,87; p = 0,024; df = 4) was higher than correlation with the number of Polish ABDR donors (r=0.82; p=0.046; df=4). In the years 2001-2006 the percentage of mismatches with adverse aminoacid substitution in position 116 of class I molecule was successively reduced. On the contrary, the percentage of favorable KIR ligand mismatches remained unchanged.
Conclusions. More than 70% of Polish leukemia patients have an acceptable unrelated donor for SCT. Substantial enrichment of Polish bone marrow donor registries would further improve the quality of selected donors and increase the number of patients to benefit from this therapy. In the absence of fully matched donor, a selection of partly mismatched donor with the top permissive mismatch, should be considered.

Wstęp
Ponad 70% pacjentów z chorobami poddającymi się leczeniu allogeniczną transplantacją komórek krwiotwórczych (TKK) nie posiada zgodnego rodzinnego dawcy. Przeprowadzenie u nich zabiegu TKK uzależnione jest od dobrania niespokrewnionego dawcy o wystarczającym stopniu zgodności immunogenetycznej, najczęściej w zakresie 10 alleli loci A, B, Cw, DRB1 i DQB1 głównego kompleksu zgodności tkankowej HLA (human leukocyte antigen) (1-4). W rejestrach światowych zgromadzono wstępne dane immunogenetyczne ponad 11 milionów, a w polskich ponad 35 tysięcy potencjalnych niespokrewnionych dawców szpiku (5). Pomimo mnogości dawców nie dla wszystkich pacjentów udaje się dobrać dawcę zgodnego w zakresie 10 alleli, w związku z olbrzymim polimorfizmem najistotniejszych loci HLA. Badania kliniczne, przeprowadzane najczęściej w formie case-control wykazały negatywne oddziaływanie niezgodności alleli HLA na wynik TKK, zależne zarówno od liczby (6, 7), jak i jakości niezgodnych alleli (3, 8). Sugeruje się permisywność niektórych typów niezgodności HLA (9, 10), a także możliwość oddziaływania szeregu innych niż HLA czynników genetycznych (11) oraz wpływ bliskości etnicznej i genetycznej (12, 13), różnicy płci (14) pomiędzy dawcą a biorcą, immunizacji (14) i wieku dawcy (14, 15, 16), jak również stanu nosicielstwa CMV (17) i innych herpeswirusów (18). W różnych ośrodkach uzyskano rozbieżne wyniki badań odnośnie znaczenia niezgodności grup krwi układu AB0 w TKK (14, 19). Badania wieloośrodkowe wykazały, że u pacjentów rasy białej niezależny negatywny wpływ na przeżycie chorych po TKK oraz na wystąpienie ostrej choroby przeszczep przeciw gospodarzowi ma alleliczna i antygenowa niezgodność HLA locus Cw, B i DRB1 (20, 21). Niezgodność dwóch i więcej alleli/antygenów oddziałuje negatywnie silniej niż pojedyncza niezgodność, a niezgodność pojedynczego antygenu oddziałuje silniej niż niezgodność pojedynczego allelu (7, 22, 23). Szczególne, negatywne oddziaływanie na wynik TKK ma mieć substytucja aminokwasu w pozycji 116 (24) w cząsteczce HLA klasy I. Pozytywne oddziaływanie ma wykazywać niezgodność alleli HLA klasy I jako ligandów KIR, obejmująca substytucje aminokwasów w pozycjach 80 i 77 w porównaniu z niezgodnością HLA bez niezgodności KIR (9). Wymienione czynniki mogą być uwzględnione w procesie doboru o ile są one znane u chorego i potencjalnego dawcy oraz istnieje więcej niż jeden potencjalny dawca dla danego chorego. Celem pracy było określenie skuteczności i ocena jakościowa doboru niespokrewnionych dawców komórek krwiotwórczych dla chorych z ostrymi i przewlekłymi białaczkami w latach 2001-2006.
Materiał i metody
Analizie poddano 360 procedur i wyników doboru niespokrewnionego dawcy komórek krwiotwórczych przeprowadzonych w Instytucie Hematologii i Transfuzjologii, zleconych w latach 2001-2006 i zakończonych dobraniem lub wykluczeniem możliwości dobrania dawcy. Kryterium dobrania dawcy była jego akceptacja przez lekarzy ośrodka transplantacji szpiku. Przed rozpoczęciem procedury wszyscy pacjenci zostali w pełni poinformowani na temat procedury doboru niespokrewnionego dawcy szpiku oraz wyrazili pisemną zgodę na dobór i udział w badaniach. Dobory zostały przeprowadzone w Instytucie Hematologii i Transfuzjologii (IHiT) zgodnie z zasadami immunogenetyki populacyjnej, standardami World Marrow Donor Association oraz wcześniej opisaną metodą selekcji dawców AB (25). Dawcy i pacjenci byli typowani w zakresie genów HLA zgodnie ze standardami Europejskiej Federacji Immunogenetyki i zaleceniami Polskiego Towarzystwa Immunogenetycznego.
Wyniki i omówienie
W latach 1999-2000 nie istniała w Polsce jednolita procedura finansowania procedur doboru niespokrewnionych dawców komórek krwiotwórczych. W związku z tym dobory i zabiegi TKK od dawcy niespokrewnionego odbywały się sporadycznie. W latach 2001-2006, w związku z wdrożeniem przez MZ regularnego finansowania za pośrednictwem Poltransplantu przeprowadzono w IHiT 360 procedur doboru niespokrewnionego dawcy komórek krwiotwórczych, na zlecenie wszystkich krajowych ośrodków wykonujących TKK od dawców niespokrewnionych. Trzydzieści osiem (11%) spośród 360 procedur wycofano przed ich ukończeniem z powodu zgonu, zmiany kwalifikacji lub rezygnacji pacjenta.
Wskazania do TKK obejmowały zakres chorób zgodny ze standardami European Group for Blood and Marrow Transplantation w adaptacji Jędrzejczaka (26). Wśród zgłoszeń do doboru niespokrewnionego dawcy szpiku przeważały przypadki przewlekłej białaczki szpikowej – 94 (26%) oraz ostrej białaczki limfoblastycznej – 86 (24%) i ostrej białaczki szpikowej – 85 (24%). Tylko w 11 (3%) przypadkach wskazanie stanowiła przewlekła białaczka limfatyczna. Pozostałe wskazania były to: zespoły mielodysplastyczne – 21 (6%), ciężka aplazja – 19 (5%), nocna napadowa hemoglobinuria – 10 (3%) oraz rzadziej, nieziarnicze chłoniaki i ziarnica złośliwa osteomielofibroza, adrenoleukodystrofia, zespół Ommena, przewlekła białaczka prolimfocytowa, zespół Wiscotta Aldricha, hemofagocytoza, wrodzona neutropenia, szpiczak mnogi i rak nerki. W ostatnich latach nastąpił stopniowy spadek odsetka chorych kwalifikowanych z PBSz (z 43% w 2001 r. do 13% w 2006 r.) i wzrost odsetka chorych z ostrymi białaczkami (z 38% do 56% w tych samych latach, ryc. 1).
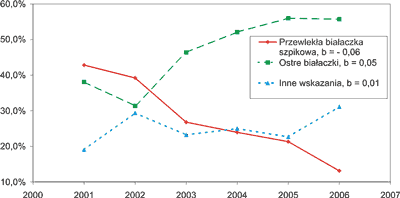
Ryc. 1. Udział procentowy pacjentów z przewlekłą białaczką szpikową, ostrymi białaczkami i innymi chorobami wśród chorych, dla których wykonywano procedurę doboru niespokrewnionego dawcy komórek krwiotwórczych w latach 2001-2006. b – współczynnik nachylenia krzywej.
Skuteczność doboru dawcy, którą definiowano jako akceptację dawcy przez lekarzy ośrodka transplantacji szpiku nie była uzależniona od rozpoznania, lecz raczej od popularności genotypu HLA pacjenta. Spośród ukończonych 322 procedur dobrano dawcę dla 226 (70%) chorych, z czego dla 148 (46%) całkowicie zgodnego (10/10 alleli), a dla 79 (25%) częściowo niezgodnego (9, 8 lub 7/10). Dla 95 (30%) chorych nie było możliwe dobranie akceptowalnego dawcy (tab. 1).
Tabela 1. Liczba chorych i wynik doboru dawcy komórek krwiotwórczych w latach 2001-2006.
| Rok | Liczba chorych, dla których dawca był: |
| Dobrany | Całkowicie zgodny | Zaakceptowany niezgodny | Brak akceptowalnego dawcy | Razem |
| 2001 | 29 (74%) | 18 (46%) | 12 (31%) | 10 (26%) | 40 |
| 2002 | 30 (71%) | 18 (43%) | 12 (29%) | 12 (29%) | 42 |
| 2003 | 34 (67%) | 25 (49%) | 9 (18%) | 17 (33%) | 51 |
| 2004 | 44 (65%) | 34 (50%) | 10 (15%) | 24 (35%) | 68 |
| 2005 | 47 (65%) | 23 (32%) | 24 (33%) | 24 (33%) | 71 |
| 2006 | 42 (84%) | 30 (60%) | 12 (24%) | 8 (16%) | 50 |
| Razem | 226 (70%) | 148 (46%) | 79 (25%) | 95 (30%) | 322 |
W 33% doborów pierwszy dawca wybrany z rejestrów okazał się całkowicie zgodny na poziomie alleli (10/10) i został zaakceptowany do TKK (tab. 2). Był to wysoki odsetek zważywszy, że wyboru dokonywano jedynie na podstawie analizy danych rejestrowych, przeważnie niekompletnych. Dodatkowo, dla 13% pacjentów udało się dobrać również całkowicie zgodnego dawcę, jednak aby to osiągnąć konieczne było szersze przebadanie kilku dawców i sprowadzenie próbek krwi kolejno od 2-4 wyselekcjonowanych dawców. Dzięki zdobytemu w poprzednich latach doświadczeniu i zwiększeniu liczby dawców w rejestrach odsetek chorych, dla których w 2006 roku dobrano w pełni zgodnych dawców wyniósł 60% (tab. 2).
Tabela 2. Liczba chorych, dla których w latach 2001-2006 dobrano całkowicie zgodnych dawców (10/10 alleli) w zakresie HLA-A, B, Cw, DRB1 i DQB1.
| Rok | Liczba chorych, dla których dawca był: |
| Całkowicie zgodny | Pierwszy trafiony | Trudny ale zgodny |
| 2001 | 18 (46%) | 14 (36%) | 4 (10%) |
| 2002 | 18 (43%) | 13 (31%) | 5 (12%) |
| 2003 | 25 (49%) | 17 (33%) | 8 (16%) |
| 2004 | 34 (50%) | 21 (31%) | 13 (19%) |
| 2005 | 23 (32%) | 16 (22%) | 7 (10%) |
| 2006 | 30 (60%) | 24 (48%) | 6 (12%) |
| Razem | 148 (46%) | 105 (33%) | 43 (13%) |
Chorzy, dla których dobrano częściowo niezgodnego dawcę (79/322) zostali przeanalizowani w zakresie liczby niezgodnych alleli, swoistości niezgodnego locus i obecności uważanej za szkodliwą substytucji aminokwasu w pozycji 116 cząsteczki HLA (24). Pojedynczą niezgodność (9/10) zaakceptowano u 73%, a niezgodność 2 i 3 alleli (8 i 7/10) – odpowiednio u 23% i 4% niezgodnych dawców. Liczebność i odsetek niezgodności w poszczególnych loci wynosiły: A – 8 (7%), B – 29 (26%), Cw – 51 (46%), DRB1 – 4 (3,6%), DQB1 – 18 (16%). Spośród 68 chorych, dla których dawca był niezgodny w zakresie HLA klasy I, u 36 (53%) wystąpiła substytucja aminokwasu w pozycji 116, uważana za klinicznie niekorzystną w stosunku do innych substytucji (24). U 28 (41%) wystąpiła niezgodność HLA jako ligandów KIR w kierunku GvH (graft versus host, przeszczep przeciw gospodarzowi). Niezgodność tego typu jest uważana za korzystniejszą niż niezgodność HLA bez niezgodności w zakresie ligacji KIR w kierunku GvH (9). W związku z wdrożeniem analizy sekwencji aminokwasów w niezgodnych cząsteczkach HLA klasy I zanotowano spadkową tendencję liczby dobranych i zaakceptowanych dawców z substytucją aminokwasu w pozycji 116 (z 63% w latach 2001-2004 do 10% w 2006 r.).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Bogunia-Kubik K., et al.: Confirmatory typing results of the National Polish Bone Marrow Donor Registry. Bone Marrow. Transpl., 1998; 22(S4): S45-6.
2. Karabon L., et al.: Qualification and HLA typing for donor-recipient matching in unrelated donor hematopoietic stem cell transplantation. Transplant P 2002; 34(2): 668-70.
3. Weisdorf D.J., et al.: Allogeneic bone marrow transplantation for chronic myelogenous leukemia: Comparative analysis of unrelated versus matched sibling donor transplantation. Blood 2002; 99: 1971-7.
4. Lange A., et al.: Activity of the National Polish Bone Marrow Donors Registry. In: Lange A, editor. Standardization of Donor-recipient Matching in Transplantation. Hauppauge NY: Nova Science Publishers, Inc.; 2006. Chapter 11, p. 93-101.
5. http://www.bmdw.org/index.php?id=number_donors.
6. Petersdorf E.W., et al.: Limits of HLA mismatching in unrelated hematopoietic cell transplantation. Blood 2004; 104: 2976-2980.
7. Styczynski J., et al.: Outcomes of unrelated cord blood transplantation in pediatric recipients. Bone Marrow Transpl 2004; 34: 129-136.
8. Flomenberg N., et al.: Impact of HLA class I and class II high resolution matching on outcomes of unrelated donor bone marrow transplantation: HLA-C mismatching is associated with a strong adverse effect on transplant outcome. Blood 2004; 104: 1923-1930.
9. Bornhäuser M., et al.: Role of KIR ligand incompatibility in hematopoietic stem cell transplantation using unrelated donors. Blood 2004; 103: 2860-2861.
10. Morishima Y., et al.: Effect of HLA-A2 allele disparity on clinical outcome in hematopoietic cell transplantation from unrelated donors. Tissue Antigens 2007; 69(S1): 31-35.
11. Mullally A., et al.: The significance of genomic variation for allogeneic hematopoietic stem cell transplantation. Blood 2007; 109(4): 1355-1362.
12. Beatty P., et al.: Impact of racial genetic polymorphism upon the probability of finding an HLA-matched donor. Transplantation 1995; 60: 778-783.
13. Aplenc R., et al.: Ethnicity and survival in childhood acute myeloid leukemia: a report from the Children´s Oncology Group. Blood 2006; 108: 74-80.
14. Kollman C., et al.: Donor characteristics as risk factors in recipients after transplantation of bone marrow from unrelated donors: the effect of donor age. Blood 2001; 98: 2043-2051.
15. Carreras E., et al.: Donor age and degree of HLA matching have a major impact on the outcome of unrelated donor haematopoietic cell transplantation for chronic myeloid leukaemia. Bone Marrow Transpl 2006; 37: 33-40.
16. Ottinger H.D., et al.: Change of paradigm in donor seiection for hematopoietic stem cell transpiantation for patients above 40 years with early stage leukaemia in HLA-identical siblings are no longer first choice. Bone Marrow. Transpl. 2004; 33(S1): S68, O376.
17. Ringden O., et al.: Which donor should be chosen for haematopoietic stem cell transplantation among unrelated HLA-A, B and DRB1 genomically identical volunteers. Bone Marrow. Transpl. 2004; 33(S1): 131-132, P561.
18. Gustafsson Jernberg A., et al.: Risk factors in pediatric stem cell transplantation for leukemia. Pediatr Transplant 2004; 8: 464-474.
19. Benjamin R.J., et al.: ABO incompatibility as an adverse risk factor for survival after allogeneic bone marrow transplantation. Transfusion 1999; 39: 179-187.
20. Petersdorf E.W., et al.: Clinical significance of donor – recipient HLA matching on survival after myeloablative hematopoietic cell transplantation from unrelated donors. Tissue Antigens 2007; 69(S1): 25-30.
21. Petersdorf E.W., et al.: Impact of donor-recipient HLA matching on survival after myeloablative hematopoietic cell transplantation from unrelated donors. In: Hansen JA, editor. Immunobiology of the human MHC (Proceedings of the 13-th International Histocompatibility Workshop and Conference), Seattle: IHWG Press; 2007. Vol.1. p.1336-47.
22. Flomenberg N., et al.: Impact of HLA class I and class II high-resolution matching on outcomes of unrelated donor bone marrow transplantation: HLA-C mismatching is associated with a strong adverse effect on transplantation outcome. Blood 2004; 104(7): 1923-1930.
23. Greinix H.T., et al.: Impact of HLA class I high-resolution mismatches on chronic graft-versus-host disease and survival of patients given hematopoietic stem cell grafts from unrelated donors. Bone Marrow. Transpl. 2005; 35: 57-62.
24. Ferrara G.B., et al.: Bone marrow transplantation from unrelated donors: the impact of mismatches with substitutions at position 116 of the human leukocyte antigen class I heavy chain. Blood 2001; 98: 3150-3155.
25. Nowak J., et al.: Reliability of HLA-Cw data collected in unrelated bone marrow registry and their usefulness for preliminary donor selection. Int. J. Immunogenet., 2005; 32: 319-22.
26. Jędrzejczak W.W.: Propozycja wskazań do przeszczepiania allogenicznych komórek krwiotwórczych w roku 2006. Acta Haematol. Pol., 2006; 37(S4): 75-80.
27. http://www.medigen.pl/artykuly_12.htm.
28. Polak M., et al.: Activity of National Polish Bone Marrow Donor Registry. East-West Immunogenetics Conference, 1-3 March, 2007, Book of Abstracts, 2007; 2:p26.
29. Tiercy J.M., et al.: Bone marrow transplantation with unrelated donors: what is the probability of identifying an HLA-A/B/Cw/DRB1/B3/B5/DQB1-matched donor? Bone Marrow. Transpl., 2000; 26(4): 437-41.

