© Borgis - Postępy Nauk Medycznych 7/2014, s. 453-460
*Mariusz Marciszek, Emilia Wojtera
Receptory β-adrenergiczne w sercu (na marginesie nagrody nobla z chemii w 2012 roku)
Cardiac β-adrenoreceptors (reference to the nobel prize in chemistry in 2012 year)
Zakład Fizjologii Klinicznej, Centrum Medyczne Kształcenia Podyplomowego, Warszawa
Kierownik Zakładu: prof. dr hab. med. Andrzej Beręsewicz
Streszczenie
W 2012 roku Kobilka i Lefkowitz otrzymali nagrodę Nobla za całokształt prac nad receptorami sprzężonymi z białkiem G (GPCR). GPCR stanowią dużą rodzinę receptorów pośredniczących w przekazywaniu sygnału ze środowiska zewnętrznego do wnętrza komórki. Charakterystyczną cechą ich struktury jest siedem helis przenikających błonę komórkową. Łączy je także ogólny mechanizm transdukcji sygnału. Polega on na związaniu liganda w domenie zewnątrzkomórkowej receptora i przeniesieniu pobudzenia poprzez zmiany konformacyjne na białko G. Kaskada uruchamiana przez aktywację receptora powoduje zmianę metabolizmu komórki, wpływając na aktywność kinaz białkowych i kanałów jonowych. Do tej rodziny należą receptory β-AR obecne w sercu. Ich główną rolą w organizmie jest pośredniczenie w natychmiastowej regulacji układu krążenia w odpowiedzi na bodźce stresowe. Przewlekła stymulacja tych receptorów prowadzi do uaktywnienia ścieżek proprzerostowych w sercu. Niewydolność serca (NS) charakteryzuje się przewlekłą nadmierną stymulacją receptorów β-AR. Skutkuje to zmianą w składzie ilościowym receptorów β-AR w sercu i niesie za sobą zmianę w odpowiedzi serca na sytuacje stresowe. Poznanie struktury i sposobu funkcjonowania receptorów β-AR pozwoliło na wprowadzenie odpowiedniej terapii u osób dotkniętych NS. Artykuł podsumowuje aktualny stan wiedzy dotyczący budowy i funkcjonowania receptorów β-AR w sercu.
Summary
In 2012 Kobilka and Lefkowitz won the Nobel Prize in chemistry for their work on G-protein coupled receptors (GPCR). GPCRs comprise a large receptor family engaged in signal transduction from the external environment to the cell interior. The most characteristic feature of this family is a receptor structure that involves seven transmembrane helices arranged into a funnel. GPCRs have also common mode of signal transduction which consist in receptor rearrangement, caused by binded ligand, and as a result activation of G protein. The cascade started by receptor activation leads to changes in cellular metabolism through acting with protein kinases or ionic channels. Cardiac β-adrenergic receptors (β-AR) are the member of this family. Their main role is in immediate adaptation of the cardiovascular system to the external stressors. Heart failure (HF) is associated with chronic excessive β-AR stimulation that results in hypertrophic myocardial response and in quantitative changes in the cardiac β-AR expression and activity. Knowledge of the β-AR’s structure and mechanism of action set the stage for the contemporary HF therapy with β-AR antagonists.

WPROWADZENIE
W 2012 roku Nagrodę Nobla w dziedzinie chemii otrzymali Brian K. Kobilka i Robert J. Lefkowitz. Autorzy ci od lat 70. XX w. pracowali nad izolacją, krystalizacją i badaniem struktury receptorów β-adrenergicznych. Nagroda została przyznana za całokształt prac obydwu naukowców, które pozwoliły zrozumieć, w jaki sposób funkcjonują i jak są zbudowane receptory sprzężone z białkiem G (ang. G-protein coupled receptor – GPCR), w tym β-AR. Receptory GPCR są dużą rodziną receptorów błonowych, które: mają podobną strukturę, odbierają sygnały chemiczne z otoczenia komórek niesione przez hormony, neurotransmitery, neuropeptydy, substancje parakrynne, substancje odżywcze, zapachy, smaki oraz pośredniczą w przekazywaniu tych sygnałów do wnętrza komórki za pośrednictwem wewnątrzkomórkowego efektora, jakim jest białko G (1, 2).
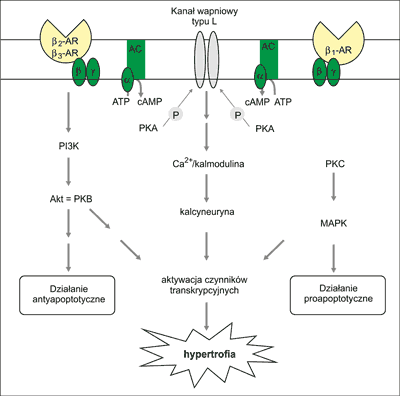
W sercu obecne są receptory adrenergiczne β1, β2 i β3 (β-AR) różniące się powinowactwem do agonistów, komórkowymi szlakami sygnalizacyjnymi i funkcją biologiczną. Stosunek gęstości β1-AR do β2-AR na powierzchni kardiomiocytów wynosi 3:1. W natychmiastowej regulacji układu krążenia (minuty), której istota polega między innymi na zmianie czynności serca, udział biorą głównie β1-AR poprzez aktywację szlaku kinazy białkowej A. Wynika to z ilościowej przewagi β1-AR nad β2-AR oraz faktu, że β1-AR mają większe powinowactwo do agonistów niż pozostałe β-AR. Wypadkowym efektem krótkotrwałej stymulacji współczulnej serca są: wzrost siły skurczu miokardium, przyspieszenie rozkurczu, przyspieszenie częstości rytmu zatokowego i zwiększenie szybkości przewodzenia w węźle AV. Aktywacja β2-AR i β3-AR służy głównie jako mechanizm ograniczający skutki nadmiernej aktywacji β1-AR, poprzez desensytyzację i tzw. down-regulację β1-AR. Przedłużająca się aktywacja współczulna skutkuje aktywacją dodatkowych ścieżek sygnalizacyjnych prowadzących do przerostu mięśnia sercowego. W przypadku regularnego treningu sportowego aktywowane są szlaki skutkujące blokowaniem apoptozy i tzw. przerostem fizjologicznym (poprzez aktywację β2-AR i szlaki „pro-life”), a w przypadku niewydolności krążenia (NS) dodatkowo szlaki skutkujące przyspieszoną apoptozą i tzw. przerostem patologicznym (poprzez aktywację β1-AR i szlaki „pro-death”). W NS ekspresja i aktywność β1-AR w sercu są obniżone, co z jednej strony chroni je przed nadmierną stymulacją współczulną, a z drugiej – ogranicza możliwość wzrostu rzutu minutowego serca podczas wysiłku i w różnych sytuacjach stresowych.
STRUKTURA RECEPTORÓW GPCR
W ludzkim organizmie wykryto kilkaset receptorów GPCR. Białka te są zbudowane z pojedynczego łańcucha polipeptydowego o pofałdowanej strukturze, który siedmiokrotnie przenika błonę komórkową, tworząc w jej rdzeniu domenę hydrofobową oraz pozabłonowe domeny: zewnątrz- i wewnątrzkomórkową. Domena wewnątrzbłonowa zbudowana jest z α-helis (oznaczonych symbolami TM1-TM7, licząc od N-końca), których wzajemne ułożenie tworzy okrągły lub lejkowaty kształt. Helisy połączone są ze sobą pętlami wystającymi ponad błonę – do cytozolu i na zewnątrz komórki. Domena wewnątrzkomórkowa receptora tworzona jest przez pętle ICL1-ICL3 (ang. intracellular loop) eksponowane do wnętrza komórki oraz C-koniec łańcucha polipeptydowego. Pętla ICL3, łącząca helisy błonowe TM5 z TM6, wspólnie z pętlą ICL2 oraz fragmentem C-końca tworzy miejsce wiązania i aktywacji białka G. Domena zewnątrzkomórkowa tworzona jest przez pętle ECL1-ECL3 znajdujące się poza cytozolem (ang. extracellular loop) oraz przez N-koniec białka. W części zewnątrzkomórkowej receptora zachodzi wiązanie ligandów. Wejście dla nich znajduje się pomiędzy pętlą ECL3 a połączonymi pętlami ECL1 i ECL2 (które tworzą przykrywkę nad miejscem wiązania ligandu). Budowa domeny zewnątrzkomórkowej może różnić się w szczegółach pomiędzy różnymi receptorami, jednak ogólny schemat jest wspólny (1, 3-5).
Części wewnątrz- i zewnątrzkomórkowa receptora mogą ulegać modyfikacjom potranslacyjnym. W części zewnątrzkomórkowej mogą powstawać mostki siarczkowe stabilizujące strukturę przestrzenną receptora. W β-AR mostki spinające pętlę ECL3 otwierają większy dostęp ligandów do kieszeni receptora. Część wewnątrzkomórkowa może ulegać glikozylacji, mirystylacji i palmitynizacji lub może przyłączać cząsteczki cholesterolu. Modyfikacje te mają znaczenie w kierowaniu receptora do miejsc w błonie komórkowej bogatej w kaweole lub tratwy lipidowe. Dodatkowo, okolice C-końca bogate w serynę i treoninę mogą być fosforyzowane przez odpowiednie kinazy, co skutkuje inaktywacją receptora (vide poniżej) (4).
MECHANIZM TRANSDUKCJI SYGNAŁU GPCR
Po przyłączeniu się liganda do receptora następuje zmiana konformacyjna całego receptora. Polega to na takiej zmianie ułożenia przestrzennego helis transbłonowych, że możliwe staje się związanie białka G z wewnętrzną domeną receptora. Następuje aktywacja białka G, która skutkuje zmianą aktywności wewnątrzkomórkowego białka efektorowego (najczęściej kinazy białkowej lub kanału jonowego) i zmiana komórkowego poziomu substancji pełniącej funkcję przekaźnika informacji drugiego rzędu (np. cAMP). Jednorazowa aktywacja receptora skutkuje aktywacją wielu kopii białka G, co powoduje wzmocnienie sygnału. Transmisję sygnału blokuje fosforylacja receptora przez odpowiednie kinazy (vide poniżej) (3, 4, 6, 7).
Białko G jest heterotrimerem i składa się z podjednostek α, β i γ (istnieją także białka G0 o budowie monomerycznej). Podjednostka α wiąże nukleotyd guanylowy (GTP) i ma aktywność GTP-azy. Natomiast β i γ tworzą niepodzielny kompleks, który łączy się z nieaktywną podjednostką α. Zaktywowane białko G zmienia konformację i cząsteczka GDP związana z podjednostką α jest wymieniana na GTP z cytozolu, co umożliwia odłączenie podjednostki α od kompleksu βγ. Białko G podzielone na komponenty α i βγ przekazuje sygnał na białko efektorowe (np. cyklazę adenylową), czemu towarzyszy hydroliza GTP do GDP i nieaktywna podjednostka α odnawia wiązanie z kompleksem βγ (5, 7-9).
Istnieje kilka izoform białka G (Gs, Gi, Gt, Gq(p), G0) różniących się białkiem efektorowym, z którym wchodzą w interakcję. Białko Gs aktywuje cyklazę adenylową, która produkuje cAMP (7-10). Gi hamuje cyklazę adenylową i zmniejsza produkcję cAMP (7-10). Gq(p) aktywuje fosfolipazę C, której produktami są diacyloglicerol (DAG) i trifosforan inozytolu (IP3). Gt aktywuje fosfodiesterazę, a białko G0 hamuje kanały wapniowe (7, 9).
Obok podjednostki α także kompleks βγ ma działanie sygnalizacyjne. Aktywuje mianowicie kinazę receptorów GPCR (GRK), która fosforylując białko receptorowe, skutkuje zahamowaniem aktywności receptora, co jest mechanizmem zabezpieczającym przed nadmierną aktywacją receptora (vide poniżej) (7, 11). Kompleks βγ bierze również udział w receptorowej aktywacji kanałów wapniowych i niektórych potasowych (7-9).
WPŁYW LIGANDÓW NA AKTYWNOŚĆ RECEPTORA
Receptory GPCR są często przedstawiane w ujęciu bimodalnym. Zakłada ono, że receptor może występować tylko w jednym z dwóch stanów – może być w stanie aktywnym, w którym miejsce wiązania białka G jest odsłonięte, albo w stanie nieaktywnym, w którym miejsce wiązania białka G jest zakryte. Wbrew tej koncepcji, niektóre receptory GPCR, w tym β-AR, wykazują pewną podstawową aktywność nawet pod nieobecność agonisty. Okazuje się ponadto, że podstawowa aktywność receptorów może być regulowana przez ligandy. W tym kontekście wyróżnia się: a) pełnych agonistów – czyli ligandy skutkujące maksymalną aktywacją receptora, b) częściowych agonistów – czyli ligandy, które nawet w stężeniach wysycających receptor skutkują jedynie submaksymalną aktywację białka G oraz c) odwrotnych agonistów – czyli ligandy, które hamują podstawową aktywność receptora. Natomiast antagoniści nie modyfikują aktywności samego receptora, a jedynie kompetencyjnie blokują wiązanie z nim innych ligandów (2, 4, 12). Interakcja liganda z receptorem może odbywać się na dwa sposoby. Agonista może skutkować zmianą konformacji receptora poprzez proste zakłócenie oddziaływań istniejących wewnątrz jego cząsteczki i kreując zestaw oddziaływań stabilizujących nowy stan konformacyjny lub też może służyć jako mostek, który bierze udział w powstawaniu nowych interakcji pomiędzy domenami transbłonowymi i stabilizuje bardziej aktywną konformację receptora (2, 12).
SERCOWE EFEKTY NATYCHMIASTOWEJ AKTYWACJI β-AR
W sercu obecne są receptory adrenergiczne β1, β2 i β3 (β-AR). Agonistami β-AR w sercu są mediatory układu współczulnego: noradrenalina – uwalniana z zakończeń nerwowych sercowych włókien współczulnych, oraz adrenalina – uwalniana z rdzenia nadnerczy. W zdrowym sercu stosunek gęstości β1-AR do β2-AR wynosi 70-80%/20-30%. Dodatkowo, największe powinowactwo do agonistów mają β1-AR, a najmniejsze β3-AR (około 100 razy mniejsze). Razem wziąwszy, oznacza to, że przy umiarkowanym poziomie aktywacji współczulnej pobudzeniu ulegają głównie β1-AR i że dwa pozostałe β-AR włączają się dopiero w stanach znacznie zwiększonej aktywacji współczulnej.
Receptory β-adrenergiczne są (ryc. 1):
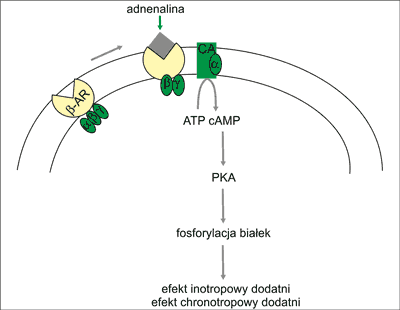
Ryc. 1. Schemat przekazywania sygnału przez receptory β-ad-renergiczne.
β-AR – receptor adrenergiczny β; α, β, γ – podjednostki białka G; CA – cyklaza adenylowa; ATP – adenozyno-trifosforan; cAMP – cykliczny adenozyno-monofosforan; PKA – kinaza białkowa A
1. Sprzężone z białkiem Gs (heterotrimer αsβγ) i/lub białkiem Gi (heterotrimer αiβγ); podjednostka αs aktywuje cyklazę adenylową i produkcję cAMP, a podjednostka αi enzym ten hamuje.
2. Białkiem efektorowym szlaku β-AR w sercu są: a) enzym cyklaza adenylowa, który przekształca ATP w cykliczny adenozyno-mono-fosforan (cAMP) oraz b) kanał wapniowy typu L.
3. Drugorzędowymi przekaźnikami w ścieżce sygnalizacyjnej β-AR w sercu są cAMP oraz jony Ca2+.
4. Kinazami aktywowanymi przez ścieżkę β-AR są: a) kinaza białkowa A (PKA) aktywowana przez cAMP; PKA przenosi resztę fosforanową z ATP na serynę, treoninę lub tyrozynę różnych białek i w ten sposób zmienia ich właściwości, w tym właściwości białek zaangażowanych w skurcz bądź rozkurcz kardiomiocytów, częstość pobudzeń wytwarzanych w węźle zatokowo-przedsionkowym, szybkość przewodzenia w łączu AV oraz metabolizm komórki (ryc. 2) oraz b) kinaza aktywowana przez kompleks Ca2+-kalmodulina (CaMKII). Kinaza ta fosforyluje niektóre białka komórkowego obiegu jonów Ca2+ i w ten sposób uczestniczy w natychmiastowej regulacji pracy serca. Aktywuje także proprzerostowy szlak kalcyneuryny (ryc. 3).
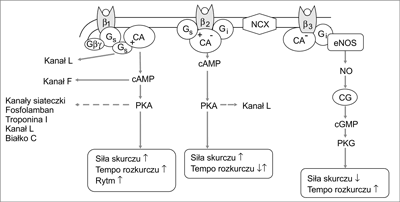
Ryc. 2. Szlaki aktywowane stymulacją typów receptorów adrenergicznych β1, β2 i β3 (objaśnienia skrótów w tekście).
Ryc. 3. Mechanizmy zabezpieczające komórkę przed nadmierną stymulacją katecholaminową. Sekwencja wydarzeń obejmuje: (1) aktywację β-AR; (2) fosforylację β-AR przez β-ARK; (3) blokowanie interakcji β-AR-białko Gs przez β-arrestynę; (4) internalizację β-AR w mechanizmie ich endocytozy oraz (5) β-ARK zamknięty w endosomie jest albo magazynowany w cytoplazmie, albo wraca na powierzchnię błony, albo ulega degradacji w lizosomach.
Receptory β1
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Nygaard R, Frimurer TM, Holst B et al.: Ligand binding and micro-switches in 7TM receptor structures. Trends Pharmacol Sci 2009; 30: 249-259.
2. Kobilka BK, Deupi X: Conformational complexity of G-protein-coupled receptors. Trends Pharmacol Sci 2007; 28: 397-406.
3. Schertler G: Structure of rhodopsin and the metarhodopsin I photointermediate. Curr Opin Struct Biol 2005; 15: 408-415.
4. Kobilka BK, Schertler G: New G-protein-coupled receptor crystal structures: insights and limitations. Trends Pharmacol Sci 2008; 29: 79-83.
5. Kobilka BK: G protein coupled receptor structure and activation. Biochim Biophys Acta 2007; 1768: 794-807.
6. Soubias O, Gawrisch K: The role of the lipid matrix for structure and function of the GPCR rhodopsin. Biochim Biophys Acta 2012; 1818: 234-240.
7. Traczyk W, Trzebski A: Fizjologia człowieka z elementami fizjologii stosowanej i klinicznej. Wydawnictwo Lekarskie PZWL, Warszawa 2004.
8. Hoyer D, Bartfai T: Neuropeptides and Neuropeptide Receptors: Drug Targets, and Peptide and Non-Peptide Ligands: a tribute to Prof. Dieter Seebach. Chemistry & Biodiversity 2012; 9: 2367-2387.
9. Lefkowitz RJ: Historical review: A brief history and personal retrospective of seven-transmembrane receptors. Trends Pharmacol Sci 2004; 25: 413-422.
10. Lefkowitz RJ: Heterogeneity of adenylate cyclase-coupled ß-adrenergic receptors. Biochem Pharmacol 1975; 24: 583-590.
11. Whalen EJ, Foster MW, Matsumoto A et al.: Regulation of ß Adrenergic Receptor Signaling by S-Nitrosylation of G-Protein-Coupled Receptor Kinase 2. Cell 2007; 129: 511-522.
12. Zocher M, Fung JJ, Kobilka BK: Ligand-Specific Interactions Modulate Kinetic, Energetic, and Mechanical Properties of the Human ß2 Adrenergic Receptor. Structure 2012; 20: 1391-1402.
13. Mackiewicz U, Klemenska E, Beręsewicz A: Receptory beta-adrenergiczne w zdrowym i niewydolnym sercu. Kardiol Pol 2007; 65: 368-375.
14. Molenaar P, Parsonage WA: Fundamental considerations of beta-adrenoreceptor subtypes in human heart failure. Trends Pharmacol Sci 2005; 26: 368-375.
15. Zhu WZ, Zheng M, Koch WJ et al.: Dual modulation of cell survival and cell death by beta(2)-adrenergic signaling in adult mouse cardiac myocytes. Proc Natl Acad Sci U S A 2001; 98: 1607-1612.
16. Razeghi P, Young ME, Alcorn JL et al.: Metabolic Gene Expression in Fetal and Failing Human Heart. Circulation 2001; 104: 2923-2931.
17. Marks AR: Ryanodine receptors, FKBP12, and heart failure. Front Biosci 2002; 7: d970-d97.
18. Doi M, Yano M, Kobayashi S et al.: Propranolol prevents the development of heart failure by restoring FKBP12.6-mediated stabilization of ryanodine receptor. Circulation 2002; 105: 1374-1379.



