© Borgis - Postępy Fitoterapii 4/2015, s. 223-236
*Magdalena Borusiewicz, Zbigniew Janeczko
Nigella sativa L. – roślinny surowiec o właściwościach plejotropowych
Nigella sativa L. – plant with the pleiotropic features
Katedra i Zakład Farmakognozji, Wydział Farmaceutyczny, Uniwersytet Jagielloński, Collegium Medicum w Krakowie
Kierownik Katedry i Zakładu: prof. dr hab. Zbigniew Janeczko
Summary
Nigella sativa is a widely used medicinal plant throughout the world. It has got the place among the top ranked evidence based herbal medicines. This is also revealed that most of the therapeutic properties of this plant are due to the presence of thymoquinone which is major bioactive component of the essential oil. This review mainly focuses on the pharmacological action of seed extracts, oils and active constituents for their wide spectrum biological properties such as antioxidant, antidiabetic, antimicrobial, anticancerous, etc. It has been widely used as antihypertensive, liver tonics, diuretics, digestive, anti-diarrheal, appetite stimulant, analgesics, antibacterial and in skin disorders. Extensive studies on N. sativa have been carried out by various researchers and a wide spectrum of its pharmacological actions have been explored. The present review is therefore an effort to give a survey of literature on phytochemistry and pharmacological activities of N. sativa.

Wprowadzenie
Od wieków tradycyjna medycyna stosowała wiele roślin leczniczych, wykorzystując je w terapii chorób różnego pochodzenia. Ze względu na powszechną opinię, iż są one bezpieczniejsze w porównaniu z nowoczesnymi lekami syntetycznymi, rośliny są również powszechnie stosowane do wytwarzania leków ziołowych. Wiele grup badawczych ogniskuje swoje badania na roślinnych surowcach leczniczych, ponieważ nie wszystkie gatunki zostały dotychczas dokładnie zbadane pod kątem ich właściwości terapeutycznych, mechanizmów molekularnych ich działania oraz bezpieczeństwa i działania toksycznego na organizm człowieka.
Wśród dobrze poznanych roślin o udowodnionym potencjale prozdrowotnym Nigella sativa (ryc. 1) zajmuje wysoką pozycję, jako obiecujący surowiec leczniczy. Liczne doniesienia naukowe wskazują na jej szerokie spektrum właściwości farmakologicznych. Nigella sativa jest powszechnie znana jako czarnuszka siewna, czarnuszka ogrodowa lub czarny kmin (ang. black cumin). Występuje w Europie Południowej, Afryce Północnej oraz Azji Południowo-Zachodniej i jest uprawiana w wielu krajach na świecie, m.in. w obszarze Morza Śródziemnego, we wschodniej i południowej Europie, w Indiach, Pakistanie, Syrii, Turcji i Arabii Saudyjskiej (1). Nasiona N. sativa (ryc. 2), a także wytwarzany z nich olej były szeroko stosowane w leczeniu różnych chorób związanych z układem oddechowym (w tym chorób zakaźnych), prawidłowym funkcjonowaniem żołądka, jelit, wątroby, nerek, krążenia i systemu immunologicznego oraz dla ogólnej poprawy samopoczucia (2). Wśród muzułmanów nasiona oraz olej z czarnuszki nadal uważane są za jedne z najważniejszych dostępnych środków leczniczych. Są tradycyjnie używane w południowo-wschodniej Azji oraz krajach Bliskiego Wschodu w leczeniu wielu chorób, takich jak astma, zapalenie oskrzeli, reumatyzm oraz w różnych stanach zapalnych. Określane są jako ziarna błogosławieństwa (Habbatul Barakah).

Ryc. 1. Kwitnąca czarnuszka siewna (zdj. Anna Szałankiewicz).

Ryc. 2. Nasiona czarnuszki siewnej (Nigella sativa) (zdj. Anna Szałankiewicz).
Nalewka wytwarzana z nasion jest stosowana w przypadkach niestrawności, braku apetytu, biegunkach, a także w różnego rodzaju wykwitach skórnych. Olej z nasion czarnuszki stosuje się jako środek antyseptyczny oraz jako miejscowy środek znieczulający. Palone nasiona są podawane dla powstrzymania wymiotów (3-6). W licznych badaniach naukowych N. sativa została dokładnie zbadana pod kątem aktywności biologicznej i potencjalnego działania terapeutycznego. Wykazano, że nasiona mają szerokie spektrum właściwości, włączając w to aktywność: diuretyczną, obniżającą ciśnienie, przeciwcukrzycową, przeciwnowotworową, immunomodulującą, przeciwbólową, przeciwbakteryjną, przeciwzapalną, przeciwutleniającą, a także powodują rozszerzanie oskrzeli, chronią żołądek, wątrobę i nerki (7-11).
Nasiona i olej z czarnuszki, ze względu na niski poziomem toksyczności, znajdują także zastosowanie w przemyśle spożywczym jako przyprawa do aromatyzowania ciast, pieczywa, marynat oraz jako środek konserwujący (3, 12).
Skład chemiczny nasion czarnuszki siewnej
W licznych pracach badawczych zostało wyizolowanych i zidentyfikowanych wiele związków aktywnych obecnych w nasionach czarnuszki siewnej. Badania przeprowadzone w celu określenia składu nasion czarnuszki potwierdziły obecność oleju roślinnego, białek, alkaloidów, saponin, flawonoidów i olejku eterycznego. W zależności od pochodzenia surowca roślinnego skład olejku może się różnić, jednak najważniejszymi związkami czynnymi są: tymochinon (30-48%), tymohydrochinon, ditymochinon, p-cymen (7-15%), karwakrol (6-12%), 4-terpineol (2-7%), t-anetol (1-4%), α-pinen i tymol. Potwierdzona została także obecność innych składników olejku eterycznego, takich jak karwon, limonen i cytronelol.
Nasiona zawierają alkaloidy izochinolinowe (nigellinę oraz nigelliminę), alkaloidy diterpenowe (nigellaminę) oraz indazolowe (nigellidynę oraz nigellicynę). Ponadto w ich składzie znajdują się pentacykliczne saponiny triterpenowe, na przykład α-hederyna o potencjalnej aktywności przeciwnowotworowej (13, 14).
Potwierdzono, iż nasiona bogate są w nienasycone kwasy tłuszczowe, głównie kwas linolowy (50-60%), oleinowy (20%) i eikozadienowy (3%). Zawartość nasyconych kwasów tłuszczowych (kwasu palmitynowego i stearynowego) wynosi około 30%. Głównym związkiem steroidowym jest α-sitosterol, który w tunezyjskiej i irańskiej odmianie stanowi odpowiednio 44 i 54% steroli, oraz stigmasterol, którego zawartość w nasionach waha się w zakresie od 6,57 do 20,92% sumy steroli (15-17). Oprócz tego nasiona czarnuszki są bogatym źródłem witamin (tokoferole) i soli mineralnych (Fe, Ca, K, Zn, P i Cu) (18, 19).
Większość udowodnionych efektów farmakologicznych przypisuje się chinonowym składnikom nasion czarnuszki, z czego największą część stanowi tymochinon (ryc. 3). Wykazuje on działanie przeciwdrgawkowe (20-22), przeciwutleniające (23), przeciwzapalne (24), przeciwnowotworowe (25), przeciwbakteryjne (26) i przeciwgrzybicze (27).
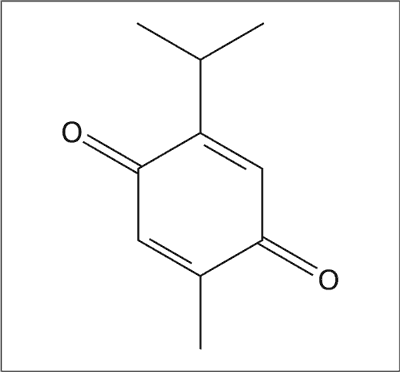
Ryc. 3. Struktura chemiczna tymochinonu.
Badania naukowe i potencjał farmakologiczny czarnuszki siewnej
Związki pochodzenia naturalnego były przez długi czas jedynymi lekami dostępnymi dla człowieka i nadal odgrywają dużą rolę w lecznictwie. Nigella sativa była wielokrotnie testowana przez niezależne grupy badawcze. Ponieważ czarnuszka siewna uważana jest za ważny surowiec o plejotropowych właściwościach farmakologicznych, stanowi ona przedmiot badań wykorzystujących nowoczesne techniki analityczne. Jest to w wielu przypadkach konsekwencją wyczerpywania się możliwości leczenia ciężkich chorób, na przykład zakażeń bakteryjnych, w wyniku rosnącej oporności szczepów klinicznych na powszechnie znane antybiotyki. Niniejszy artykuł omawia możliwości wykorzystania terapeutycznego czarnuszki siewnej w oparciu o najnowsze wyniki badań naukowych.
Aktywność przeciwbakteryjna
Właściwości przeciwbakteryjne związków i substancji roślinnych były znane od czasów starożytnych, natomiast próby badania ich właściwości antybiotycznych w warunkach laboratoryjnych rozpoczęły na początku XX wieku (28). Z uwagi na rosnącą oporność drobnoustrojów chorobotwórczych na najczęściej stosowane antybiotyki, próby znalezienia nowych skutecznych środków do zwalczania zakażeń wywołanych drobnoustrojami stanowią duże wyzwanie dla ośrodków badawczych.
Mechanizm działania przeciwdrobnoustrojowego nasion N. sativa nie został dotychczas udowodniony, jednak jego przeciwbakteryjne działanie przypisuje się głównie składnikom chinonowym (tymochinonowi) (29). Tymochinon ma potwierdzone działanie przeciwbakteryjne i może wzmacniać działanie antybiotyków, zwłaszcza w przypadku zakażeń Staphylococcus aureus. Aktywność przeciwbakteryjną wyciągu z nasion czarnuszki badano metodą dyfuzyjno-krążkową, wykorzystującą krążki z bibuły nasączane wyciągiem z surowca. Wyraźne zahamowanie wzrostu S. aureus zaobserwowano przy stężeniu 300 mg/ml, porównując wyniki z wodą destylowaną oraz z azytromycyną, użytymi jako kontrole. Lepsze wyniki udało się uzyskać dla nasion pochodzących z Hadramout (Jemen), niż dla nasion pochodzących z Etiopii, jednakże jedne i drugie sugerują ich wyraźną aktywność.
Zaobserwowano także działanie na drobnoustroje ekstraktu eterowo-etylowego z czarnuszki. Hamował on w stężeniu 25-400 μg/krążek wzrost szczepów bakterii Gram-dodatnich (Staphylococcus aureus) i Gram-ujemnych (Pseudomonas aeruginosa, Escherichia coli) oraz grzybów drożdżoidalnych (Candida albicans). Badania te wykazały synergistyczne działanie tego wyciągu ze streptomycyną i gentamycyną, a także wzmocnienie działania przeciwbakteryjnego wyciągu z doksycykliną, spektynomycyną, erytromycyną, tobramycyną, ampicyliną, chloramfenikolem, kwasem nalidyksowym, linkomycyną i kotrimoksazolem (30). Tymochinon także wykazywał skuteczne działanie wobec bakterii Staphylococcus aureus i innych Gram-dodatnich ziarniaków, w tym S. epidermidis (wartości MIC w zakresie 8-32 μg/ml) (31). Aktywność etanolowego ekstraktu z N. sativa (w stężeniu 4 mg/krążek) wobec szczepów klinicznych gronkowca złocistego (S. aureus) opornych na metycylinę potwierdzono również w badaniach z użyciem seryjnych rozcieńczeń w podłożu, otrzymując zakres wartości MIC wynoszący 0,2-0,5 mg/ml (32).
Wykazano ponadto skuteczność działania wyciągów z nasion N. sativa wobec Helicobacter pylori u pacjentów z dyspepsją niewrzodową, porównywalną z dotychczas stosowaną tzw. potrójną terapią, opartą na lewofloksacynie i amoksycylinie (33). Helicobacter pylori jest Gram-ujemnym spiralnym drobnoustrojem zaopatrzonym w rzęski, bytującym na powierzchni komórek nabłonkowych błony śluzowej w części przedodźwiernikowej żołądka (34).
Olej z nasion N. sativa wykazał silne działanie przeciwbakteryjne wobec wszystkich szczepów Listeria monocytogenes, wykazując większe strefy zahamowania wzrostu mikroorganizmów, niż w przypadku zastosowania gentamycyny. Średnie strefy zahamowania wzrostu omawianego drobnoustroju wynosiły odpowiednio 31,5 i 14,8 mm (35).
W innym badaniu, mającym na celu określenie wartości MIC dla tymochinonu, największą aktywność zaobserwowano wobec szczepu Streptococcus constellatus (MIC = 4 μg/ml). Natomiast olejek z nasion N. sativa wykazał najsilniejszą aktywność przeciwko szczepom: Streptococcus mitis, Streptococcus mutans, Streptococcus constellatus i Gemella haemolysans (MIC = 2,13 mg/ml), ale nie był skuteczny wobec szczepów bakterii Enterococcus faecalis oraz Enterococcus faecium (MIC > 8,5 mg/ml) (36). Te same szczepy zbadano także metodą dyfuzyjno-krążkową. Tymochinon (150 μg/krążek) okazał się skuteczny wobec S. mutans i S. mitis (strefy hamowania wzrostu: 24,5 i 22 mm), jednak wykazywał słabe działanie wobec E. faecalis, E. faecium oraz Streptococcus salivarius (strefy hamowania wzrostu: 9,0; 9,5 i 9,5 mm). Olejek eteryczny (2,43 mg/krążek) wykazał z kolei silne działanie przeciw S. mitis, Streptococcus oralis, S. mutans, S. constellatus oraz G. haemolysans (strefy hamowania wzrostu: 13,5-15,5 mm), natomiast okazał się nieskuteczny wobec E. faecalis, E. faecium i S. salivarius (36).
Wodny ekstrakt z nasion N. sativa wykazał słabsze działanie przeciwbakteryjne w stosunku do ekstraktu metanolowego (37). Ekstrakt metanolowy w stężeniu 20 mg/ml skutecznie hamował wzrost Streptococcus pyogenes (strefa hamowania wzrostu: 10 mm), natomiast w stężeniu 100 mg/ml również okazał się skuteczny wobec Streptococcus pneumoniae, Pseudomonas aeruginosa i Proteus vulgaris (strefa hamowania wzrostu: 15 mm). Ekstrakt wodny w stężeniu 100 mg/ml wykazał natomiast zahamowanie wzrostu bakterii P. aeruginosa (20 mm), S. pyogenes (15 mm), jednak w stężeniu 50 mg/ml wykazał tylko niewielką aktywność przeciwko S. pyogenes (10 mm), Klebsiella pneumoniae (11 mm) oraz P. vulgaris (12 mm).
W jednym z badań zsyntetyzowano na drodze kopolimeryzacji rodnikowej termoczułe micele, jako system do kontrolowanego uwalniania ekstraktu z czarnuszki N. sativa. W badaniach oszacowano działanie przeciwbakteryjne tak przygotowanego układu. Okazało się, że ekstrakt z nasion czarnuszki, będący wewnątrz polimerowych miceli, wykazał skuteczność wobec bakterii Gram-dodatnich, takich jak S. aureus oraz Bacillus subtilis, a także wobec bakterii Gram-ujemnych – Escherichia coli. Badania te sugerują, że termoczułe systemy uwalniania leków mogą być wykorzystane w praktyce w stanach zakażenia organizmu drobnoustrojami chorobotwórczymi i przy podwyższonej temperaturze (38).
W badaniach in vivo na zwierzętach wykazano, że olejek eteryczny, a także metanolowe i chloroformowe ekstrakty z nasion N. sativa wywoływały zależne od dawki działanie przeciwbakteryjne wobec S. aureus oraz E. coli (39). Odmiedniczkowe zapalenie nerek jest chorobą, w przebiegu której w wyniku stanu zapalnego dochodzi do uszkodzenia tkanki śródmiąższowej nerek i komórek kanalików nerkowych. Aby ocenić, czy ochronna terapia tymochinonem przed zakażeniem bakterią E. coli lub podczas niego może zapobiec utleniającemu uszkodzeniu nerek, zastosowano doświadczalny model szczurzy. Tymochinon wstrzykiwano dootrzewnowo (10 mg/kg) 24 godziny przed zakażeniem bakteriami i powtarzano proces w odstępach 24-godzinnych. Badania wykazały, że związek ten zmniejszył efekty utleniającego uszkodzenia nerek, hamując uwalnianie wolnych rodników. Efekt ochronny potwierdzono badaniem histologicznym i przypisano właściwości przeciwutleniające głównemu składnikowi wchodzącemu w skład nasion czarnuszki siewnej (40).
Ekstrakt z nasion N. sativa wykorzystano także w badaniach in vivo i in vitro, określając jego wpływ na bakterie powodujące zapalenie gruczołu sutkowego u krów. Krowy, u których klinicznie potwierdzono zapalenie tego gruczołu, leczono poprzez lokalne wstrzyknięcie ekstraktu. Natomiast do badania in vitro wykorzystano bakterie pobrane bezpośrednio z chorej tkanki. Wyniki obu badań potwierdziły silne działanie przeciwbakteryjne ekstraktu z nasion czarnuszki siewnej (41).
Aktywność przeciwgrzybicza
Aktywność eterowego ekstraktu z nasion N. sativa w odniesieniu do 8 gatunków dermatofitów (4 szczepy Trichophyton rubrum oraz po jednym szczepie Trichophyton interdigitale, Trichophyton mentagrophytes, Epidermophyton floccosum oraz Microsporum canis) badano metodą seryjnych rozcieńczeń. W badaniach wykorzystano także tymochinon oraz gryzeofulwinę. Wartości MIC dla całego ekstraktu wahały się w zakresie 10-40 mg/ml, natomiast w przypadku tymochinonu i gryzeofulwiny wartości MIC osiągały odpowiednio 0,125-0,250 mg/ml oraz 0,00095-0,01550 mg/ml. Wyniki te pozwalają na stwierdzenie, że nasiona czarnuszki siewnej są wartościowym źródłem związków mogących znaleźć wykorzystanie w leczeniu grzybiczych zakażeń skóry (42).
Istnieją doniesienia na temat możliwości skutecznego wykorzystania tymochinonu oraz tymohydrochinonu, izolowanych z N. sativa, jako silnie działających środków przeciw grzybom drożdżoidalnym. Mogą one być wykorzystywane w przemyśle mleczarskim jako środki konserwujące pochodzenia naturalnego. Aktywność przeciwgrzybiczą obu chinonów porównano z najczęściej stosowanymi w produktach mlecznych środkami konserwującymi, a mianowicie natamycyną, propionianem wapnia i sorbinianem potasu w dwóch zakresach pH (4,0 i 5,5). Stwierdzono, że zarówno tymochinon, jak i tymohydrochinon wykazały znaczną aktywność grzybobójczą. Dla związków tych uzyskano wartości MIC w zakresie od 8 do 128 μg/ml (43).
Zbadano wzrost Aspergillus parasiticus i Aspergillus flavus, a także proces wytwarzania aflatoksyny B1 przez te szczepy pod wpływem oleju z nasion N. sativa. Badania wykazały, że w obecności różnych stężeń tego oleju (1, 2 i 3 ml/100 ml podłoża) nastąpiło hamowanie wytwarzania aflatoksyny B1 przez szczep A. parasiticus w granicach odpowiednio 48-58% oraz przez szczep A. flavus w granicach 32-48%. Przyjmuje się, że olej z nasion N. sativa może mieć wpływ na szlaki metaboliczne biosyntezy aflatoksyny (44).
Badania olejku eterycznego pochodzącego z N. sativa wykazały jego znaczącą aktywność wobec dermatofitów Microsporum gypseum, Trichophyton rubrum oraz Trichophyton simii. Olejek ten okazał się także równie skuteczny przeciwko Chrysosporium tropicum i Chrysosporium evolceanui, jak standardowo stosowany w dermatologii ketokonazol (45).
Przy użyciu standardowych diagnostycznych testów mikologicznych wyizolowano i przebadano 20 szczepów Candida albicans pobranych bezpośrednio od hospitalizowanych pacjentów. Najsilniejsze działanie przeciwgrzybicze wykazał ekstrakt metanolowy z nasion N. sativa. Równie skuteczny okazał się ekstrakt chloroformowy, natomiast ekstrakty wodne nie wykazały żadnej aktywności przeciwgrzybiczej (46). Do innych wniosków doszli natomiast Khan i wsp. (47), lecząc myszy wodnym ekstraktem z nasion czarnuszki. Wewnątrznaczyniowe zakażenie organizmu szczepem Candida albicans powoduje wytwarzanie ognisk zapalnych w wątrobie, śledzionie i nerkach. Po 24 godzinach leczenie wodnym ekstraktem (6,6 ml/kg na dobę) spowodowało widoczne zahamowanie wzrostu grzybów drożdżoidalnych we wszystkich badanych narządach. Przypuszcza się, że ekstrakt z nasion N. sativa zawiera aktywne składniki, które mogą bezpośrednio stymulować granulocyty i monocyty do wytwarzania NO hamującego rozwój C. albicans (47, 48).
Przeprowadzono także badanie w celu oceny wpływu tymochinonu na kandydozę pochwy u myszy z upośledzoną odpornością. Myszom na 1 i 3 dni przed zakażeniem podawano podskórnie prednizolon metylu w dawce 150 mg/kg. Następnie do pochwy zwierząt wprowadzano zawiesinę C. albicans i po 5 dniach rozpoczynano leczenie kremem z tymochinonem. Po 6 dniach wykazano spadek liczby kolonii C. albicans w porównaniu do grupy kontrolnej. Zmniejszenie zakażenia występowało proporcjonalnie do stężenia tymochinonu w kremie. Zastosowanie kremu z zawartością 10% tymochinonu skutkowało zabiciem większości komórek C. albicans. Mechanizm tego dziania przypisuje się procesowi inaktywacji białek w błonie plazmatycznej omawianego drobnoustroju. Należy przy tym wspomnieć, iż tymochinon nie powodował żadnego negatywnego wpływu na komórki mysiego organizmu (27).
Aktywność przeciwpasożytnicza
Omówiono wpływ czarnuszki siewnej na niektóre pasożyty człowieka, a mianowicie przywry z rodzaju Schistosoma, jaja tasiemca i zarodźce malarii. Schistosomatoza, obok malarii, jest najpoważniejszym w skali światowej parazytologicznym problemem zdrowotnym. Jest to grupa chorób pasożytniczych wywoływanych przez rozdzielnopłciowe przywry z rodzaju Schistosoma (Schistosoma haematobium, S. mansoni, S. intercalatum, S. japonicum i S. mekongi), występujące na kontynencie afrykańskim, na wschodnich wybrzeżach Ameryki Południowej, w Azji Południowo-Wschodniej i na Bliskim Wschodzie (49).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Khare CP. Encyclopedia of Indian medicinal plants. Springes-Verlag, New York 2004. 2. Al-Jabre S, Al-Akloby OM, Al-Qurashi A i wsp. Thymoquinone, an active principle of Nigella sativa, inhibited Aspergillus niger. Pak J Med Res 2003; 42(3):102-4. 3. Warrier PK, Nambiar VPK, Ramankutty. Indian medicinal plants – a compendium of 500 species. Orient Longman Pvt Ltd, Chennai 2004; 139-42. 4. Sharma PC, Yelne MB, Dennis TJ. Database on medicinal plants used in Ayurveda. New Delhi 2005; 420-40. 5. Yarnell E, Abascal K. Nigella sativa: holy herb of the middle East. Altern Compl Therap 2011; 17(2):99-105. 6. Padhye S, Banerjee S, Ahmad A i wsp. From here to eternity-the secret of Pharaohs: Therapeutic potential of black cumin seeds and beyond. Cancer Ther 2008; 6: 495-510. 7. Abel-Salam BK. Immunomodulatory effects of black seeds and garlic on alloxan-induced diabetes in albino rat. Allergol Immunopathol (Madr) 2012; 40(6):336-40. 8. Khaled AAS. Gastroprotective effects of Nigella sativa oil on the formation of stress gastritis in hypothyroidal rats. Int J Physiol Pathophysiol Pharmacol 2009; 1:143-9. 9. Assayed ME. Radioprotective effects of black seed (Nigella sativa) oil against hemopoietic damage and immunosuppression in gamma-irradiated rats. Immunopharmacol Immunotoxicol 2010; 32(2):284-96. 10. Abdel-Zaher AO, Abdel-Rahman MS, Elwasei FM. Protective effect of Nigella sativa oil against tramadol-induced tolerance and dependence in mice: role of nitric oxide and oxidative stress. Neurotoxicology 2011; 32(6):725-33. 11. Boskabady MH, Mohsenpoor N, Takaloo L. Antiasthmatic effect of Nigella sativa in airways of asthmatic patients. Phytomed 2010; 17(10):707-13. 12. Wichtl M. Herbal drugs and phytopharmaceuticals. Medpharm GmBH, Stuttgart 2004; 416-7. 13. Al-Jassir MS. Chemical composition and microflora of black cumin (Nigella sativa L.) seeds growing in Saudi Arabia. Food Chem 1992; 45:239-42. 14. Atta-Ur-Rahman. Nigellidine – a new indazole alkaloid from the seed of Nigella sativa. Tetrahedron Lett 1995; 36(12):1993-4. 15. Cheikh-Rouhou S, Besbes S, Lognay G i wsp. Sterol composition of black cumin (Nigella sativa L.) and Aleppo pine (Pinus halpensis Mill.) seed oils. J Food Comp Anal 2008; 21(2):162-8. 16. Mehta BK, Verma M, Gupta MJ. Novel lipid constituents identified in seeds of Nigella sativa Linn. Braz Chem Soc 2008; 19(3):458-62. 17. Bourgou S, Ksouri R, Bellila A i wsp. Phenolic composition and biological activities of Tunisian Nigella sativa L. shoots and roots. CR Biol 2008; 331(1):48-55. 18. Tembhurne SV, Feroz S, Sakarkar DM. A review on therapeutic potential of Nigella sativa (kalonji) seeds. J Med Plants Res 2014; 8:166-7. 19. Ahmad A, Husain A, Mujeeb M i wsp. A review on therapeutic potential of Nigella sativa: A miracle herb. Asian Pac J Trop Biomed 2013; 3:337-52. 20. Parvardeh S, Nassiri-Asl M, Mansouri MT i wsp. Study on the anticonvulsant activity of thymoquinone, the major constituent of Nigella sativa L. seeds, through intracerebroventricular injection. J Med Plants 2005; 4:45-52. 21. Hosseinzadeh H, Parvardeh S. Anticonvulsant effects of thymoquinone, the major constituent of Nigella sativa seeds, in mice. Phytomed 2004; 11:56-64. 22. Hosseinzadeh H, Parvardeh S, Nassiri-Asl M i wsp. Intracerebroventricular administration of thymoquinone, the major constituent of Nigella sativa seeds, suppresses epileptic seizures in rats. Med Sci Monit 2005; 11:BR106-10. 23. Hosseinzadeh H, Taiari S, Nassiri-Asl M. Effect of thymoquinone, a constituent of Nigella sativa L., on ischemia-reperfusion in rat skeletal muscle. N-S Arch Pharmacol 2012; 385:503-8. 24. El Gazzar M, El Mezayen R, Marecki JC i wsp. Anti-inflammatory effect of thymoquinone in a mouse model of allergic lung inflammation. Int Immunopharmacol 2006; 6:1135-42. 25. Gali-Muhtasib H, Ocker M, Kuester D i wsp. Thymoquinone reduces mouse colon tumor cell invasion and inhibits tumor growth in murine colon cancer models. J Cell Mol Med 2008; 12:330-42. 26. Halawani E. Antibacterial activity of thymoquinone and thymohydroquinone of Nigella sativa L. and their interaction with some antibiotics. Adv Biol Res 2009; 3:148-52. 27. Abdel Azeiz AZ, Saad AH, Darweesh MF. Efficacy of thymoquinone against vaginal candidiasis in prednisolone-induced immunosuppressed mice. J Am Sci 2013; 9:155-9. 28. Dorman HJ, Deans SG. Antimicrobial agents from plants: antibacterial activity of plant volatile oils. J Appl Microbiol 2000; 88:308-16. 29. Bakathir HA, Abbas NA. Detection of the antibacterial effect of Nigella sativa ground seeds with water. Afr J Tradit Compl Altern Med 2011; 8:159-64. 30. Hanafy MS, Hatem ME. Studies on the antimicrobial activity of Nigella sativa seed (black cumin). J Ethnopharmacol 1991; 34:275-8. 31. Chaieb K, Kouidhi B, Jrah H i wsp. Antibacterial activity of Thymoquinone, an active principle of Nigella sativa and its potency to prevent bacterial biofilm formation. BMC Complement Altern Med 2011; 11:1-6. 32. Hannan A, Saleem S, Chaudhary S i wsp. Anti-bacterial activity of Nigella sativa against clinical isolates of methicillin resistant Staphylococcus aureus. J Ayub Med Coll Abbottabad 2008; 20(3): 72-4. 33. Salem EM, Yar T, Bamosa AO i wsp. Comparative study of Nigella sativa and triple therapy in eradication of Helicobacter pylori in patients with non-ulcer dyspepsia. Saudi J Gastroenterol 2010; 16(3): 207-14. 34. Rowland M, Daly L, Vaughan M i wsp. Age-specific incidence of Helicobacter pylori. Gastroenterology 2006; 130:65-72. 35. Nair MKM, Vasudevan P, Venkitanarayanan K. Antibacterial effect of black seed oil on Listeria monocytogenes. Food Cont 2005; 16:395-8. 36. Harzallah HJ, Kouidhi B, Flamini G i wsp. Chemical composition, antimicrobial potential against cariogenic bacteria and cytotoxic activity of Tunisian Nigella sativa essential oil and thymoquinone. Food Chem 2011; 129:1469-74. 37. Hasan NA, Nawahwi MZ, Malek, HA. Antimicrobial activity of Nigella sativa seed extract. Sains Malaysiana 2013; 42:143-7. 38. Deepak SS, Sikender M, Garg V i wsp. Entrapment of seed extract of Nigella sativa into thermosensitive (NIPAAm–Co–VP) co-polymeric micelles and its antibacterial activity. Int J Pharm Sci Drug Res 2011; 3:246-52. 39. Hosseinzadeh H, Fazly Bazzaz BS, Motevaly Haghi M. Antibacterial activity of total extracts and essential oil of Nigella sativa L. seeds in mice. Pharmacol 2007; 2: 429-35. 40. Evirgen O, Gokçe A, Ozturk OH i wsp. Effect of thymoquinone on oxidative stress in Escherichia coli – Induced pyelonephritis in rats. Curr Ther Res Clin Exp 2011; 72:204-15. 41. Monika T, Sasikala P, Vijaya Bhaskara Reddy M. A investigational of antibacterial activities of Nigella sativa on mastitis in dairy crossbred cows. Int J Adv Technical Res 2013; 3:263-72. 42. Aljabre SH, Randhawa MA, Akhtar N i wsp. Antidermatophyte activity of ether extract of Nigella sativa and its active principle, thymoquinone. J Ethnopharmacol 2005; 101(1-3):116-9. 43. Halamova K, Kokoska L, Flesar J i wsp. In vitro antifungal effect of black cumin seed quinones against dairy spoilage yeasts at different acidity levels. J Food Prot 2010; 73(12):2291-5. 44. El-Nagerabia SA, Al-Bahryb SN, Elshafieb AE i wsp. Effect of Hibiscus sabdariffa extract and Nigella sativa oil on the growth and aflatoxin B1 production of Aspergillus flavus and Aspergillus parasiticus strains. Food Cont 2012; 25:59-63. 58. Sunita M, Meenakshi SH. Chemical composition and antidermatophytic activity of Nigella sativa essential oil. Afr J Pharm Pharacol 2013; 7:1286-92. 45. Sunita M, Meenakshi SH. Chemical composition and antidermatophytic activity of Nigella sativa essential oil. Afr J Pharm Pharmacol 2013; 7:1286-92. 46. Bita A, Rosu AF, Calina D i wsp. An alternative treatment for Candida infections with Nigella sativa extracts. Eur J Hosp Pharm 2012; 19:162. 47. Khan MAU, Ashfaq MK, Zuberi HS i wsp. The in vivo antifungal activity of the aqueous extract from Nigella sativa seeds. Phytother Res 2003; 17:183-6. 48. Fierro IM, Barja-Fidalgo C, Cunha FQ i wsp. The involvement of nitric oxide in the anti-Candida albicans activity of rat neutrophils. Immunology 1996; 89:295-300. 49. Eddleston M, Davidson R, Wilkinson R i wsp. Oxford handbook of tropical medicine. 2nd Ed. Oxford University Press, New York 2005; 376-9. 50. Mahmoud MR, El-Abhar HS, Saleh S. The effect of Nigella sativa oil against the liver damage induced by Schistosoma mansoni infection in mice. J Ethnopharmacol 2002; 79(1):1-11. 51. Aboul-Ela EI. Cytogenetic studies on Nigella sativa seeds extract and thymoquinone on mouse cells infected with schistosomiasis using karyotyping. Mutat Res 2002; 516:11-7. 52. Mohamed AM, Metwally NM, Mahmoud SS. Nigella sativa seeds against Schistosoma mansoni different stages. Mem Inst Oswaldo Cruz 2005; 100:5-211. 53. Shenawy El, Nahla S, Soliman MF i wsp. The effect of antioxidant properties of aqueous garlic extract and Nigella sativa as anti-schistosomiasis agents in mice. Rev Inst Med Trop Sao Paulo 2008; 50:29-36. 54. Akhtar MS, Riffat S. Field trial of Saussurea lappa roots against nematodes and Nigella sativa seeds against cestodes in children. J Pak Med Assoc 1991; 41:185-7. 55. Okeola VO, Adaramoye OA, Nneji CM i wsp. Antimalarial and antioxidant activities of methanolic extract of Nigella sativa seeds (black cumin) in mice infected with Plasmodium yoelli nigeriensis. Parasitol Res 2011; 108:1507-12. 56. Salem ML, Hossain MS. Protective effect of black seed oil from Nigella sativa against murine cytomegalovirus infection. Int J Immunopharmacol 2000; 22:729-40. 57. Salem ML, Hossain MS. In vivo acute depletion of CD8 (+) T cells before murine cytomegalovirus infection upregulated innate antiviral activity of natural killer cells. Int J Immunopharmacol 2000; 22:707-18. 58. Barakat EM, El Wakeel LM, Hagag RS. Effects of Nigella sativa on outcome of hepatitis Cin Egypt. World J Gastroenterol 2013; 19:2529-36. 59. Umar S, Zargan J, Umar K i wsp. Modulation of the oxidative stress and inflammatory cytokine response by thymoquinone in the collagen induced arthritis in Wistar rats. Chem Biol Interact 2012; 197(1):40-6. 60. Bourgou S, Pichette A, Marzouk B i wsp. Antioxidant, anti-inflammatory, anticancer and antibacterial activities of extracts from Nigella sativa (Black Cumin) plant parts. J Food Biochem 2012; 36(5):539-46. 61. Khan N, Sultana S. Inhibition of two stage renal carcinogenesis, oxidative damage and hyperproliferative response by Nigella sativa. Eur J Cancer Prev 2005; 14(2):159-68. 62. Al-Othman AM, Ahmad F, Al-Orf S i wsp. Effect of dietry supplementation of Ellataria cardamun and Nigella sativa on the toxicity of rancid corn oil in rats. Int J Pharmocol 2006; 2(1):60-5. 63. Gendy E, Hessien M, Abdel Salamm I i wsp. Evaluation of the possible antioxidant effects of Soybean and Nigella sativa during experimental hepatocarcinogenesis by nitrosamine precursors. Turkish J Biochem 2007; 32(1):5-11. 64. Hosseinzadeh H, Parvardeh S, Asl MN i wsp. Effect of thymoquinone and Nigella sativa seeds oil on lipid peroxidation level during global cerebral ischemia-reperfusion injury in rat hippocampus. Phytomed 2007; 14(9):621-7. 65. Harzallah HJ, Grayaa R, Kharoubi W i wsp. Thymoquinone, the Nigella sativa bioactive compound, prevents circulatory oxidative stress caused by 1,2-dimethylhydrazine in erythrocyte during colon postinitiation carcinogenesis. Oxid Med Cell Longev 2012; 2012:854065. 66. Salama RH. Hypoglycemic effect of lipoic acid, carnitine and Nigella sativa in diabetic rat model. Int J Health Sci (Qassim) 2011; 5(2):126-34. 67. Abdelmeguid NE, Fakhoury R, Kamal SM i wsp. Effects of Nigella sativa and thymoquinone on biochemical and subcellular changes in pancreatic β-cells of streptozotocin-induced diabetic rats. J Diabetes 2010; 2(4):256-66. 68. Kanter M, Akpolat M, Aktas C. Protective effects of the volatile oil of Nigella sativa seeds on beta-cell damage in streptozotocin-induced diabetic rats: a light and electron microscopic study. J Mol Histol 2009; 40(5-6):379-85. 69. Pari L, Sankaranarayanan C. Beneficial effects of thymoquinone on hepatic key enzymes in streptozotocin-nicotinamide induced diabetic rats. Life Sci 2009; 85(23-6):830-4. 70. Altan MF, Kanter M, Donmez S i wsp. Combination therapy Nigella sativa and human parathyroid hormone on bone mass, biomechanical behavior and structure in streptozotocin-induced diabetic rats. Acta Histochem 2007; 109(4):304-14. 71. Bamosa AO, Kaatabi H, Lebdaa FM i wsp. Effect of Nigella sativa seeds on the glycemic control of patients with type 2 diabetes mellitus. Indian J Physiol Pharmacol 2010; 54(4):344-54. 72. Benhaddou-Andaloussi A, Martineau L, Vuong T i wsp. The in vivo antidiabetic activity of Nigella sativa is mediated through activation of the AMPK pathway and increased muscle glut4 content. Evid Based Complement Alternat Med 2011; 2011:538671. 73. Alemi M, Sabouni F, Sanjarian F i wsp. Anti-inflammatory effect of seeds and callus of Nigella sativa L. extracts on mix glial cells with regard to their thymoquinone content. AAPS Pharm Sci Tech 2012 Dec 19. 74. Shuid AN, Mohamed N, Mohamed IN i wsp. Nigella sativa: A potential antiosteoporotic agent. Evid Based Compl Altern Med 2012; 2012:696230. 75. Chehl N, Chipitsyna G, Gong Q i wsp. Anti-inflammatory effects of the Nigella sativa seed extract, thymoquinone, in pancreatic cancer cells. HPB (Oxford) 2009; 11(5):373-81. 76. El Mezayen R, El Gazzar M, Nicolls MR i wsp. Effect of thymoquinone on cyclooxygenase expression and prostaglandin production in a mouse model of allergic airway inflammation. Immunol Lett 2006; 106(1):72-81. 77. Nikakhlagh S, Rahim F, Aryani FH i wsp. Herbal treatment of allergic rhinitis: the use of Nigella sativa. Am J Otolaryngol 2011; 32(5):402-7. 78. Mahmoud SS, Torchilin VP. Hormetic/cytotoxic effects of Nigella sativa seed alcoholic and aqueous extracts on MCF-7 breast cancer cells alone or in combination with doxorubicin. Cell Biochem Biophys 2012; 25(7):1392-8. 79. Salem ML, Alenzi FQ, Attia WY. Thymoquinone, the active ingredient of Nigella sativa seeds, enhances survival and activity of antigen-specific CD8-positive T cells in vitro. Br J Biomed Sci 2011; 68(3):131-7. 80. Peng L, Liu A, Shen Y i wsp. Antitumor and anti-angiogenesis effects of thymoquinone on osteosarcoma through the NF-κB pathway. Oncol Rep 2013; 29(2):571-8 81. Ng WK, Yazan LS, Ismail M. Thymoquinone from Nigella sativa was more potent than cisplatin in eliminating of SiHa cells via apoptosis with down-regulation of Bcl-2 protein. Toxicol In vitro 2011; 25(7):1392-8. 82. Woo CC, Loo SY, Gee V i wsp. Anticancer activity of thymoquinone in breast cancer cells: possible involvement of PPAR-γ pathway. Biochem Pharmacol 2011; 82(5):464-75. 83. Lei X, Lv X, Liu M i wsp. Thymoquinone inhibits growth and augments 5-fluorouracil-induced apoptosis in gastric cancer cells both in vitro and in vivo. Biochem Biophys Res Commun 2012; 417(2):864-8. 84. Kruczak A. Nowe komercyjne przeciwciała i ich zastosowanie w diagnostyce patomorfologicznej. Diagn Lab 2014; 50(2):177-8. 85. Torres MP, Ponnusamy MP, Chakraborty S i wsp. Effects of thymoquinone in the expression of mucin 4 in pancreatic cancer cells: implications for the development of novel cancer therapies. Mol Cancer Ther 2010; 9(5):1419-31. 86. Wu ZH, Chen Z, Shen Y i wsp. Anti-metastasis effect of thymoquinone on human pancreatic cancer. Yao Xue Xue Bao 2011; 46(8):910-4. 87. Salim EI. Cancer chemopreventive potential of volatile oil from black cumin seeds, Nigella sativa L. in a rat multi-organ carcinogenesis bioassay. Oncol Lett 2010; 1(5):913-24. 88. Ghonime M, Eldomany R, Abdelaziz A i wsp. Evaluation of immunomodulatory effect of three herbal plants growing in Egypt. Immunopharmacol Immunotoxicol 2011; 33(1):141-5. 89. Boskabady MH, Keyhanmanesh R, Khameneh S i wsp. Potential immunomodulation effect of the extract of Nigella sativa on ovalbumin sensitized guinea pigs. J Zhejiang Univ Sci B 2011; 12(3):201-9. 90. Duncker SC, Philippe D, Martin-Paschoud C i wsp. Nigella sativa (Black Cumin) seed extract alleviates symptoms of allergic diarrhea in mice, involving opioid receptors. PLoS One 2012; 7(6):e39841. 91. Magdy MA, Hanan el-A, Nabila el-M. Thymoquinone: Novel gastroprotective mechanisms. Eur J Pharmacol 2012; 697(1-3):126-31. 92. Al Mofleh IA, Alhaider AA, Mossa JS i wsp. Gastroprotective effect of an aqueous suspension of black cumin Nigella sativa on necrotizing agents-induced gastric injury in experimental animals. Saudi J Gastroenterol 2008; 14(3):128-34. 93. Khaled AAS. Gastroprotective effects of Nigella sativa oil on the formation of stress gastritis in hypothyroidal rats. Int J Physiol Pathophysiol Pharmacol 2009; 1:143-9. 94. Tayman C, Cekmez F, Kafa IM i wsp. Beneficial effects of Nigella sativa oil on intestinal damage in necrotizing enterocolitis. J Invest Surg 2012; 25(5):286-94. 95. Lei X, Liu M, Yang Z i wsp. Thymoquinone prevents and ameliorates dextran sulfate sodium-induced colitis in mice. Dig Dis Sci 2012; 57(9):2296-303. 96. Yildiz F, Coban S, Terzi A i wsp. Nigella sativa relieves the deleterious effects of ischemia reperfusion injury on liver. World J Gastroenterol 2008; 14(33):5204-9. 97. Kapoor S. Emerging clinical and therapeutic applications of Nigella sativa in gastroenterology. World J Gastroenterol 2009; 7:2170-1. 98. Zafeer MF, Waseem M, Chaudhary S i wsp. Cadmium-induced hepatotoxicity and its abrogation by thymoquinone. J Biochem Mol Toxicol 2012; 26(5):199-205. 99. Saleem U, Ahmad B, Rehman K i wsp. Nephro-protective effect of vitamin C and Nigella sativa oil on gentamicin associated nephrotoxicity in rabbits. Pak J Pharm Sci 2012; 25(4):727-30. 100. Ulu R, Dogukan A, Tuzcu M i wsp. Regulation of renal organic anion and cation transporters by thymoquinone in cisplatin induced kidney injury. Food Chem Toxicol 2012; 50(5):1675-9. 101. Hadjzadeh MA, Keshavarzi Z, Yazdi TSA i wsp. Effect of alcoholic extract of Nigella sativa on cisplatin-induced toxicity in rat. Iran J Kidney Dis 2012; 6(2):99-104. 102. Abul-Nasr SM, El-Shafey MDM, Osfor MMH. Amelioration by Nigella sativa of methotrexate induced toxicity in male albino rats: a biochemical, haematological and histological study. Scintia Agri Bohem 2001; 32:123-60. 103. Yaman I, Balikci E. Protective effects of Nigella sativa against gentamicin-induced nephrotoxicity in rats. Exp Toxicol Pathol 2010; 62(2):183-90. 104. Yildiz F, Coban S, Terzi A i wsp. Protective effects of Nigella sativa against ischemia-reperfusion injury of kidneys. Ren Fail 2010; 32(1):126-31. 105. Kanter M. Effects of Nigella sativa seed extract on ameliorating lung tissue damage in rats after experimental pulmonary aspirations. Acta Histochem 2009; 111(5):393-403. 106. Tayman C, Cekmez F, Kafa IM i wsp. Protective effects of Nigella sativa oil in hyperoxia-induced lung injury. Arch Bronchopneumol 2012; 49(1):15-21. 107. Boskabady MH, Javan H, Sajady M i wsp. The possible prophylactic effect of Nigella sativa seed extract in asthmatic patients. Fundam Clin Pharmacol 2007; 21(5):559-66. 108. Perveen T, Abdullah A, Haider S i wsp. Long-term administration of Nigella sativa effects nociception and improves learning and memory in rats. Pak J Biochem Mol Biol 2008; 41(3):141-3. 109. Perveen T, Haider S, Kanwal S i wsp. Repeated administration of Nigella sativa decreases 5-HT turnover and produces anxiolytic effects in rats. Pak J Pharm Sci 2009; 22(2):139-44. 110. Gilhotra N, Dhingra D. Thymoquinone produced antianxiety-like effects in mice through modulation of GABA and NO levels. Pharmacol Rep 2011; 63(3):660-9. 111. Akhtar M, Maikiyo AM, Khanam R i wsp. Ameliorating effects of two extracts of Nigella sativa in middle cerebral artery occluded rat. J Pharm Bioallied Sci 2012; 4(1):70-5. 112. Ezz HS, Khadrawy YA, Noor NA. The neuroprotective effect of curcumin and Nigella sativa oil against oxidative stress in the pilocarpine model of epilepsy: a comparison with valproate. Neurochem Res 2011; 36(11):2195-204. 113. Raza M, Alghasham AA, Alorainy MS i wsp. Potentiation of valproate-induced anticonvulsant response by Nigella sativa seed constituents: the role of GABA receptors. Int J Health Sci (Qassim) 2008; 2(1):15-25.



