*Łukasz Nyk1, Michał A. Skrzypczyk2, Stanisław Szempliński2, Mieszko Kozikowski1, Wojciech Michalak1, Sebastian Piotrowicz1, Szymon Kawecki1, Tomasz Dzik3, Maciej Wysocki4, Andrzej Borówka1, Jakub Dobruch1, 2
Porównanie stopnia klinicznego i patologicznego zaawansowania raka stercza
Comparison of clinical and pathological stage of prostate cancer
1I Zespół Dydaktyki, Klinika Urologii, Centrum Medyczne Kształcenia Podyplomowego, Europejskie Centrum Zdrowia Otwock
Kierownik Kliniki: dr hab. med. Jakub Dobruch
2II Zespół Dydaktyki, Klinika Urologii, Centrum Medyczne Kształcenia Podyplomowego, Samodzielny Publiczny Szpital Kliniczny im. prof. W. Orłowskiego, Warszawa
Kierownik Kliniki: dr hab. med. Jakub Dobruch
3Zakład Patomorfologii, Międzyleski Szpital Specjalistyczny, Warszawa
Kierownik Zakładu: dr med. Tomasz Dzik
4Zakład Patomorfologii, Szpital Bielański, Warszawa
Kierownik Zakładu: dr med. Jan Faryna
Streszczenie
Wstęp. Głównymi przesłankami warunkującymi wybór postępowania u chorych na PCa jest zaawansowanie kliniczne raka i jego złośliwość. Oceny klinicznego zaawansowania guza (cT) dokonuje się na podstawie wielu przesłanek: sPSA, DRE, TRUS, biopsji oraz badań obrazowych (MRI i TK). Dokładność oceny stopnia klinicznego zaawansowania PCa ma ogromny wpływ na dalsze losy chorego, gdyż wpływa zasadniczo na podjęcie decyzji terapeutycznej.
Cel pracy. Porównanie stopnia klinicznego i patologicznego zaawansowania raka stercza.
Materiał i metody. Materiał badawczy stanowiły gromadzone prospektywnie dane medyczne dotyczące kolejnych 212 chorych poddanych prostatektomii radykalnej (PR), u których raka stercza rozpoznano na podstawie wielomiejscowej biopsji rdzeniowej stercza wykonanej pod kontrolą ultrasonografii przezodbytniczej.
Wyniki. Na podstawie badania stercza palcem przez odbytnicę (DRE) u 82 (38,7%) chorych nie stwierdzono nieprawidłowości, które mogłyby sugerować istnienie PCa. Podejrzenie raka zaawansowanego miejscowo (cT3a) wysnuto u 3 (1,4%) mężczyzn. TRUS wykonana w czasie biopsji stercza nie wykazała zmian, które mogłyby sugerować istnienie PCa u 68 (32,08%) mężczyzn. Nieprawidłowości struktury stercza sugerujące PCa wykryto aż u 144 (67,9%) chorych. Ujemny margines specymenów operacyjnych stwierdzono u 153 (72,2%) chorych. PSM wykryto u 59 (27,8%) operowanych. Nacieczenie nowotworowe torebki stercza (Pcaps-1) stwierdzono w 58 (27,4%) specymenach operacyjnych, zaś naciekanie pozasterczowe (ECE) w 78 (36,8%). Nacieczenie pęcherzyków nasiennych przez PCa stwierdzono u względnie niedużego odsetka chorych (11,8%). Nasze dane świadczą o znacznym niedoszacowaniu stopnia zaawansowania PCa na podstawie przesłanek klinicznych: raka klinicznie ograniczonego do stercza rozpoznano u prawie 98% chorych, zaś raka rzeczywiście ograniczonego do stercza (pT2) tylko u prawie 59% operowanych.
Wnioski. W naszym badaniu stopień klinicznego zaawansowania PCa (cT) różni się od stopnia zaawansowania patologicznego (pT) u znacznego odsetka chorych poddanych prostatektomii radykalnej, przy czym znacznie częściej występuje niedoszacowanie cechy T niż jej przeszacowanie.
Summary
Introduction. The main premises for the choice of treatment in patients with PCa are the clinical stage (cT) and malignancy. Assessment of cT is made on the basis of sPSA, DRE, TRUS, biopsy, and – in some patients – computer tomography (CT) of the pelvis and/or resonance imagining (MRI). Accuracy of clinical stage of PCa has a great impact on therapeutic decisions.
Aim. Comparision of clinical and pathological stage of prostate cancer.
Material and methods. Research material consisted of prospectively collected medical data for 212 consecutive patients who underwent radical prostatectomy (RP) in the Urology Clinic of the CPME and were diagnosed with PCa based on transrectal-ultrasound guided multiple-core biopsy ( TRUScoreBx).
Results. Digital rectal examination (DRE) and transrectal ultrasound (TURS) confirmed low diagnostic efficiency in PCa detection. Negative results for these examinations occurred, respectively, in 38.7 and 32.08% of the patients diagnosed with PCa on the basis of TRUScoreBx. Positive surgical margins (PSM) and extracapsular extension (ECE) and seminal vesicle invasion (SVI) in post prostatectomy material was found in 27.8, 36.8 and 11.8% respectively. The data comparing the clinical and pathological stage of PCa show a major underestimation of cancer at diagnosis. In own material, neoplasm clinically limited to the prostate gland was found in almost 98% of the patients. After the analysis of oncological characteristics of PCa in post-surgery preparations, neoplasm was actually found to be limited to the prostate in less than 59% of them; thus, the remaining 41% were diagnosed with locally advanced cancer (pT3).
Conclusions. The clinical stage of PCa (cT) is different from the pathological stage (pT) in a large percentage of patients who undergo radical prostatectomy; cT underestimation is much more frequent than overestimation.

WSTĘP
Rak stercza (ang. prostate carcinoma – PCa) w Ameryce Północnej i wielu krajach Europy Zachodniej wyprzedza pod względem częstości występowania wszystkie nowotwory innych narządów (ryc. 1, 2) (1).
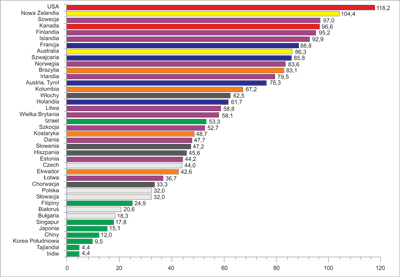
Ryc. 1. Zapadalność (na 100 tys.) na raka stercza w różnych krajach i regionach świata (1)
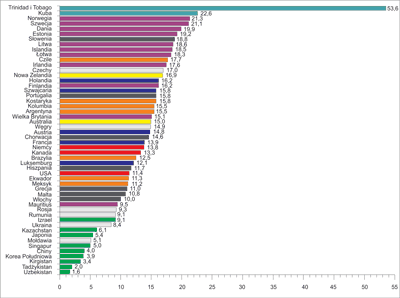
Ryc. 2. Umieralność (na 100 tys.) z powodu raka stercza w różnych krajach i regionach świata (1)
Zapadalność na PCa w Polsce ustępuje jedynie zapadalności na raka płuca (tab. 1).
Tab. 1. Współczynniki standaryzowane zapadalności na najczęściej występujące nowotwory złośliwe u mężczyzn i umieralności z ich powodu w Polsce w 2012 roku (3)
| Nowotwór złośliwy | Zapadalność | Liczba | Umieralność | Liczba |
| C34 płuca | 5 | 15 134 | 53,5 | 16 182 |
| C61 stercza | 35,6 | 10 798 | 12,4 | 4199 |
| C67 pęcherza moczowego | 16,4 | 5016 | 7,9 | 2550 |
| C18 okrężnicy | 16,9 | 5133 | 12,4 | 3917 |
Raka stercza rozpoznaje się na podstawie biopsji mającej z reguły charakter wielomiejscowej biopsji rdzeniowej, wykonanej igłą tru-cut pod kontrolą ultrasonografii przezodbytniczej (TRUScoreBx) (1-5).
Cechami sugerującymi możliwość istnienia PCa i stanowiącymi wskazanie do TRUScoreBx są: podwyższenie stężenia swoistego antygenu sterczowego (ang. prostate specific antygen – PSA) w surowicy lub/i nieprawidłowości stwierdzone na podstawie badania stercza palcem przez odbytnicę (ang. digital rectal examination – DRE), lub/i stwierdzenie nieprawidłowości w ultrasonografii przezodbytniczej (ang. transrectal ultrasound – TRUS).
Głównymi przesłankami warunkującymi wybór postępowania u chorych na PCa jest zaawansowanie kliniczne raka i jego złośliwość. Najogólniej mówiąc, zastosowanie radykalnego leczenia chirurgicznego lub radioterapii radykalnej jest uzasadnione w przypadku raka ograniczonego do stercza u chorych, których perspektywa przeżycia naturalnego przewyższa 10 lat. Oceny klinicznego zaawansowania guza (cT) dokonuje się na podstawie wielu przesłanek: sPSA, DRE, TRUS, biopsji oraz – coraz częściej – na podstawie obrazowania metodą rezonansu magnetycznego protonów (MRI) i rzadziej tomografii komputerowej (TK) (6). Obrazowanie stercza metodą MRI (z użyciem cewki doodbytniczej lub 3-teslowego aparatu) jest najbardziej dokładną, nieinwazyjną, ale też najbardziej kosztowną i nie wszędzie dostępną metodą oceny raka zaawansowanego miejscowo, zwłaszcza naciekającego pęcherzyki nasienne (7, 8).
Zasięg miejscowego rozprzestrzenienia PCa oraz istnienie lub nieistnienie przerzutów do węzłów chłonnych i przerzutów odległych stanowią podstawę klasyfikacji stopnia zaawansowania nowotworu. Klasyfikacją stosowaną powszechnie jest klasyfikacja TNM (T – tumor, N – noduli, M – metastases), autoryzowana przez Międzynarodową Unię do Walki z Rakiem (Union for International Cancer Control – UICC) i zaakceptowana przez Światową Organizację Zdrowia (World Health Organization – WHO). Pierwszą klasyfikację TNM opublikowano w 1958 roku (9). Od tego czasu zmodyfikowano ją kilkakrotnie – wersja ostatnia pochodzi z 2009 roku (10).
Dokładność oceny stopnia klinicznego zaawansowania PCa ma ogromny wpływ na dalsze losy chorego, gdyż wpływa zasadniczo na podjęcie decyzji terapeutycznej. Przeszacowanie stopnia zaawansowania guza (cT > pT) może doprowadzić do rezygnacji z leczenia radykalnego i pozbawienia chorego możliwości wyleczenia. Natomiast niedoszacowanie stopnia zaawansowania (cT < pT) może przyczynić się wykonania niepotrzebnej, bo niezapewniającej wyleczenia operacji oraz do wystąpienia powikłań z nią związanych i wpływających bezpośrednio na jakość życia chorego.
Zarówno badanie DRE, jak i wszystkie metody obrazowe pozwalają ocenić stopień klinicznego zaawansowania nowotworu w skali „makro”. Nie są jednak w stanie wykryć mikroskopowego naciekania raka poza stercz. Dlatego możliwość odróżnienia na ich podstawie raka ograniczonego do stercza od raka zaawansowanego miejscowo pozostanie nieduża (11-14).
Nie należy się zatem dziwić istnieniu różnic, głównie w postaci niedoszacowania, między oceną stopnia zaawansowania klinicznego (cT) i patologicznego (pT). Wynika to również z ilości materiału tkankowego, którą dysponuje patomorfolog, oceniając rdzenie tkankowe i materiał operacyjny: w przypadku oceny materiału pochodzącego z biopsji jest to zaledwie kilka lub kilkanaście skrawków długości około 1,5 cm każdy, zaś ocena pT oparta jest na badaniu całego gruczołu krokowego i pęcherzyków nasiennych (15-17).
Odmienność ocen klinicznego i patologicznego zaawansowania PCa, a także odmienność ocen złośliwości raka określonej na podstawie badania rdzeni tkankowych oraz na podstawie badania materiału operacyjnego były przedmiotem szeregu badań (18-20), jednak interesujące jest, jak przedstawia się ona w warunkach rodzimych.
CEL PRACY
Porównanie stopnia klinicznego i patologicznego zaawansowania raka stercza.
MATERIAŁ I METODY
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Ferlay J, Parkin DM, Curado MP, et al. Cancer incidence in five continents, volumes I to IX: IARC CancerBase No. 9. Lyon, France: International Agency for Research on Cancer. World Health Organization Web site. http://ci5.iarc.fr
2. Według www.onkologia.org.pl
3. Antoniewicz AA: Jak poprawić jakość biopsji stercza? [W:] Antoniewicz AA (red.): Biopsja stercza. Komitet Edukacji PTU Top Kurier, Toruń 2002: 73-81.
4. Bostwick DG, Meiers I: Prostate biopsy and optimization of cancer yield. European Urology 2006; 49(3): 415-417.
5. Ficarra V, Novella G, Novara G et al.: The potential impact of prostate volume in the planning of optimal number of cores in the systematic transperineal prostate biopsy. European Urology 2005; 48(6): 932-937.
6. Mottet N, Bastian PJ, Bellmunt J et al.: Guidelines of Prostate Carcinoma. European Association of Urology 2014: 18-26.
7. Heidenreich A: Consensus Criteria for the Use of Magnetic Resonance Imaging in the Diagnosis and Staging of Prostate Cancer: Not Ready for Routine Use. European Urology 2011; 59(4): 495-497.
8. Comet-Batlle J, Vilanova-Busquets JC, Saladiè-Roig JM et al.: The Value of Endorectal MRI in the Early Diagnosis of Prostate Cancer. European Urology 2003; 44(2): 201-208.
9. International Union Against Cancer (UICC), Committee on Clinical Stage Classification and Applied Statistics: Clinical stage classification and presentation of results, malignant tumours of the breast and larynx. Paris 1958.
10. Sobin LH: Luteinising hormone. [In:] Sobin LH, Gospodariwicz M, Wittekind C (eds.): TNM classification of malignant tumours. UICC International Union Against Cancer. 7th ed. Wiley-Blackwell, Singapore 2009: 243-248.
11. Catalona WJ, Richie JP, Ahmann FR et al.: Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer: results of a multicenter clinical trial of 6,630 men. J Urol 1994; 151: 1283-1290.
12. Okotie OT, Kimberly AR, Misop H et al.: Relevance Feedback Icon Characteristics of Prostate Cancer Detected by Digital Rectal Examination Only. Urology 2007; 70(6): 1117-1120.
13. Smith DS, Catalona WJ: Interexaminer variability of digital rectal examination in detecting prostate cancer. Urology 1995; 45: 70-74.
14. Sanchez-Chapado M, Angulo JC, Ibarburen C et al.: Comparison of digital rectal examination, transrectal ultrasonography, and multicoil magnetic resonance imaging for preoperative evaluation of prostate cancer. Eur Urol 1997; 32: 140-149.
15. Grossfeld GD, Chang JJ, Broering JM et al.: Under staging and under grading in a contemporary series of patients undergoing radical prostatectomy: results from the Cancer of the Prostate Strategic Urologic Research Endeavor database. J Urol 2001; 165: 851-856.
16. Montironi R, Mazzuccheli R, Scarpelli M et al.: Gleason grading of prostate cancer in needle biopsies or radical prostatectomy specimens: contemporary approach, current clinical significance and sources of pathology discrepancies. BJU Int 2005; 95: 1146-1152.
17. Ung JO, Richie JP, Chen MH et al.: Evolution of the presentation and pathologic and biochemical outcomes after radical prostatectomy for patients with clinically localized prostate cancer diagnosed during the PSA era. Urology 2002; 60: 458-463.
18. Dobruch J, Borówka A, Grotthuss G et al.: Comparison of clinical and pathological stage and grade of prostate cancer. Urol Pol 2007; 60: 30-37.
19. Frauscher F, Klauser A, Halpern EJ: Advances in ultrasound for the detection of prostate cancer. Ultrasound Q 2002; 18: 135-142.
20. Derweesh IH, Kupelian PA, Zippe C et al.: Continuing trends in pathological stage migration in radical prostatectomy specimens. Urol Oncol 2004; 22: 300-306.
21. DiMarco DS, Blute ML, Zincke H et al.: Multivariate models to predict clinically important outcomes at prostatectomy for patients with organ-confined disease and needle biopsy Gleason scores of 6 or less. Urol Oncol 2003; 21: 439-446.
22. Steinberg DM, Sauvageot J, Piantadosi S, Epstein JI: Correlation of prostate needle biopsy and radical prostatectomy Gleason grade in academic and community settings. Am J Surg Pathol 1997; 21: 566-576.
23. King CR: Patterns of prostate cancer biopsy grading: trends and clinical implications. Int J Cancer 2000; 90: 305-311.
24. Johnstone PA, Riffenburgh R, Saunders EL, Willison FW: Grading inaccuracies in diagnostic biopsies revealing prostatic adenocarcinoma: implications for definitive radiation therapy. Int J Radiation Oncology, Biology, Physics 1995; 32: 479-482.
25. Robein JA: Results of radical prostatectomies for cancer: a retrospective multicenter study on 918 cases. J Urol 1994; 100: 121-127.
26. Ogura Y, Sakata Y, Wakita T et al.: Treatment results of radical prostatectomy in clinical stage B and C prostate cancer: comparison of the neoadjuvant therapy group versus the surgery group; retrospective analysis of 80 cases. Acta Urologica Japonia 2003; 49: 515-520.
27. Maroni P, Crawford E: Screening for prostate cancerin 2006: PSA in the 21st century. N C Med J 2006; 67: 136-139.
28. Freedland S, Partin A: Prostate-specific antigen: Update 2006. Urology 2006; 67: 458-460.
29. Bradford T, Tomlins S, Wang X, Chinnaiyan A: Molecular markers of prostate cancer. Urologic Oncology: Seminars and Original Investigations 2006; 24: 538-551.


