© Borgis - Postępy Fitoterapii 4/2016, s. 268-273
Krzysztof Gołąb, Jakub Gburek, *Maria Warwas
Acemannan – właściwości i użyteczność w lecznictwie
Acemannan – properties and medical utility
Katedra i Zakład Biochemii Farmaceutycznej, Wydział Farmaceutyczny z Oddziałem Analityki Medycznej, Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
Kierownik Katedry i Zakładu: dr hab. n. farm. Jakub Gburek
Streszczenie
W tradycyjnej medycynie aloes wykorzystywany jest od wieków. Największą aktywność biologiczną i zastosowanie ma Aloe vera, którego globalny rynek szacuje się w ostatnich latach na 13 miliardów dolarów rocznie. Jest on źródłem żółtego, gorzkiego mleczka, które jest produktem farmakopealnym oraz bezbarwnego żelu o neutralnym smaku i zapachu. Żel zawiera około 75 substancji biologicznie aktywnych, w tym polisacharydy. Głównym polisacharydem wyizolowanym z żelu aloesowego jest acemannan (synonim Carrisyn).
W pracy zebrano informacje, w oparciu o najnowszą literaturę, dotyczące budowy acemannanu, metod jego izolacji oraz właściwości fizykochemicznych. Ponadto przedstawiono główne aktywności biologiczne i mechanizmy działania: przeciwzapalnego, przeciwdrobnoustrojowego, przeciwnowotworowego i immunomodulującego oraz przyspieszającego gojenie się ran. Bardziej szczegółowo przedstawiono badania przeprowadzone z udziałem ludzi, świadczące o skuteczności acemannanu po podaniu miejscowym, w leczeniu schorzeń stomatologicznych takich jak: zapalenia kości zębodołu, afty czy pulpotomia. Po krótkim omówieniu patomechanizmu wymienionych wyżej schorzeń przedstawiono wyniki przeprowadzonych badań klinicznych i wypływające z nich wnioski.
Trwają prace nad zastosowaniem acemannanu w klejach do protez dentystycznych oraz w konstrukcjach biomateriałów stosowanych w chirurgii stomatologicznej ze względu na jego korzystne właściwości reologiczne.
Summary
Aloe has been used in traditional medicine for ages. The most biological active and useful species is Aloe vera, which is a globally important commodity with an annual market of 13 billion dollars. It is a source of a yellow, bitter milk and a colorless, neutral in taste and smell gel. The gel contains about 75 biological active substances including polysaccharides. The main polysaccharide isolated from aloe gel is acemannan (syn. Carrisyn).
The information collected in this paper are based on the latest literature concerning physicochemical properties of acemannan, methods of its isolation and its main biological activities such as: anti-inflammatory, anti-microbial (bacteria, viruses, fungi), anti-tumor and immunomodulatory effects, as well as acceleration of wound healing. We have described in more detail the effectiveness of acemannan after topical application in the treatment of dental diseases, such as alveoral osteitis, recurrent dental afts and pulpotomy. After short presentation of the pathogenesis of the above mentioned conditions, we presented the results of known clinical study and its conclusions.
There are ongoing studies on the use of acemannan in adhesives for dental prostheses and in biomaterial-based structures used in dental surgery due to favourable rheological properties.

Wstęp
Acemannan jest głównym polisacharydem występującym w liściach aloesu – rośliny rosnącej w suchym, gorącym klimacie. Obecnie, według trzeciej wersji systemu klasyfikacji roślin okrytonasiennych, utworzonej w roku 2009 przez członków Angiosperm Phylogeny Group III (APG III), rodzaj Aloes zaliczany jest do rodziny Złotogłowowatych (Asphodeloideae), podrodziny roślin jednoliściennych, Żółtakowatych (Xanthorrhoeaceae) (1). Istnieje około 400 gatunków aloesu uprawianych na całym świecie: drzewiastych, krzewiastych, bylin, a nawet lian (2), jednak tylko dwa gatunki uprawiane są w celach komercyjnych: Aloe arborescens Mill. i Aloe barbadensis Mill. (Aloe vera (L.) Webb. – aloes zwyczajny). Największą aktywność biologiczną i zastosowanie ma Aloe vera, którego globalny rynek szacuje się na 13 miliardów dolarów rocznie (3). Ostatnio przeprowadzone badania filogenetyczne wskazują na Półwysep Arabski jako pierwotne miejsce występowania i rozprzestrzeniania się Aloe vera (3). Roślina, której żywotność wynosi około 12 lat, pełną dojrzałość osiąga po okresie 3-4 lat, kiedy to liście zaczynają wypuszczać pędy i zawierają optymalną ilość składników odżywczo-leczniczych. Zbiór może odbywać się co 6-8 tyg. przez usuwanie od 3 do 4 liści (4). Skład chemiczny całych liści aloesu oraz jego właściwości biologiczne przedstawione zostały w licznych opracowaniach zbiorczych (np. 5-9).
Z liści aloesu pozyskiwane są dwa produkty farmaceutyczne: alona oraz żel aloesowy, różniące się składem chemicznym oraz zastosowaniem leczniczym. Alona (mleczko aloesowe) jest surowcem leczniczym zawierającym w swoim składzie głównie glikozydy antrachinowe o działaniu przeczyszczającym. Surowiec ten ma monografie w wielu farmakopeach. Żel aloesowy, zawierający ok. 75 biologicznie aktywnych związków, w tym glikoproteiny i polisacharydy (10, 11), stosowany jest w ramach leczenia tradycyjnego, gdyż prace nad jego zastosowaniem u ludzi znajdują się na etapie badań przedklinicznych lub nielicznych badań klinicznych.
Żel aloesowy otrzymywany jest z komórek miękiszowych wewnętrznych części liści. Jest to klarowna ciecz o dużej lepkości, bez smaku (10). Charakteryzuje się złożonym składem chemicznym: 98,50% stanowi woda, a pozostała część zawiera ponad 75 związków, takich jak: polisacharydy, acetylowane pochodne polisacharydów, glikoproteiny, antrachinony fenolowe, flawonoidy, enzymy, substancje mineralne, aminokwasy, sterole, saponiny oraz witaminy (5, 11, 12). Żel aloesowy otrzymywany jest w wyniku procesu technologicznego, którego pierwszym etapem jest miażdżenie pozbawionych skórki liści, a następnym ich mielenie. Kolejny etap to filtrowanie płynnej frakcji oraz dodatek do niej witaminy C w celu ochrony przed utlenieniem. Do żelu dodawane są także środki konserwujące: benzoesan sodu, sorbinian potasu, kwas cytrynowy lub witamina E oraz stabilizatory: guma guar, guma ksantanowa, siarczyny polisacharydów. Żel aloesowy wykorzystywany jest w przemyśle spożywczym, kosmetycznym oraz farmaceutycznym (5, 11).
Metody pozyskiwania acemannanu i źródła komercyjne
Acemannan, czyli acetylowany glukomannan, jest mieszaniną różnej długości polimerów, składających się z: mannozy (93,4%), galaktozy (3,1%) i glukozy (3,0%) (13). Wytwarzany jest przez bezbarwne, niefotosyntetyzujące, wyspecjalizowane komórki zwane leukoplastami, a pozyskiwany ze śluzowej warstwy znajdującej się pod skórką liści, czyli żelu aloesowego (14). Opisano kilka metod izolacji acemannanu, stosowanego w badaniach naukowych. Jako przykład przedstawić można metodę opisaną w 2014 roku. W metodzie tej świeżą pulpę Aloe vera poddaje się procesom: homogenizacji, wirowania i strącania alkoholem. W celu usunięcia niskocząsteczkowych białek i monosacharydów preparat dializowany jest przez 24 godz., a następnie liofilizowany. Masę cząsteczkową otrzymanego w ten sposób acemannanu określano metodą wysokosprawnej chromatografii cieczowej (HPLC), z zastosowaniem kolumny Shodex Sugar (KS-804). Skład i strukturę polisacharydów analizowano za pomocą chromatografii gazowej i spektrometrii mas (GC-MS) oraz za pomocą spektrometrii magnetycznego rezonansu jądrowego 13C (13C NMR). Uzyskane z analiz chemicznych wartości były zgodne z danymi wcześniej podawanymi przez innych badaczy i wskazywały, iż wyizolowany polisacharyd jest czystym acemannanem, który według autorów może służyć jako standard do innych oznaczeń (15).
Jednym z pierwszych producentów, który otrzymał acemannan na skalę przemysłową, jest firma Carrington Laboratories (USA). Produkt nosi nazwę Acemannan lub Carrisyn™ (16). Jest to lek przeznaczony dla psów i kotów do leczenia włókniakomięsaka (17). Kolejnym produktem tworzonym przez firmę Carrington jest SaliCept Patch. Są to liofilizowane paski, które zawierają acemannan w postaci hydrożelu, stosowane w dentystyce (18). Czysty acemannan w porcjach od 10 do 100 mg produkowany jest także przez biotechnologiczną firmę Elicytil Oligotech – CarrVet. Preparat ten zawiera acemannan pochodzący z Aloe barbadensis Miller. Jest to specjalnie opracowany żel, mający za zadanie utrzymanie wilgotnego środowiska, co ma istotne znaczenie przy gojeniu się ran. Porównując jednak czas gojenia się odleżyn u 30 pacjentów, u których przez 10 tyg. stosowano opatrunki z solą fizjologiczną lub opatrunki hydrożelowe z acemannanem (firmy Carrington), nie zaobserwowano istotnych różnic (19).
Budowa, właściwości fizykochemiczne i metabolizm acemannanu
Acemannan jest polimerem liniowym. Mannoza, glukoza i galaktoza połączone są ze sobą wiązaniami glikozydowymi. W pozycjach C-2 i C-3 występują podstawniki O-acetylowe, a w pozycji C-6 znajduje się galaktoza (13). Cząsteczkowa budowa acemannanu przedstawiona została na rycinie 1.
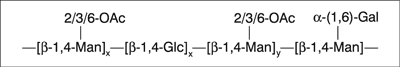
Ryc. 1. Cząsteczkowa budowa acemannanu (13)
Acemannan ma postać białego, bezpostaciowego proszku, dobrze rozpuszczającego się w wodzie oraz w 0,9% NaCl (20). Istotny wpływ na charakter rozpuszczalności ma pochodzenie acemannanu oraz stopień przetworzenia, co jest istotne w procesie wytwarzania leków (21). Masa cząsteczkowa wynosi zwykle 30-40 kDa, ale z surowego materiału można wyekstrahować cząsteczki nawet o masie do 5000 kDa (14).
Badania z udziałem zwierząt wykazały, że acemannan podany doustnie dostaje się do krwiobiegu po 90 min. W przewodzie pokarmowym ulega fragmentacji przez bakterie jelitowe. Komórki nabłonkowe wyściełające jelito mają swoiste receptory mannozowe, które aktywnie wychwytują mannozę, a tym samym acemannan z jelit, transportując go do krwi. Z krwi trafia on głównie do wątroby, ale także do śledziony, mózgu, nerek, serca, trzustki i grasicy. Z doświadczenia, w którym acemannan został oznakowany radioaktywnym węglem C14, wiadomo, że jest on metabolizowany w organizmie; 86,4% radioaktywnego węgla stwierdzono w wydychanym powietrzu, a tylko 2,16% w moczu i kale.
Ustalono, że masa cząsteczkowa acemannanu odpowiednia do miejscowego zastosowania powinna wynosić od 1 do 2 mil Da. Jako lek do iniekcji powinien mieć masę 100 kDa (14).
Aktywność biologiczna acemannanu
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Ray A, Aswatha SM. An analysis of the influence of growth periods on physical appearance, and acemannan and elemental distribution of Aloe vera L. gel. Jnd Crop Prod 2013; 48:36-42. 2. Zamiara K. Aloes – jego tajemnicza moc. Farm Pol 2010; 66:495-7. 3. Grace OM, Buerki S, Symonds MRE i wsp. Evolutionary history and leaf succulence as explanations for medicinal use in aloes and the global popularity of Aloe vera. BMC Evol Biol 2015; 15:29. DOI: 10.1186/s12862-015-0291-7. 4. Chandegara VK, Varshney AK. Aloe vera L. processing and products: A review. Int J Med Arom Plants 2013; 3:492-506. 5. Ahlawat KS, Khatkar BS. Processing, food applications and safety of Aloe vera products: a review. J Food Sci Technol 2011; 48:525-33. 6. Nandal U, Bhardwaj RL. Aloe vera for human nutrition, health and cosmetic use – A review. Int Res J Plant Sci 2012; 3:38-46. 7. Pareek S, Nagaraj A, Sharma P i wsp. Aloe vera: a herb with medical properties. IJOCR 2013; 1:47-50. 8. Radha MH, Laxmipriya NP. Evaluation of biological properties and clinical effectiveness of Aloe vera: A systematic review. J Trad Compl Med 2015; 5:21-6. 9. Cieślik E, Turcza K. Właściwości prozdrowotne aloesu zwyczajnego Aloe vera (L.) Webb. (Aloe barbadensis Mill). Post Fitoter 2015; (2):117-24. 10. Hamman JH. Composition and applications of Aloe vera leaf gel. Molecules 2008; 13:1599-616. 11. Javed S, Atta-Ur R. Aloe vera gel in food, health products, and cosmetic industry. Stud Nat Pro Chem 2014; 41:261-85. 12. Roge A, Mikołajewska E, Warwas M. Żel aloesowy – miejscowe zastosowania w stomatologii. Farm Pol 2015; 71: 367-75. 13. Talmadge J, Chavez J, Jacobs L i wsp. Fractionation of Aloe vera L. inner gel, purification and molecular profiling of activity. Int Immunopharmacol 2004; 4:1757-73. 14. Cowsert ML. Biological activities of acemannan, grudzień 2010. https://www.symmetryglobal.com/pdf/bioactivofacemannan.pdf. 15. Boonyagul S, Banlunara W, Sangvanich P i wsp. Effect of acemannan, an extracted polysaccharide from Aloe vera, on BMSCs proliferation, differentiation, extracellular matrix synthesis, mineralization, and bone formation in a tooth extraction model. Odontology 2014; 102:310-7. 16. Reynolds T, Dweck AC. Aloe vera leaf gel: a review update. J Ethnopharmacol 1999; 68:3-37. 17. King GK, Yates KM, Greenlee PG i wsp. The effect of acemannan immunostimulant in combination with surgery and radiation therapy on spontaneous canine and feline fibrosarcomas. J Am Animal Hosp Assoc 1995; 31:439-47. 18. Poor MR, Hall JE, Poor AS. Reduction in the incidence of alveolar osteitis in patients treated with the SaliCept Patch, containing acemannan hydrogel. J Oral Maxillofac Surg 2002; 60:374-9. 19. Thomas DR, Goode PS, LaMaster K i wsp. Acemannan hydrogel dressing versus saline dressing for pressure ulcers. A randomized, controlled study. Adv Wound Care 1998; 11:273-6. 20. Yates KM. Acemannan Review. CelaCare Technologies, kwiecień 2012. http://www.sanitaaloebynature.com/pdf/acemannan_review.pdf. 21. Nema J, Shrivastava SK, Mitra NG. Physicochemical study of acemannan polysaccharide in Aloe species under the influence of soil reaction (pH) and moisture application. AJPAC 2012; 6:132-6. 22. Lissoni P, Rovelli F, Brivio F i wsp. A randomized study of chemotherapy versus biochemotherapy with chemotherapy plus Aloe arborescens in patients with metastatic cancer. In vivo 2009; 23:171-6. 23. Montaner JS, Gill J, Singer J i wsp. Double-blind placebo-controlled pilot trial of acemannan in advanced human immunodeficiency virus disease. J Acquir Immune Syndr Hum Retrovirol 1996; 12:153-7. 24. Tarakji B, Saleh LA, Umiar A i wsp. Systemic review of dry socket: aetiology, treatment, and prevention 2015; 9:ZE10-3. 25. Preetha S. An overview of dry socket and its management. IOSR J Dent Med Sci 2014; 13:32-5. 26. Kaya GS, Yapici G, Savaş Z i wsp. Comparison of Alvogyl, SaliCept Patch, and Low-Level laser therapy in the management of alveolar osteitis. J Oral Maxillofac Surg 2011; 69:1571-7. 27. Jansisyanont P, Tiyapongprapan S, Chuenchompoonut V i wsp. The effect of acemannan sponges in post-extraction socket healing: a randomized trial. J Oral Maxillofac Surg Med Pathol 2015; 432. DOI: org/10.1016/j.ajoms.2015.07.006. 28. Jettanacheawchankit S, Sasithanasate S, Sangvanich P i wsp. Acemannan stimulates gingival fibroblast proliferation; expressions of keratinocyte growth factor-1, vascular endothelial growth factor, and type I collagen; and wound healing. J Pharmacol Sci 2009; 109:525-31. 29. Chavan M, Jain H, Diwan N i wsp. Recurrent aphthous stomatitis: a review. J Oral Pathol Med 2012; 41:577-83. 30. Górska R. Diagnostyka i leczenie chorób błony jamy ustnej. Med Tour Press Int, Warszawa 2011. 31. Bhalang K, Thunyakitpisal P, Rungsirisatean N. Acemannan, a polysaccharide extracted from Aloe vera, is effective in the treatment of oral aphthous ulceration. J Altern Complement Med 2013; 19:429-34. 32. Songsiripradubboon S, Banlunara W, Sangvanich P i wsp. Clinical, radiographic, and histologic analysis of the effects of acemannan used in direct pulp capping of human primary teeth: short-term outcomes. Odontology 2016 Sep; 104(3):329-37. DOI: 10.1007/s10266-015-0215-4. 33. Jittapiromsak N, Sahawat D, Banlunara W i wsp. Acemannan, an extracted product from Aloe vera, stimulates dental pulp cell proliferation, differentiation, mineralization, and dentin formation. Tissue Eng Part A 2010; 16:1997-2006. 34. Tello CG, Ford P, Iacopino AM. In vitro evaluation of complex carbohydrate denture adhesive formulations. Quintessence Int 1998; 29:585-93. 35. Escobedo-Lozano AY, Domard A, Velázquez C i wsp. Physical properties and antibacterial activity of chitosan/acemannan mixed systems. Carbohydr Polym 2015; 115:707-14.