*Michał Michalik, Adrianna Podbielska-Kubera, Agnieszka Dmowska-Koroblewska
Leczenie chrapania metodą korekcji podniebienia miękkiego z wykorzystaniem lasera diodowego w technice palisadowej
Diode laser-assisted uvulopalatoplasty using palisade technique
Department of Otolaryngology, MML Medical Center, Warsaw, Poland
Head of Department: Michał Michalik, MD, PhD
Streszczenie
Wstęp. Drożność dolnej części górnych dróg oddechowych zależy od stabilnego napięcia mięśni gardła, podniebienia miękkiego i języka. Konsekwencją zmniejszenia napięcia mięśni oddechowych jest powtarzające się całkowite lub częściowe zwężenie dróg oddechowych. Wówczas przepływające powietrze wywołuje drgania tkanek miękkich, które słyszane jest jako chrapanie.
Materiał i metody. W badaniu brało udział 34 pacjentów: 27 mężczyzn i 7 kobiet. Zastosowano leczenie chrapania metodą korekcji podniebienia miękkiego z wykorzystaniem lasera diodowego dwutlenkowęglowego, o długości fali 810 nm, mocy 5 W oraz długości impulsacji 4 sekundy.
Przed wykonaniem badania pacjenci zostali poddani ocenie laryngologicznej, zebrano wywiad dotyczący chorób przewlekłych. Ponadto pacjenci wypełnili 2 ankiety: kwestionariusz do diagnostyki przesiewowej zaburzeń oddychania w czasie snu oraz kwestionariusz Skali Senności Epworth. Dodatkowo wykonano badanie tomografii komputerowej 3D oraz rynometrię akustyczną. Wszystkie badania powtórzono 3 miesiące po zabiegu.
Wyniki. Zabieg wykonano u 34 osób. Ustąpienie dolegliwości zaobserwowano u 21 osób, a zmniejszenie objawów – u 13 osób. W grupie badawczej nie znaleźli się pacjenci, u których nie nastąpiłaby poprawa. Żaden z pacjentów nie zgłosił powikłań.
Wnioski. U pacjentów uzyskano dobry efekt usztywnienia struktur podniebienia, co przyczyniło się do ustąpienia chrapania. Do zalet stosowania lasera diodowego w technice palisadowej zaliczamy bezpieczeństwo stosowania, małą inwazyjność, krótki czas gojenia, minimalne ryzyko powikłań. Zabieg przeprowadzany jest w trybie ambulatoryjnym, w znieczuleniu miejscowym.
Summary
Introduction. The patency of the lower part of the upper respiratory tract depends on the muscle tone of pharynx, soft palate and tongue muscles. The consequence of the lowered tone of these muscles is recurrent total or partial narrowing of the airways. In this case, the turbulent airflow causes soft tissue vibration, which is heard as snoring.
Material and Methods. The study included 34 patients: 27 men and 7 women. Carbon dioxide diode laser-assisted uvulopalatoplasty was employed. The diode laser with a wavelength of 810 mm, power of 5 W, and pulse length of 4 seconds was used.
Before the procedure, all the patients underwent laryngological assessment. Medical history of the patients was also collected. In addition, the patients completed 2 questionnaires: a sleep disorder screening questionnaire and Ephworth Sleepiness Scale. Moreover, a 3D CT scan and acoustic rhinometry were performed. All the tests were repeated 3 months after the procedure.
Results. The procedure was performed in 34 patients. Complete clinical response was observed in 21 cases, and a partial response was seen in 13 cases. There were no patients in the study group who had not experienced at least a partial improvement of symptoms. None of the patients reported any complications.
Conclusions. Good clinical outcome was obtained in all the patients after obtaining palatal stiffening, which contributed to the resolution of symptoms. The advantages of diode laser-assisted uvulopalatoplasty using palisade technique include the safety of the procedure, minimal invasiveness, short healing time, and a low risk of complications. The procedure is performed on an out-patient basis under local anesthesia.
Wstęp
Zaburzenia oddychania w czasie snu
Do zaburzeń oddychania podczas snu zalicza się zespół wzmożonej oporności górnych dróg oddechowych, zespół obturacyjny zaburzeń oddychania podczas snu oraz chrapanie pierwotne (1).
Drożność dolnej części górnych dróg oddechowych (tj. nieobejmującej dróg oddechowych w obrębie jamy nosowej) zależy od stabilnego napięcia mięśni gardła, podniebienia miękkiego i języka (1). Większa część górnych i dolnych dróg oddechowych otoczona jest rusztowaniem kostnym (nos, krtań) lub chrzęstnym (tchawica), które utrzymuje ich drożność (1). Ściany gardła utworzone są natomiast wyłącznie przez tkanki miękkie (1). Drożność gardła jest utrzymywana poprzez napięcie mięśni stanowiących przednią oraz boczne ściany gardła (1).
Konsekwencją zmniejszenia napięcia mięśni oddechowych jest powtarzające się całkowite lub częściowe zwężenie dróg oddechowych (1). W tej sytuacji ujemne ciśnienie w drogach oddechowych w czasie wdechu jest większe niż napięcie mięśni stabilizujących te drogi. Dochodzi do zwężenia cieśni gardła, a przepływające powietrze wywołuje drgania tkanek miękkich słyszane jako chrapanie (ryc. 1) (1). Prędkość przepływu powietrza wzrasta w miejscu zwężenia w drogach oddechowych (efekt Bernoulliego) (2). W przypadku osiągnięcia ciśnienia zamykającego dochodzi do zwężenia lub zamknięcia dróg oddechowych (2). Zwężenie lub całkowite zamknięcie światła górnych dróg oddechowych może wystąpić na całej długości, ale najczęściej dotyczy gardła środkowego i dolnego (1). Następujące hipoksja i hiperkapnia powodują zwiększanie wysiłku oddechowego i przebudzenie, które przyczynia się do wzrostu napięcia mięśni i udrożnienia gardła. W efekcie dochodzi do krótkotrwałej hiperwentylacji umożliwiającej ponowne zaśnięcie (2).
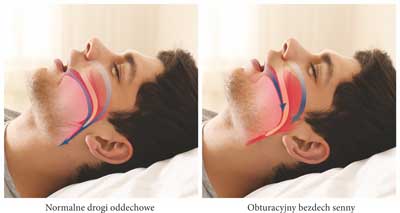
Ryc. 1. Porównanie prawidłowych dróg oddechowych z drogami oddechowymi w obturacyjnym bezdechu sennym
Chrapanie
Chrapanie to wibracja tkanek górnych dróg oddechowych i wynikający z niej dźwięk, spowodowany przez częściową niedrożność tego odcinka dróg oddechowych (3). W początkowym stadium chrapanie może pozostać niezauważone przez chorego, jednak jest uciążliwe dla rodziny pacjenta. Z wyników badań dotyczących problemu chrapania w opinii społecznej, wykonanych przez TNS Polska w 2016 roku na zlecenie Centrum Medycznego MML, wynika, że problem chrapania jest coraz częściej rozpoznawany, co wynika zarówno z bardziej powszechnego dostępu do technik diagnostycznych, jak również ze samoświadomości problemu wśród pacjentów (4). Chrapanie bezpośrednio wpływa na pogorszenie jakości snu i w opinii badanych może przekładać się na szereg problemów zdrowotnych (4). Chrapanie obserwuje się u ok. 20% mężczyzn i 5% kobiet w wieku 30–35 lat (3). Występowanie problemu nasila się wraz z wiekiem. Po 60 r.ż. częstość chrapania szacuje się na 60% u mężczyzn i 40% u kobiet (3).
Najgroźniejszym powikłaniem chrapania jest bezdech senny (5). Jako obturacyjny bezdech senny (OSA – ang. obstructive sleep apnea) określa się epizody powtarzających się spłyceń oddechu lub bezdechów z desaturacją i przebudzeniem podczas snu (5). Bezdech obserwuje się u większości osób chrapiących (3). Do głównych powikłań zaburzeń oddychania zaliczamy uczucie stałego zmęczenia, suchość w jamie ustnej i gardle, bóle głowy po przebudzeniu, senność w ciągu dnia, zaburzenia funkcji poznawczych oraz depresję (4). OSA wiąże się również ze zwiększonym ryzykiem wystąpienia poważnych chorób, takich jak choroby sercowo-naczyniowe, udar mózgu, cukrzyca, nadciśnienie tętnicze, pooperacyjne powikłania sercowo-naczyniowe lub oddechowe (5). W badaniu Cardiovascular Health Study (6) potwierdzono związek objawów OSA, w tym senności w ciągu dnia, bezdechów i chrapania z wyższym poziomem glukozy na czczo oraz 2 godziny po posiłku, a także niższą wrażliwością na insulinę.
Chrapanie może być skutkiem występowania patologii w obrębie jamy nosowej, gardła, krtani lub wszystkich tych struktur (5). Do patologii w rejonie jamy nosowej można zaliczyć przerost małżowin nosowych, krzywą przegrodę nosową oraz polipy nosa (5). Do głównych anomalii w obrębie gardła, które mogą być odpowiedzialne za chrapanie, należą: przerost języczka i/lub języka, zbyt wiotkie, przerośnięte podniebienie miękkie, przerost migdałków, wiotkość ścian bocznych gardła (5).
Rycina 2 przedstawia wyniki badania tomografii komputerowej pacjenta z odtworzoną prawidłową drożnością po operacji. Na rycinie 3 przedstawiono rekonstrukcję 3D tomografii komputerowej pozwalającą na określenie poziomu niedrożności.
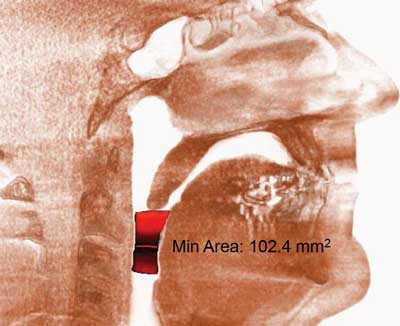
Ryc. 2. Badanie tomografii komputerowej przedstawiające odtworzoną prawidłową drożność po operacji
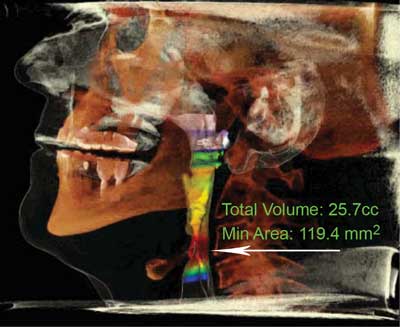
Ryc. 3. Określenie poziomu niedrożności (obszar zaznaczony strzałką) w rekonstrukcji 3D tomografii komputerowej
Diagnostyka i leczenie chrapania
Chrapanie stanowi wskazanie do wizyty u laryngologa i przeprowadzenia diagnostyki. Pierwszy etap diagnostyki to szczegółowy wywiad i badanie przedmiotowe. Kolejne etapy obejmują kwalifikację do zabiegów okolicy nosa, podniebienia i języka (5).
Opracowano kilka kwestionariuszy, aby zidentyfikować grupy wysokiego ryzyka chrapania.
Kwestionariusze składają się z pytań dotyczących objawów zaburzeń oddychania (np. senność/zmęczenie w ciągu dnia), chorób współistniejących (np. nadciśnienie tętnicze, otyłość) oraz indywidualnych predyspozycji pacjenta (wiek, płeć, obwód szyi) (7).
Jednym z częściej stosowanych kwestionariuszy jest kwestionariusz STOP-BANG. Kwestionariusz ocenia następujące objawy i czynniki ryzyka: chrapanie (S – ang. snoring), zmęczenie (T – ang. tiredness), obserwowany bezdech (O – ang. observed stop of breathing), ciśnienie krwi (P – ang. pressure), BMI powyżej 35 (B), wiek powyżej 50 lat (A – ang. age), duży obwód szyi (N – ang. neck), oraz płeć męska (G – ang. gender) (1). Inną możliwością jest użycie Kwestionariusza Berlińskiego (KB), który ocenia obecność i częstotliwość chrapania, obecność bezdechów, senność w ciągu dnia, nadciśnienie i otyłość (1). KB ma wysoką czułość (69–86%) i swoistość (56–95%) w diagnostyce OSA (5).
Przydatnym narzędziem skriningowym jest również Skala Senności Epworth. Narzędzie to służy ocenie senności w ciągu dnia. Pacjent jest proszony o ocenę szansy zaśnięcia w 8 sytuacjach (8). Uzyskuje się wyniki skali 0–24 punkty. Rezultat powyżej 10 punktów sugeruje zaburzenie snu, niższy – uogólnione zmęczenie (4).
Same kwestionariusze są uważane za niewystarczające do badań przesiewowych (5). Poza kwestionariuszami do diagnostyki chrapania i bezdechów stosuje się badanie polisomnograficzne, endoskopię w czasie snu farmakologicznego (ang. DISE – drug-induced sleep endoscopy), tomografię komputerową 3D, diagnostykę laboratoryjną oraz domowe testy bezdechu.
Polisomnografia stanowi standard diagnostyki zaburzeń oddychania podczas snu (2, 7). W tej metodzie używa się wielu czujników, które umożliwiąją jednoczesne rejestrowanie przepływu powietrza, saturacji krwi, wysiłku oddechowego i aktywności elektrycznej serca, mózgu, oczu i mięśni. Niektóre aparaty posiadają także czujniki pozycji ciała, ruchów klatki piersiowej, brzucha i kończyn, a niekiedy rejestratory obrazu i dźwięku (9). Polisomnografia jest kosztowna i czasochłonna, wymaga specjalistycznego sprzętu w laboratorium i wykwalifikowanego personelu (9).
Poligrafia to prostsza wersja polisomnografii. Może być stosowana jako badanie przesiewowe i wykonywana w szpitalu lub w domu (10). Poligrafia nie obejmuje elektroencefalografii, elektrookulogramu i pomiaru napięcia mięśni, jest mniej dokładna niż polisomnografia, zwykle jednak wystarczająca do postawienia właściwego rozpoznania (10). W niektórych przypadkach konieczne może być wykonanie pełnej polisomnografii (10).
Tomografia komputerowa 3D uwidacznia miejsca niedrożności w górnych drogach oddechowych, w tym wiele nieprawidłowości związanych z chrapaniem m.in. krzywą przegrodę nosową, przerośnięte małżowiny nosowe, przerośnięte tkanki gardła, migdały, oraz zbyt duże podniebienie miękkie czy język (11). Do zalet tomografii należy jej bezbolesność, nieinwazyjność i szybki czas wykonania badania.
Istnieje możliwość wykonania domowego testu bezdechu. Badanie takie jest wskazane u dorosłych w wieku od 18 do 65 lat, z wysokim prawdopodobieństwem umiarkowanego do ciężkiego OSA oraz u osób, u których wykonanie badania polisomnograficznego nie jest możliwe z powodów bezpieczeństwa lub ze względu na konieczność utrzymania stanu bezruchu, umiarkowaną do ciężkiej chorobę płuc, choroby nerwowo-mięśniowe czy niewydolność serca (8). Domowe testy bezdechu stanowią użyteczny dodatek do diagnostyki obturacyjnego bezdechu sennego, ponieważ są proste, obiektywne i ekonomiczne, umożliwiając przy tym ocenę objawów OSA. Domowe testy bezdechu mogą jednak niedoszacowywać nasilenie zaburzeń oddychania w czasie snu. Nie wiadomo również, w jakim stopniu czas badania rejestrowanego przez urządzenie reprezentuje rzeczywisty sen (12).
Wybór odpowiedniej metody leczenia zależy od wielu czynników, które wpływają na budowę struktur głowy i szyi. Do tych czynników zaliczamy m.in. wiek, płeć, masę ciała oraz rasę (5). Ponadto należy wziąć pod uwagę objawy zgłaszane przez pacjenta (5). Kluczowe jest określenie miejsca przewężenia prowadzącego do wystąpienia bezdechów i chrapania. Równolegle z leczeniem zabiegowym niezbędne są zmiany stylu życia: zmniejszenie masy ciała, zaprzestanie palenia tytoniu, unikanie środków uspokajających, ograniczenie kofeiny, unikanie spożycia alkoholu wieczorem, zmniejszenie hałasu w sypialni i odpowiednią wentylację, wygodne łóżko, odpowiednia ilość snu, zachowanie właściwej pozycji podczas snu (2, 5).
W leczeniu chrapania i bezdechów przydatne mogą być ponadto aparaty wspomagające oddychanie (CPAP – ang. Continuous Positive Airway Pressure – stałe dodatnie ciśnienie w drogach oddechowych) (13). Często wykorzystywane urządzenia do jamy ustnej oraz aparaty nazębne (OA – ang. oral appliance) poprawiają drożność górnych dróg oddechowych poprzez zmianę położenia języka i powiązanych struktur górnych dróg oddechowych (13).
Zastosowanie stymulatora nerwu podjęzykowego jest skuteczne u chorych z wielopoziomowym zapadaniem w obrębie górnych dróg oddechowych (14).
Zabiegi chirurgiczne nosa i zatok poprawiają drożność górnych dróg oddechowych i zwiększają skuteczność CPAP oraz aparatów doustnych (2). W przypadku występowania patologii w obrębie przegrody nosa wykonuje się zabieg septoplastyki (2). Inną przyczyną utrudnionego oddychania przez nos jest przerost małżowin nosowych. W takich przypadkach wykonuje się zabieg conchoplastyki. Wycięcie migdałków (tonsillektomia) jest obecnie podstawą metodą chirurgiczną leczenia zaburzeń oddechania w czasie snu u dzieci spowodowanego przerostem migdałków (6, 15). Zabiegi chirurgiczne u chorych z bezdechem śródsennym uwzględniają także chirurgię bariatryczną ułatwiającą utratę wagi i tracheostomię (16). Tracheostomia jest wskazana u pacjentów, którzy odmówili leczenia metodą CPAP, a także wówczas, gdy zawiodły inne metody leczenia chirurgicznego (17).
Zaawansowane techniki chirurgiczne w leczeniu chrapania i bezdechów sennych to operacje wielopoziomowe – uwulopalatofaryngoplastyka, operacja języka, żuchwy itp.
Uwulopalatofaryngoplastyka polega na chirurgicznym usunięciu języczka i tkanki z podniebienia miękkiego w celu poszerzenia cieśni gardzieli i likwidacji oporów w części ustnej gardła (1). Zabiegi chirurgiczne MMA (ang. maxillomandibular advancement) trwale pociągają żuchwę do przodu.
Zastosowanie małoinwazyjnych technik chirurgicznych umożliwia pacjentowi powrót do domu w dniu zabiegu. Ponadto techniki małoinwazyjne znacznie zmniejszają ryzyko krwawień i powikłań pooperacyjnych. Takie zabiegi wskazane są u chorych z krzywą przegrodą nosową, przerostem języka i przerostem migdałów. W Centrum Medycznym MML dostępnych jest wiele technik stosowanych w leczeniu zaburzeń oddychania w czasie snu. Najczęściej stosuje się: metodę Celon (RFITT – ang. Radiofrequency Induced Thermotherapy), technikę plazmową, technikę z zastosowaniem skalpela harmonicznego, wszczepienie implantów polietylenowych oraz zabiegi z wykorzystaniem lasera diodowego.
Metoda Celon/Koblacji (RFITT) polega na zmianie proporcji struktur w obrębie podniebienia miękkiego i języka za pomocą fal elektromagnetycznych (17). Celem zabiegu w przypadku przerostu podniebienia miękkiego jest wytworzenie drobnych blizn w obrębie zbyt wiotkiego podniebienia, co usztywnia jego strukturę (18). Tę technikę charakteryzuje szybkie gojenie się ran (19).
Nóż harmoniczny wykorzystuje wibracje ultradźwiękowe do cięcia i natychmiastowej koagulacji tkanek (20). Nóż zaczyna działać dopiero w ruchu, poprzez zmianę energii elektrycznej na mechaniczną. Zastosowanie noża redukuje czas operacji i śródoperacyjną utratę krwi w wielu procedurach otolaryngologicznych (20).
Metodą wprowadzoną do leczenia chrapania i bezdechów sennych przez Centrum Medyczne MML jest małoinwazyjny zabieg przy zastosowaniu lasera diodowego w technice palisadowej. Zastosowania lasera diodowego obejmują korekcję podniebienia miękkiego, łuków podniebienno-gardłowych i podniebienno-językowych oraz języczka. W czasie zabiegu wprowadza się włókno lasera diodowego w podniebienie miękkie, w wyniku czego w obrębie podniebienia miękkiego powstają linijne zrosty śródtkankowe usztywniające podniebienie i przesuwające je w płaszczyźnie pionowej (ryc. 3). Zapobiega to drganiom tkanki w trakcie snu, co pozwala na poprawę komfortu snu przy maksymalnie poszerzonych drogach oddechowych. Przedstawiona technika pozwala na skuteczną i szybką poprawę przepływu powietrza, eliminując objawy związanie z zaburzeniami oddychania w czasie snu. Zabieg trwa około 30 minut i jest wykonywany ambulatoryjnie w znieczuleniu miejscowym bądź w sedacji. Możliwy jest szybki powrót do codziennej aktywności. Stanowi to niewątpliwą przewagę lasera diodowego w technice palisadowej nad innymi procedurami.
Cel pracy
Celem pracy było wykazanie skuteczności zastosowania techniki lasera diodowego w technice palisadowej, w leczeniu nadmiernie wiotkiego i wydłużonego podniebienia miękkiego u pacjentów z zaburzeniami oddychania podczas snu.
Materiał i metody
Badanie miało charakter retrospektywny. W badaniu wzięło udział 34 pacjentów: 27 mężczyzn i 7 kobiet. Zastosowano laser diodowy dwutlenkowęglowy, o długości fali 810 nm, mocy w 5 W oraz o długości impulsacji 4 sekundy.
U pacjentów przed przystąpieniem do badania zebrano wywiad dotyczący chorób przewlekłych. Ponadto pacjenci otrzymali do wypełnienia 2 ankiety: kwestionariusz do diagnostyki przesiewowej zaburzeń oddychania w czasie snu (poszerzona, autorska ankieta oparta o Kwestionariusz Berliński) (ryc. 4) oraz kwestionariusz skali senności Epworth przygotowany przez Brytyjskie Towarzystwo Chrapania i Bezdechu Sennego (ryc. 5), służący ocenie senności i prawdopodobieństwa zaśnięcia w sytuacjach życia codziennego (21).



Ryc. 4. Kwestionariusz do diagnostyki przesiewowej zaburzeń oddychania w czasie snu

Ryc. 5. Skala senności dziennej Epworth
Pacjentów poddano badaniu laryngologicznemu obejmującemu nos zewnętrzny, nozdrza przednie, przegrodę nosową i dolne małżowiny nosowe. Oceniono także podniebienie miękkie wg skali Mallampatiego (tab. 1) oraz migdałki podniebienne wg skali Pirqueta (tab. 2). Badania wykonano w trybie ambulatoryjnym.
Tab. 2. Skala Pirqueta
| Stopień | Opis |
| I° | Migdałki są schowane za łukami podniebiennymi |
| II° | Migdałki sięgają do łuków podniebiennych |
| III° | Migdałki przekraczają linię łuków podniebiennych |
| IV° | Migdałki zajmują połowę szerokości gardła |
| V° | Migdałki stykają się ze sobą na tylnej ścianie gardła |
Tab. 1. Skala Mallampatiego
| Stopień | Opis |
| 1. | widoczne podniebienie miękkie, języczek, gardło i zarys migdałków |
| 2. | widoczne podniebienie miękkie i języczek |
| 3. | widoczne podniebienie miękkie i podstawa języczka |
| 4. | nie widać podniebienia miękkiego |
U wszystkich pacjentów przed zabiegiem wykonano badanie tomografii komputerowej 3D, aby uwidocznić patologie będące przyczyną chrapania. W przypadku naszej grupy badawczej przyczyny obejmowały krzywą przegrodę nosową, przerośnięte małżowiny nosowe, przerośnięte tkanki gardła oraz migdałki, a także zbyt duże podniebienie miękkie czy język. U każdego pacjenta wwykonano także badanie rynometrii akustycznej.
Podczas zabiegu pacjenci spoczywali na stole operacyjnym w pozycji na wznak. Standardowe monitorowanie obejmowało EKG, pomiar częstości akcji serca i ciśnienia tętniczego krwi oraz saturację. Zastosowano znieczulenie miejscowe powierzchniowe 10% lignokainą oraz nasiękowe: Dentocaine (40 mg chlorowodorku artkainy i 0,01 mg adrenaliny).
Wszystkim pacjentom zostały przepisane leki przeciwbólowe. Bezpośrednio po zabiegu mogli opuścić ambulatorium, a w ciągu 2–3 godzin możliwe było przyjmowanie pokarmów i napojów. Wizyty kontrolne zaplanowano na tydzień i 6 tygodni po zabiegu. Kontrola obejmowała ankietę, wywiad i badanie endoskopowe.
Wyniki leczenia oceniano 3 miesiące po zabiegu. Przeprowadzono badanie laryngologicznie, a ponadto badanie endoskopowe, tomografię komputerową 3D oraz rynometrię akustyczną. Pacjenci byli także poproszeni o ponowne wypełnienie ankiet.
Jeżeli podniebienie miękkie było napięte, a objawy utrzymywały się, diagnostyka schorzenia była poszerzana o inne wymienione wcześniej techniki, w zależności od oceny klinicznej pacjenta.
Wyniki
Od 2007 do 2017 roku w Centrum Medycznym MML przeprowadzono 12 911 zabiegów leczących chrapanie i bezdechy podczas snu. Wśród pacjentów było 3228 kobiet i 9683 mężczyzn. Średni wiek pacjentów wynosił 46 lat w przypadku mężczyzn i 35 lat w przypadku kobiet. Średni czas trwania choroby wynosił 4 lata.
Wykonano 34 zabiegi techniką lasera diodowego w technice palisadowej. Ustąpienie dolegliwości zaobserwowano u 21 osób, zmniejszenie objawów – u 13 osób. W grupie badawczej nie znaleźli się pacjenci, u których nie nastąpiłaby poprawa. Nie wystąpiły powikłania takie jak krwawienie pooperacyjne, podwyższenie temperatury ciała, duszności.
Wyniki zabiegu oceniano 3 miesiące po wykonaniu procedury. Badanie satysfakcji pacjentów z wyników uzyskanych po leczeniu wykazało, że 26 pacjentów (76%) było bardzo zadowolonych, 8 pacjentów (24%) stwierdziło, że są dość zadowoleni z leczenia. Wzrosła również jakość snu: po 3 miesiącach od zabiegu w 30 na 34 przypadków (88%) pacjenci odczuwali mniejszy ucisk w gardle i ocenili, że mogą lepiej oddychać. Potwierdzono ponadto spadek głośności chrapania w ocenie subiektywnej partnerów osób chorych, a także zmniejszoną częstotliwość budzenia się z powodu chrapania oraz zmniejszoną suchość w jamie ustnej. Wyniki całościowe są w trakcie analizy.
Dyskusja
Biorąc pod uwagę złożoność patofizjologii bezdechu sennego postępowanie powinno być ustalane w zespołach wielodyscyplinarnych obejmujących lekarzy zajmujących się zaburzeniami oddychania podczas snu, ortodontów, chirurgów szczękowo-twarzowych i otolaryngologów (2).
Leczenie bezdechu i chrapania może odbywać się w ambulatoryjnie lub podczas hospitalizacji. Pacjenci z mniejszymi zmianami są kierowani do leczenia ambulatoryjnego. Zabiegi ambulatoryjne wskazane są w przypadku przerostu małżowin nosowych, wiotkiego podniebienia miękkiego oraz przerostu języczka. Leczenie to jest małoinwazyjne, nie wymaga specjalnego przygotowania, a zabieg trwa krótko, zazwyczaj do 30 minut, i odbywa się w znieczuleniu miejscowym. Krwawienie i podrażnienie tkanek jest niewielkie.
Zabieg chirurgiczny można zastosować jako leczenie pierwszego rzutu u wybranych pacjentów w każdym stadium OSA, u których występują anatomicznie nieprawidłowości przyczyniające się do zapadnięcia się górnych dróg oddechowych podczas snu (2).
Chirurgię wielopoziomową stosuje się u dorosłych pacjentów z OSA, u których zawiodły konwencjonalne lub alternatywne opcje leczenia (22). Wskaźniki sukcesu dla tych zabiegów są bardzo zmienne i zależne od podejścia chirurgicznego i doświadczenia chirurga (12). Młodszy wiek pacjenta (< 60 lat), niższy BMI (< 30 kg/m2) i brak chorób współistniejących są czynnikami związanymi z wyższymi wskaźnikami sukcesu (22).
Obecnie coraz częściej stosuje się techniki małoinwazyjne. Główne ich wykorzytanie to leczenie zaburzeń oddychania spowodowanych obturacją górnych dróg odechowych. W badaniach dotyczących skuteczności laserowej redukcji podstaw języka i nagłośni uzyskano obiecujące wyniki i znaczną poprawę wartości wskaźnika AHI (ang. apnea-hypopnea index – wskaźnik bezdechu/spłycenia oddechu) (17).
Techniką rozwijaną przez Centrum Medyczne MML jest zastosowanie lasera diodowego w technice palisadowej. W naszych obserwacjach jest to metoda zapewniająca bezpieczeństwo, małą inwazyjność, krótki czas gojenia, minimalne ryzyko powikłań oraz minimalny dyskomfort bólowy. Przewaga leczenia chrapania przy wykorzystaniu lasera diodowego w technice palisadowej nad innymi procedurami to przede wszystkim możliwość przeprowadzenia zabiegu w trybie ambulatoryjnym, w krótkim czasie (30–40 minut), w znieczuleniu miejscowym. Pacjent bezpośrednio po zabiegu może powrócić do codziennej aktywności. Stanowi to niewątpliwą zaletę w porównaniu do techniki Koblacji, w której czas rekonwalescencji trwa kilka dni, a występujący po zabiegu ból może wymagać podawania leków przeciwbólowych.
Wnioski
1. Przedstawiona technika operacyjna umożliwia uzyskanie subiektywnego zmniejszenia dolegliwości u pacjentów z OSA.
2. Zastosowana technika prowadzi do usztywnienia struktur wiotkich podniebienia miękkiego w płaszczyźnie pionowej opoprzez wytworzenie śródtkankowych zrostów.
3. Technika leczenia chrapania przy zastosowaniu lasera diodowego stanowi ważną alternatywę dla innych metod leczenia zaburzeń oddechowych związanych ze snem.
Piśmiennictwo
1. Slowik JM, Collen JF: Apnea, Obstructive Sleep Apnea. In: StatPearls. Treasure Island (FL): StatPearls Publishing. 2017; Available from: https://www.ncbi.nlm.nih.gov/books/NBK459252/.
2. Memon J, Manganaro SN: Apnea, Snoring And Obstructive Sleep, CPAP. In: StatPearls. Treasure Island (FL): StatPearls Publishing. 2018. Available from: https://www.ncbi.nlm.nih.gov/books/NBK441909/.
3. Chruściel-Nogalska M, Kozak M, Ey-Chmielewska H: Zespół obturacyjnego bezdechu podczas snu – podstawy diagnostyki i leczenia 2015; Dent For 2015; 43: 65-69.
4. Badanie wśród ogółu Polaków na temat chrapania. Raport TNS Polska dla Centrum Medycznego MML. 2016.
5. Chung JW, Kim N, Wee JH et al.: Clinical features of snoring patients during sedative endoscopy. Korean J Intern Med 2017; Available from: http://europepmc.org/abstract/med/29132198.
6. Muraki I, Wada H, Tanigawa T: Sleep apnea and type 2 diabetes. J Diabetes Investig 2018; 18. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1111/jdi.12823.
7. Corso R, Rusotto V, Gregoretti C, Cattano D: Perioperative management of obstructive sleep apnea: a systematic review. Minerva Anestesiol 2017; 84(1): 81-93.
8. Foldvary-Schaefer NR, Waters TE: Sleep-Disordered Breathing. Continuum (Minneap Minn) 2017; 23(4): 1093-1116.
9. Sutherland K, Almeida FR, de Chazal F, Cistulli PA: Prediction in obstructive sleep apnoea: diagnosis. Expert Rev Respir Med 2018; 12(4): 293-307.
10. Cundrle I Jr, Belehrad M, Jelinek M et al.: The utility of perioperative polygraphy in the diagnosis of obstructive sleep apnea. Sleep Med 2016; 25: 151-155.
11. Chousangsuntorn K, Bhongmakapat T, Apirakkittikul N et al.: Computed Tomography Characterization and Comparison With Polysomnography for Obstructive Sleep Apnea Evaluation. J Oral Maxillofac Surg 2017; 17: 31170-31179.
12. Aurora RN, Putcha N, Swartz R, Punjabi NM: Agreement Between Results of Home Sleep Testing for Obstructive Sleep Apnea with and Without a Sleep Specialist. Am J Med 2016; 129(7): 725-730.
13. Dicus Brookes CC, Boyd SB: Controversies in Obstructive Sleep Apnea Surgery. Oral Maxillofac Surg Clin North Am 2017; 29(4): 503-513.
14. Wray CM, Thaler ER: Hypoglossal nerve stimulation for obstructive sleep apnea: A review of the literature. World J Otorhinolaryngol Head Neck Surg 2016; 2(4): 230-233.
15. Zhang LY, Zhong L, David M, Cervin A: Tonsillectomy or tonsillotomy? A systematic review for paediatric sleep-disordered breathing. Int J Pediatr Otorhinolaryngol 2017; 103: 41-50.
16. Soose RJ: Novel Surgical Approaches for the Treatment of Obstructive Sleep Apnea. Sleep Med Clin 2016; 11(2): 189-202.
17. Ferguson MS, Magill JC, Kotecha BT: Narrative review of contemporary treatment options in the care of patients with obstructive sleep apnoea. Ther Adv Respir Dis 2017; 11(11): 411-423.
18. Olszewska E, Rutkowska J, Czajkowska A, Rogowski M: Selected surgical managements in snoring and obstructive sleep apnea patients. Med Sci Monit 2012; 18(1): CR13–CR18.
19. Hwang SY, Jefferson N, Mohorikar A, Jacobson I: Radiofrequency Coblation of Congenital Nasopharyngeal Teratoma: A Novel Technique. Case Rep Otolaryngol 2015; 2015: 634958.
20. Polacco MA, Pintea AM, Gosselin BJ, Paydarfar JA: Parotidectomy using the Harmonic scalpel: ten years of experience at a rural academic health center. Head Face Med 2017; 13: 8.
21. Johns MW. A new method for measuring daytime sleepiness: the Epworth Sleepiness Scale. Sleep 1991; 14: 540-545.
22. Cao MT, Sternbach JM, Guilleminault C: Continuous positive airway pressure therapy in obstuctive sleep apnea: benefits and alternatives. Expert Rev Respir Med 2017; 11(4): 259-272.
otrzymano: 2018-05-15
zaakceptowano do druku: 2018-06-21
Adres do korespondencji:
*Michał Michalik
Centrum Medyczne MML ul. Bagno 2, 00-112 Warszawa
Tel.: + 48 608-381-781
e-mail: m.michalik@mml.com.pl
New Medicine 2/2018Strona internetowa
czasopisma New MedicinePozostałe artykuły z numeru 2/2018:






