Karolina Raczkowska-Łabuda, Monika Jabłońska-Jesionowska, Jolanta Jadczyszyn, Magdalena Frąckiewicz, Maciej Pilch, *Lidia Zawadzka-Głos
Pneumoparotitis wywołany autogennie – opis przypadku rzadkiego schorzenia
Self-induced pneumoparotitis ? a rare case report
Department of Paediatric Otolaryngology, Medical University of Warsaw
Head of Department: Associate Professor Lidia Zawadzka-Głos, MD, PhD
Streszczenie
Pneumoparotitis (pneumoparotiditis, pneumosialoadenitis) to schorzenie rzadkie i często błędnie diagnozowane. Cechy odmy podskórnej w rzucie przyusznicy, szyi czy śródpiersia należą do niepokojących objawów, które bezzwłocznie należy wyjaśnić. Badanie TK stanowiące złoty standard diagnostyczny można w populacji dziecięcej z powodzeniem zastąpić badaniem USG. Sialografia stanowi dopełnienie obrazowania gruczołu i daje szansę na irygację przewodów ślinianki z zalegających złogów ? w prewencji nawracających stanów zapalnych. W artykule przedstawiono przypadek 12-latka, który świadomie, przez około pół roku, wypełniał obie przyusznice powietrzem, wytwarzając pneumocele prawego gruczołu o średnicy ok. 25 mm. Diagnostykę obrazową rozszerzono o badania z grupy chorób autoimmunologicznych. Przeprowadzono szczegółowy wywiad rodzinny. Zastosowano leczenie zachowawcze, w tym irygację przewodu Stenona deksametazonem, uzyskując pełne wycofanie objawów. W 3-miesięcznej obserwacji nie stwierdzono powiększenia pneumocele ani epizodu parotiditis.
Summary
Pneumoparotitis (pneumoparotiditis, pneumosialoadenitis) is a rare and frequently misdiagnosed condition. Signs of subcutaneous emphysema in parotid gland, the neck or the mediastinum are alarming symptoms that should be promptly addressed. Computed tomography, which is the gold diagnostic standard, may be successfully replaced with ultrasonography in the paediatric population. Sialography has a complementary role in the imaging of the gland, and allows for parotid duct irrigation to remove deposits and prevent recurrent inflammation. The paper presents a case of a 12-year-old boy who deliberately inflated his both parotid glands for about 6 months, and thus developed parotid pneumatocele with a diameter of about 25 mm. Diagnostic imaging was extended to include autoimmune diseases. Detailed family history was obtained. Conservative treatment, including dexamethasone irrigation of the Stensen’s duct, was used and the symptoms fully resolved. A 3-month follow-up showed no increase in the size of pneumatocele or episodes of parotiditis.
Wstęp
Ślinianki przyuszne u dzieci nie powinny być wyczuwalne w badaniu palpacyjnym. Zauważalna asymetria twarzy bądź jedno- lub obustronny obrzęk najczęściej związane są z obecnością patologii w obrębie przyusznicy. Wśród najczęstszych przyczyn należy wymienić: infekcje, choroby z grupy autoimmunologicznych, limfoproliferacyjnych, obstrukcje przewodów oraz guzy łagodne lub złośliwe. Szybko narastający obrzęk to typowo wynik infekcji wirusowej lub przewlekłego, nawracającego zapalenia ślinianek.
Termin „pneumoparotid” oznacza obecność powietrza w obrębie miąższu gruczołu lub przewodu wyprowadzającego Stenona (1, 2). Pneumoparotiditis to zapalenie ślinianki na bazie wstecznej inwazji patogenów przez poszerzone, w wyniku barotraumy, ujście przewodu (3). Ze względu na bogactwo flory jamy ustnej, mało prawdopodobne jest występowanie pneumoparotid bez pneumoparotiditis. Natomiast współwystępowanie wtórnego obrzęku zapalnego często prowadzi do błędnego rozpoznania prostego zapalenia ślinianki.
Do grupy ryzyka pneumoparoditis należą muzycy instrumentów dętych oraz dorośli z zaburzeniami psychicznymi (4, 5). Większość chorych jest świadoma swojej umiejętności wypełnienia gruczołu powietrzem. Większe wyzwanie diagnostyczne stanowią chorzy, u których proces ten zachodzi bezwiednie.
Opis przypadku
Chłopiec w wieku 12,5 roku został przyjęty na Oddział Otolaryngologii Dziecięcej WUM w trybie pilnym z powodu obrzęku prawego policzka. Półtora dnia wcześniej pacjent zakończył 7-dniową doustną terapię zapalenia ślinianki klindamycyną. Diagnozę i terapię zaproponowano na oddziale laryngologii innego ośrodka, w którym chory przebywał 5 dni poprzedzające leczenie w trybie ambulatoryjnym. W ówcześnie wykonanym badaniu USG ślinianki opisano stan zapalny gruczołu oraz jego torbiel w okolicy kąta żuchwy. Wykonano TK głowy (ryc. 1, 2).
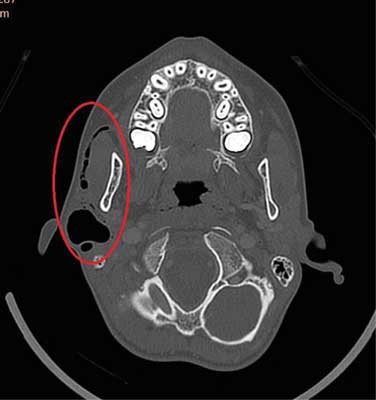
Ryc. 1. TK pacjenta z pneumoparotid. Widoczny poszerzony przewód Stenona oraz pneumocele w końcowym jego odcinku po stronie prawej
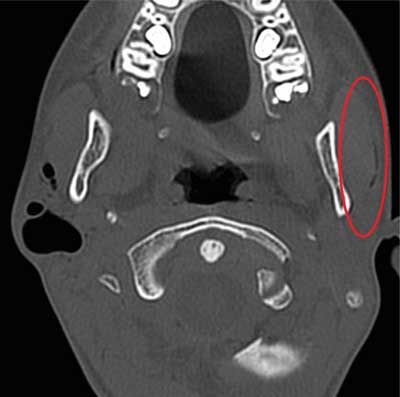
Ryc. 2. TK pacjenta z pneumoparotid. Widoczny poszerzony przewód Stenona po stronie lewej
Opisano: „W okolicy przyusznej, po stronie prawej, poniżej przewodu słuchowego zewnętrznego, w rzucie ślinianki widoczny zbiornik gazu o średnicy 23 mm, gaz widoczny jest także w przewodach ślinowych prawej ślinianki przyusznej oraz w przewodzie śliniankowym. Po stronie lewej gaz widoczny jest w przewodzie śliniankowym oraz w przewodach ślinowych w obrębie ślinianki. Widoczne powiększone węzły chłonne szyi do 21 mm. Przy dodatnim ciśnieniu w jamie ustnej zarówno przewody ślinowe, jak i zbiornik gazu po stronie prawej ulegają poszerzeniu. Obraz TK odpowiada najpewniej zdrenowanej torbieli przez przetokę do przewodów ślinowych, przy nieszczelnym ujściu i cofaniu się wstecznie powietrza do ślinianek”. Obrzęk policzka, zlokalizowany bezpośrednio pod płatkiem prawej małżowiny usznej, narósł ponownie w sposób gwałtowny, wywołując u dziecka umiarkowane dolegliwości bólowe. Przy przyjęciu wykładniki stanu zapalnego nie odbiegały od normy: CRP < 0,5, WBC ? 8,59 tys., LYMF ? 34,3% (N: 24,7-56,0%), NEUT ? 56,3% (N: 43-65%), MONO ? 6,6% (N: 4,4-12,3), EOSYNO ? 2,4% (N: 0,0-4,4%). Temperatura ciała wynosiła 36,6°C. W badaniu ORL nie obserwowano ewakuacji treści patologicznej z poszerzonego ujścia gruczołu, jedynie prawidłową wydzielinę z pęcherzykami powietrza. W dyżurowo wykonanym badaniu USG opisano: „Obie ślinianki przyuszne nie są powiększone, ale mają niejednorodną echostrukturę miąższu, bez zmian ogniskowych. Po stronie lewej niewielka ilość powietrza w przewodzie ślinianki, po stronie prawej duża ilość powietrza w rzucie ślinianki oraz niewielka ilość płynu, ok. 6-5 mm. Ślinianka przyuszna prawa z nieznacznie zwiększonym unaczynieniem. W obu okolicach podżuchwowych nieznacznie powiększone odczynowo węzły chłonne, do ok. 24 x 7 mm. Tkanki wokół ślinianek bez cech obrzęku”. Ze względu na obraz kliniczny i dane z wywiadu, jako profilaktykę parotiditis lekarz dyżurny Oddziału włączył do leczenia Amoksiklav i.v. Chory przyznał, że w ostatnich miesiącach „bawił się”, nadmuchując sobie obie ślinianki. Początkowo rozdęcie końcowego odcinka przewodu było niezauważalne, a opory napełniania gruczołu duże. Z czasem chłopiec „wypracował” pneumocele długości około 27 mm. Zeznał, że wrażenie „buzowania” przy opróżnianiu zmiany z powietrza sprawiało mu dużo radości.
Według deklaracji mamy, chłopiec dwukrotnie przechodził zapalenie przyusznicy po stronie prawej. Za każdym razem obserwowano wyciek treści ropnej z ujścia przewodu Stenona. Obie infekcje miały miejsce w ostatnim półroczu.
Pacjent w chwili przyjęcia pozostawał pod opieką poradni immunologicznej, gastroenterologicznej i kardiologicznej. Od kilku lat skarżył się na bóle śródbrzusza trwające kilka minut, bez związku z przyjmowanymi pokarmami. Mama dziecka potwierdziła brak apetytu syna, wydłużony czas przeżuwania posiłków i „kłopoty z przełykaniem” pokarmów stałych. Siatki centylowe były trudne do oznaczenia ze względu na brak pomiarów. W chwili badania masa ciała chłopca: 31 kg, lokowała się na 3. centylu (w 5. r.ż. na 25. c), a wysokość ciała: 149 cm, na 25. centylu (w 5. r.ż. na 75. c). Mama zwracała uwagę na nawracające infekcje GDO u chłopca, alergię (bez oznaczenia alergenów i bez leczenia), GERD (bez dokumentacji, bez leczenia) oraz wykluczoną celiakię (również brak dokumentacji). Dodatkową informacją z wywiadu rodzinnego było ustalenie, że u ojca chłopca rozpoznano i leczono przełyk Barretta.
Na Oddziale pobrano badania laboratoryjne celem oznaczenia: IgE całkowitego, amylazy w surowicy i moczu, anty-TPO, TSH, ANA, ANCA, IgA, IgM, IgG, EBV, CMV, RF, CRP, morfologii. Nieprawidłowy wynik uzyskano dla poziomu IgE całkowitego ? 163 KU/L (N: 0-100). Wykonano badanie USG, którego opis zacytowano wyżej.
Pacjent został zakwalifikowany do sialografii obustronnej. Zabieg wykonano w znieczuleniu miejscowym: „Podano kontrast (Imeron) przez cewnik założony do przewodu ślinianki przyusznej prawej ? wypełniono szeroki przewód ślinianki, w dystalnej części przewodu wypełniło się kilka drobnych przestrzeni oraz jedna znacznie większa od pozostałych. Przestrzenie te samoistnie opróżniają się z kontrastu (ryc. 3). Następnie podano kontrast (Imeron) przez cewnik założony do przewodu ślinianki przyusznej lewej ? wypełniono przewód ślinianki, rozgałęziający się w części dystalnej, która jest poszerzona (ryc. 4)”.
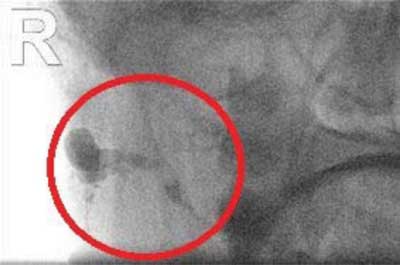
Ryc. 3. Fistulografia ślinianki przyusznej prawej. Widoczny poszerzony przewód oraz zbiornik, w jego końcowym odcinku, wypełniony kontrastem

Ryc. 4. Fistulografia ślinianki przyusznej lewej. Widoczny poszerzony przewód ? głównie w odcinku dystalnym
W trakcie badania zakwalifikowano chłopca do doprzewodowego podania deksametazonu. Irygacje powtarzano codziennie, obustronnie, do momentu deklaracji przez dziecko wrażenia bólu przez rozpieranie. Efekt leczenia monitorowano przy użyciu badania USG ślinianek oraz obserwację zmniejszających się objętości leku możliwych do aplikacji bez oporu tkanki. Początkowo podano 5 ml roztworu po stronie prawej i 3 ml po stronie lewej. Iniekcje zakończono w momencie, w którym radiolog opisał nieposzerzony przewód prawej przyusznicy ? po 6 dniach (uzyskując 1,5 ml po stronie prawej i 0,5 ml po stronie lewej) (ryc. 5).
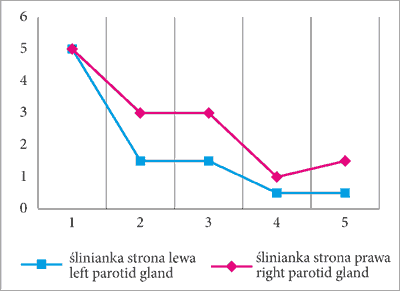
Ryc. 5. Podawane objętości deksametazonu do światła przewodów obu przyusznic
W badaniu USG: „Obie ślinianki przyuszne w normie wielkości, ale mają niejednorodną, nieprawidłową echostrukturę miąższu (prawa bardziej), bez zmian ogniskowych. Podskórnie w okolicy górnego bieguna ślinianki przyusznej prawej widoczna jest zmiana wypełniona powietrzem o średnicy 5 mm i przewód (długości ok. 9 mm) wypełniony powietrzem, biegnący od płatka ucha do górnego bieguna ślinianki. Przewód ślinianki nieposzerzony. Nie stwierdzam stanu zapalnego w obrębie ślinianek przyusznych. W obu okolicach podżuchwowych nieznacznie powiększone są odczynowo węzły chłonne, bardziej po stronie prawej, do ok. 21 mm, po lewej ? 14 mm. Tkanki wokół ślinianek bez zmian. Obraz ślinianek podżuchwowych i tarczycy jest prawidłowy”.
Wspólnie z lekarzami z Oddziału Gastroenterologii zakwalifikowano pacjenta do gastroskopii z biopsją przełyku celem wykluczenia eozynofilowego zapalenia przełyku (EoE). Uzyskano prawidłowy wynik zarówno w ocenie makroskopowej, jak i badania histopatologicznego.
Dwunastolatek został wypisany kolejnego dnia z zaleceniami intensywnej higieny jamy ustnej i spożywania dużej ilości kwaśnych produktów. Zakazano mu świadomego nadmuchiwania ślinianek, żucia gumy, gwizdania i gry na instrumentach dętych. W 3-miesięcznej obserwacji nie stwierdzono powiększenia pneumocele ani epizodu parotiditis.
Dyskusja
W literaturze można spotkać różne określenia na obecność powietrza w śliniance przyusznej: pneumoparotitis (6), pneumoparotiditis (7, 8), pneumosialoadenitis (9), anestezjologiczna/chirurgiczna świnka (10) czy pneumatocele przyusznicy (11-13). Obecnie autorzy skłaniają się ku nazwie pneumoparotitis, która ? w przeciwieństwie do pneumoparotiditis ? nie wskazuje na stan zapalny gruczołu.
Pneumoparotid może być związany z wykonywanym zawodem bądź wywołany autogennie. Bez względu na przyczynę powstania, schorzenie jest konsekwencją wzrostu ciśnienia w jamie ustnej i wstecznego przedostania się powietrza do światła przewodu Stenona i zrazików gruczołu. Może występować jednostronnie (11, 14, 15) bądź obustronnie (5, 6, 16) ? często asymetrycznie, jak u naszego pacjenta.
W literaturze dominują przypadki autogennie wywoływanego schorzenia zarówno przez dzieci, jak i przez dorosłych (5, 6, 11, 12, 14, 15, 17-19). Problem występuje głównie w kontekście zaburzeń natury psychologicznej, psychiatrycznej (4, 5, 20), traumatycznych doznań (22), tików nerwowych (14, 21) czy sposobu na uniknięcie szkoły (5, 14), a nawet więzienia (2). Opisano rozwinięcie pneumoparotitis na skutek intensywnego dmuchania nosa (23), po badaniu spirometrii (24) i przy katarze siennym podczas kichania z zatkanym nosem (25).
W warunkach fizjologicznych, przed wsteczną inwazją patogenów, śliny czy powietrza, przyusznicę zabezpieczają: układ fałdów śluzówki zasłaniających ujście, szczelinowaty kształt samego ujścia, którego średnica jest mniejsza od średnicy przewodu Stenona oraz mechanizm zamykający ujście przewodu w sytuacji wzrostu ciśnienia w jamie ustnej. Mechanizm ten sprowadza się do zwiększenia kąta zagięcia przewodu gruczołu przez ucisk przedniego brzegu mięśnia żwacza, przy rozciągniętym policzku, z równoczesnym zamknięciem ujścia przez mięsień policzkowy (5, 6, 14, 20). Stąd wzrost wewnątrzustnego ciśnienia powyżej typowego 2-3 mmHg (u trębaczy nawet do 150 mmHg (26)), hipotonia mięśnia policzkowego, hipertrofia mięśnia żwacza, złogi przewodu Stenona upośledzające przepływ śliny czy poszerzone ujście naturalne (6, 14) promują powstanie pneumoparotid czy pneumoparotiditis.
Najczęściej pneumoparotitis prezentuje się jako obrzęk ślinianki z obecnymi przy palpacji krepitacjami (3, 4). Można zaobserwować pienistą bądź ropną wydzielinę z obu ujść przyusznicy lub jednego (3, 4). Często w trakcie palpacji policzka z ujścia wydobywa się bąbelkująca ślina ? jak to miało miejsce u naszego pacjenta (3, 11, 12, 14). Skóra nad gruczołem może być ucieplona i zaczerwieniona. Okolica ślinianki nie musi być bolesna przy palpacji (27). W skrajnych przypadkach, o długotrwałym przebiegu, opisano występowanie odmy podskórnej w obrębie twarzy i szyi (3, 11, 21), a nawet pneumothorax (3, 5, 11, 28, 29). Charakterystyczne dla schorzenia są nagłe wystąpienie i krótki przebieg (3, 18, 29). Dodatkowo zebrany wywiad w kierunku dmuchania balonów, gry na instrumentach dętych bądź występowania tików nerwowych przybliża prawidłową diagnozę.
Złotym standardem w diagnostyce pneumoparotitis jest tomografia komputerowa, która jednoznacznie różnicuje obecność powietrza względem złogów/kamieni w świetle przewodu Stenona (3, 4, 16). Ostatnie badania wskazują na zasadność wykonania obrazowania z nadętymi policzkami, co zwiększa czułość metody (3, 16). Badanie USG jest również opcją wstępnego badania, a nawet wskazaną w populacji dziecięcej (3, 16, 29). W sialografii typowo uwidoczniony jest poszerzony przewód Stenona (29, 30), przy przewlekłym, nawracającym pneumoparotitis przewód może być rozdęty odcinkowo, nadając badaniu charakterystyczny wygląd „serdelków” (29, 30).
W leczeniu stosowane są zarówno metody zachowawcze, jak i chirurgia. W zmianach o małym nasileniu wystarczy postępowanie przeciwzapalne oraz antybiotykoterapia w profilaktyce nadkażenia bakteryjnego. Niezbędne jest poinformowanie pacjenta o zakazie nadmuchiwania zmiany. Czasami w celu pozbycia się niepożądanych nawyków konieczne jest wsparcie psychologa lub psychiatry (5, 6, 14). U pacjentów zawodowo narażonych na wzrost ciśnienia w jamie ustnej można stosować opatrunki uciskowe policzka (ang. cheek compressors) (3, 11, 19, 29).
Ze względu na krótki okres pomiędzy nawrotami choroby u naszego pacjenta podjęto decyzję o irygacji przewodu Stenona roztworem deksametazonu bezpośrednio po wykonaniu sialografii oraz w trakcie kilku dni obserwacji szpitalnej. Postępowanie takie ma na celu usunięcie złogów, wyciszenie stanu zapalnego oraz obkurczenie przewodu przyuszniczego (31-36). W chirurgii postępowaniem pierwszego rzutu jest podwiązanie przewodu Stenona. Parotidektomia to metoda przeznaczona do procesów chorobowych o wysokim indeksie nawrotów (2, 3, 4, 19).
Wnioski
Pomimo tego, że pneumoparotitis należy do chorób rzadkich, powinien być rozważany w diagnostyce różnicowej nawracającego zapalenia przyusznicy. W populacji dziecięcej ultrasonografia ślinianki przyusznej stanowi powszechnie stosowaną metodę diagnostyczną ze względu na charakterystyczny obraz zmiany przybliżający rozpoznanie, dużą dostępność badania i jego stosunkowo niski koszt. Sialografia z irygacją przewodu roztworem sterydu może być rozważana w prewencji nawracających stanów zapalnych wytworzonego pneumocele. Niezbędna jest chęć współpracy pacjenta nad wyeliminowaniem zwyczaju „nadmuchiwania” zmiany. Należy pamiętać, że większość chorych wymaga leczenia zachowawczego, a procedury chirurgiczne należy stosować w obliczu porażki dotychczasowych terapii.
Piśmiennictwo
1. Zuchi DF, Silveira PC, Cardoso C de O et al.: Pneumoparotitis. Braz J Otorhinolaryngol 2011; 77(6): 806.
2. House LK, Lewis AF: Pneumoparotitis. Clin Exp Emerg Med 2018; 5(4): 282-285.
3. McGreevy AE, O’Kane AM, McCaul D, Basha SI: Pneumoparotitis: a case report. Head Neck 2013; 35(2): E55-59.
4. McCormick ME, Bawa G, Shah RK: Idiopathic recurrent pneumoparotitis. Am J Otolaryngol 2013; 34(2): 180-182.
5. Balasubramanian S, Srinivas S, Aparna KR: Pneumoparotitis with subcutaneous emphysema. Indian Pediatr 2008; 45: 58-60.
6. Markowitz-Spence L, Brodsky L, Seidell G: Self-induced pneumoparotitis in an adolescent. Int J Pediatr Otorhinolaryngol 1987; 14: 113.
7. Hemphill RA: Wind parotitis. N Engl J Med 1973; 289: 1094.
8. Calcaterra TC, Lowe J: Pneumoparotitis: an unusual case of parotid gland swelling. Arch Otolaryngol 1973; 97: 468.
9. Brodie HA, Chole RA: Recurrent pneumosialadenitis: a case presentation and new surgical intervention. Otolaryngol Head Neck Surg 1988; 98: 350-353.
10. Reilly DJ: Benign transient swelling of the parotid glands following general anesthesia: “anesthesia mumps”. Anest Analg 1979; 49: 560-563.
11. Luaces R, Ferreras J, Patiño B et al.: Pneumoparotid: a case report and review of the literature. J Oral Maxillofac Surg 2008; 66: 362-365.
12. Martin-Granizo R, Herrera M, Garcia-Gonzalez D, Mas A: Pneumoparotid in childhood: report of two cases. J Oral Maxillofac Surg 1999; 57: 1468-1471.
13. Greisen O: Pneumatocele glandulae parotis. J Laryngol Otol 1968; 82: 447-480.
14. Gouguen LA, April MD, Karmody CS, Carter BL: Self-induced pneumoparotitis. Arch Otolaryngol Head Neck Surg 1995; 121: 1426-1429.
15. Faure F, Poulin Gaudon I, Tavernier L et al.: A rare presentation of recurrent parotid swelling: Self-induced parotitis. Int J Pediatr Otolaryngol 2009; 4: 29-31.
16. Lasboo AA, Nemeth AJ, Russell EJ et al.: The use of the “puffed cheek” computed tomography technique to confirm the diagnosis of pneumoparotitis. Laryngoscope 2010; 120: 967-969.
17. Meerleer KD, Hermans R: Images in clinical radiology: pneumoparotitis. JBR-BTR 2005; 88: 248.
18. Grainger J, Saravanappa N, Courtney-Harris RG: Bilateral pneumoparotid. Otolaryngol Head Neck Surg 2006; 134: 531-532.
19. Hann S, Isaacson G: Recurrent pneumoparotid: cause and treatment. Otolaryngol Head Neck Surg 2004; 131: 758-761.
20. Watt J: Benign swelling of parotid gland: a review. Proc Royal Soc Med 1970; 70: 483.
21. Gudlaugsson O, Geirsson AJ, Benediktsdottir K: Pneumoparotitis: a new diagnostic technique and a case report. Ann Otol Rhinol Laryngol 1998; 107: 356-358.
22. Prabhu SP, Tran B: Pneumoparotitis. Pediatr Radiol 2005; 38: 1144.
23. Birzgalis AR, Curley WA, Camphor CL: Pneumoparotitis, subcutaneous emphysema and pleomorphic adenoma. J Laryngol Otol 1993; 107: 377-379.
24. Kirsch DDM, Shinn J, Porzio R et al.: Pneumoparotid due to spirometry. Chest 1999; 116: 1475-1478.
25. Garber MW: Pneumoparotitis: an unusual manifestation of hayfever. Am J Emerg Med 1987; 5: 40-41.
26. Banks P: Nonneoplastic parotid swelling: a review. Oral Surg Oral Med Oral Pathol 1968; 25: 732-745.
27. Ghanem M, Brown J, McGurk M: Pneumoparotitis: a diagnostic challenge. Int J Oral Maxillofac Surg 2012; 41(6): 774-776.
28. Palau JR, Gonalez-Lagunas J, Linares JG: Self-induced parotid and parapharyngeal emphysema. Int J Oral Maxillofac Surg 2009; 38: 574.
29. Lagunas JG, Fuertes AF: Self-induced parapharyngeal and parotid emphysema: A case of pneumoparotitis. Oral and Maxillofacial Surgery Cases 2017; 3(4): 81-85.
30. Mandel L, Kaynar A, Wazen J: Pneumoparotid: a case report. Oral Surg Oral Med Oral Pathol 1991; 72: 22-24.
31. Premnath KPB, Thomas J, Ray B, Jayakrishnan V: Multimodality diagnostic features and treatment by sialography of juvenile recurrent parotitis: a case report. Int J Scientific Study 2016; 8(4): 176-178.
32. Zenk J, Schneider H, Koch M, Iro H: Current management of juvenile recurrent parotitis. Curr Otorhinol Rep 2014; 2: 64-69.
33. Narsimha Rao VV, Putta Buddi JS, Kurthukoti AJ: Juvenile recurrent parotitis in children: Diagnosis and treatment using sialography. J Indian Soc Pedod Prev Dent 2014; 32: 262-265.
34. Nahlieli O, Shacham R, Shlesinger M, Eliav E: Juvenile recurrent parotitis: A new method of diagnosis and treatment. Pediatrics 2004; 114: 9-12.
35. Gary C, Kluka EA, Schaitkin B, Walvekar RR: Interventional sialendoscopy for treatment of juvenile recurrent parotitis. J Indian Assoc Pediatr Surg 2011; 16: 132-136.
36. Ramakrishna J, Strychowsky J, Gupta M, Sommer DD: Sialendoscopy for the management of juvenile recurrent parotitis: A systematic review and meta-analysis. Laryngoscope 2015; 125: 1472-1479.




