*Marcin Szymański1, Anna Wrzesińska1, Daria Młynarek1, Arkadiusz Szymański2
Diosmina i hesperydyna – obecny stan wiedzy
Diosmin and hesperidin – the current state of knowledge
1Centrum Zaawansowanych Technologii, Uniwersytet im. Adama Mickiewicza w Poznaniu
Dyrektor Centrum: prof. dr hab. n. chem. Bronisław Marciniak
2Wydział Chemii, Uniwersytet im. Adama Mickiewicza w Poznaniu
Dziekan Wydziału: prof. dr hab. n. chem. Maciej Kubicki
Streszczenie
Diosmina jest 7-rutynozydem 3’,5,7-trihydroksy-4’-metoksyflawonu (7-O-rutynozydem diosmetyny), a hesperydyna to 7-rutynozyd 3’,5,7-trihydroksy-4’-metoksyflawanonu (7-O-rutynozyd hesperetyny). Diosmina jest szarożółtym lub jasnożółtym, higroskopijnym proszkiem, a hesperydyna ma postać jasnożółtych sferokryształów. Diosmina izolowana była z owoców rodzaju Citrus (C. sinensis, C. limonia), obecnie otrzymywana jest półsyntetycznie z naturalnej hesperydyny. Flawonoidy te działają m.in.: przeciwdrobnoustrojowo, przeciwzapalnie, przeciwcukrzycowo, przeciwnowotworowo, przeciwbólowo, antyoksydacyjnie i prawdopodobnie przeciw wirusowi wywołującemu COVID-19.
Metabolizm diosminy odbywa się początkowo w środowisku jelita cienkiego i obejmuje demetoksylację oraz hydrolizę. Natomiast oksydacja i koniugacja mają miejsce w wątrobie. W moczu nie stwierdzono obecności diosminy i diosmetyny, które eliminowane są głównie w formie koniugatów kwasu glukuronowego. Dominującym metabolitem, wykrytym w próbkach moczu jest kwas m-hydroksy-fenylopropionowy, wydalany w skoniugowanej formie. Diosmina może wywoływać obniżenie agregacji czerwonych krwinek, a tym samym jest ona w stanie zmniejszać lepkość krwi. LD50 mieszaniny 90% diosminy i 10% hesperydyny dla szczurów wynosi ponad 3 g/kg. W badaniach nie stwierdzono działania mutagennego ani wpływu na funkcje reprodukcyjne. Nie stanowi też istotnego zagrożenia podczas karmienia piersią, gdyż słabo przechodzi do mleka matki.
Summary
Diosmin is the 7-rutinoside of 3 ‘, 5,7-trihydroxy-4’-methoxyflavone (7-O-rutinoside of diosmetin), and hespheridine is the 7-rutinoside of 3’, 5,7-trihydroxy-4’-methoxyflavanone (7 -O-rutinoside hesperetin). Diosmin, is a gray-yellow or pale-yellow, hygroscopic powder, whereas hesperidine is in the form of light-yellow spherocrystals. Diosmin was isolated from fruits of the Citrus genus (C. sinensis, C. limonia), now it is obtained semi-synthetically from natural hesperidin. These flavonoids have, among others: antimicrobial, anti-inflammatory, anti-diabetic, anti-cancer, analgesic, antioxidant and possibly anti-virus activity, that cause COVID-19.
The metabolism of diosmin takes place initially in the small intestine and involves demethoxylation and hydrolysis. In contrast, oxidation and conjugation take place in the liver. There is no presence of diosmin and diosmetin in the urine, which are mainly eliminated in the form of glucuronic acid conjugates. The dominant metabolite detected in urine samples is m-hydroxy-phenylpropionic acid, excreted in conjugated form. Diosmin may reduce the aggregation of Red Blood Cells, and thus it is able to reduce blood viscosity. The LD50 of the mixture of 90% diosmin and 10% hesperidin for rats is over 3 g/kg. The tests did not reveal any mutagenic effects or effects on reproductive functions. It also does not pose a significant threat during breast feeding, as it poorly passes into breast milk.

Wstęp
Diosmina to naturalnie występujący glikozyd flawonoidowy, który może być wyizolowany z różnych źródeł roślinnych lub przekształcany z występującego w większych ilościach flawonoidu hesperydyny (1). Po raz pierwszy została wyizolowana z liści trędownika bulwiastego w 1925 roku, a wprowadzona do lecznictwa jako substancja terapeutyczna w 1969 roku (2).
Budowa diosminy i hesperydyny
Podstawowy szkielet flawonoidów cytrusowych składa się z dwóch pierścieni aromatycznych, połączonych pierścieniem γ-pironu (C) w przypadku flawonów lub γ-dihydropironu w przypadku flawanonów. Najczęściej występują one jako O-glikozydy, z cząsteczką cukru przyłączoną do grupy hydroksylowej aglikonu w pozycji C-7 (3).
Diosmina (ryc. 1) jest 7-rutynozydem 3’,5,7-trihydroksy-4’-metoksyflawonu (7-O-rutynozydem diosmetyny). Hesperydyna (ryc. 2) to 7-rutynozyd 3’,5,7-trihydroksy-4’-metoksyflawanonu (7-O-rutynozyd hesperetyny).
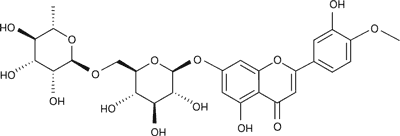
Ryc. 1. Diosmina
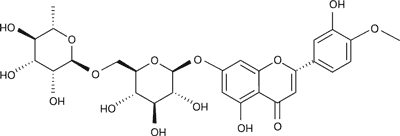
Ryc. 2. Hesperydyna
Właściwości fizyko-chemiczne diosminy i hesperydyny
Flawonoidy w soku z owoców cytrusowych występują głównie w formie glikozydów, rzadko spotykane w nim są lipofilne aglikony o niskiej rozpuszczalności w wodzie (3). Diosmina (FPXI) jest szarożółtym lub jasnożółtym, higroskopijnym proszkiem. W wodzie i w etanolu jest praktycznie nierozpuszczalna, natomiast rozpuszcza się w dimetylosulfotlenku (DMSO) oraz w pirydynie. Po rozpuszczeniu w rozcieńczonych roztworach wodorotlenków litowców roztwór przyjmuje charakterystyczne, bladożółte zabarwienie (4).
Hesperydyna ma postać jasnożółtych sferokryształów, topi się w 258-262°C. Dobrze rozpuszcza się w rozcieńczonych alkaliach, pirydynie, DMSO, w wodzie rozpuszcza się w proporcji 1:50, słabo w metanolu, gorącym kwasie octowym, nie rozpuszcza się w acetonie, benzenie i w chloroformie.
Diosmina i hesperydyna występujące w preparatach, z powodu słabej rozpuszczalności, wchłaniają się w niewielkim stopniu z przewodu pokarmowego. Dlatego diosminę coraz częściej poddaje się procesowi mikronizacji, otrzymując z cząsteczek o wielkości 20 μm cząstki poniżej 2 μm, co znacznie zwiększa biodostępność, a tym samym skuteczność działania (5).
Dowodem na to, że mikronizacja w istotny sposób zwiększa resorpcję z przewodu pokarmowego, są wyniki badania krzyżowego podwójnie zaślepionego. Brało w nim udział 12 ochotników, którzy przyjęli pojedynczą dawkę zarówno zmikronizowanej, jak i niezmikronizowanej znakowanej izotopowo diosminy. Zmierzono resorpcję radioaktywnej substancji z jelita, a jej miarą była ilość substancji wydalonej z moczem. Okazało się, że w pierwszych 24 godz. od przyjęcia dawki wydalona została prawie dwukrotna ilość diosminy zmikronizowanej (31,1%) w porównaniu z wydaloną ilością substancji niezmikronizowanej (15,9%) (6).
Przeprowadzono prospektywne, randomizowane badanie z pojedynczą ślepą próbą, w grupach równoległych, w celu oceny klinicznej równoważności podawanej raz na dobę przez 6 miesięcy niemikronizowanej diosminy (600 mg) w porównaniu z mikronizowaną diosminą (900 mg), podawaną łącznie z hesperydyną (100 mg). Do badania włączono 114 dorosłych pacjentów z objawową CVD (ang. chronic venous disease) kończyn dolnych w stopniu C0-C3 (klasyfikacja CEAP). Punktem końcowym była zmiana nasilenia objawów (od wartości wyjściowej do ostatniej wartości pozabiegowej) w skali VAS. W badaniu stwierdzono, że niemikronizowana diosmina 600 mg miała nie mniejszą skuteczność w porównaniu z mikronizowaną diosminą (900 mg z hesperydyną 100 mg) (7).
Występowanie i otrzymywanie diosminy i hesperydyny
Diosminę początkowo izolowano z owoców z rodzaju Citrus (C. sinensis, C. limonia), obecnie otrzymywana jest półsyntetycznie z naturalnej hesperydyny.
Utlenienie hesperydyny do diosminy prowadzi się przy udziale jodu, a półsyntetycznie otrzymana diosmina jest płukana w środowisku zasadowym i oddzielona przez filtrację. Wydajność tego procesu wynosi 90%, pozostałe 10% to produkty uboczne: linaryna (7-ramnoglukozyd akacetyny) i izoroifolina (7-rutynozyd apigeniny), a także 6-jododiosmina, diosmetyna, acetoizowanilon i wyjściowa, nieutleniona hesperydyna (4).
Przeprowadzono analizę porównawczą zawartości diosminy i hesperydyny w sokach z owoców wybranych gatunków rodzaju Citrus. Zestawienie wyników przedstawiono w tabeli 1.
Tab. 1. Zawartość diosminy i hesperydyny w wybranych gatunkach rodzaju Citrus (8, 9)
| Rodzaj Citrus | Zawartość hesperydyny min-max [mg/100 mL] | Zawartość diosminy min-max [mg/100 mL] |
| Sok ze słodkiej pomarańczy | 4,45-76,30 | 0,79-7,20 |
| Sok z mandarynki | 0,81-45,80 | n.o. |
| Sok z klementynki | 5,21-86,10 | 0,67-2,12 |
| Sok z cytryny | 3,84-41,00 | 0,51-5,10 |
| Handlowy sok z cytryny | 1,59-23,08 | 0,16-1,78 |
| Sok z limonki | 1,52-2,02 | n.o. |
| Sok z grejpfruta | 0,25-1,79 | n.o. |
| Handlowy sok z grejpfruta | 0,20-16,40 | 0,20-1,40 |
n.o. – nie oznaczono
Najwyższą zawartość hesperydyny oznaczono w soku z klementynki oraz ze słodkiej pomarańczy, najniższą natomiast w soku z grejpfruta. Najwięcej diosminy oznaczono w soku ze słodkiej pomarańczy (8, 9). Zawartość hesperydyny rośnie do osiągnięcia pełnej dojrzałości owocu cytrusowego, po czym stopniowo maleje, a zwiększa stężenie diosminy, która najprawdopodobniej powstaje z przekształcenia hesperydyny (9).
W owocach grejpfruta (C. paradisi) hesperydyna i diosmina występują w znacznie mniejszych ilościach, a dominującym składnikiem jest flawanon – naringina, odpowiadająca za ich gorzki smak (3).
Obecność diosminy stwierdzono również w innych gatunkach roślin: trędowniku bulwiastym (Scrophularia nodosa), budleji azjatyckiej (Buddleja asiatica) (10), bukku brzozowym (Agathosma betulina = Barosma betulina) (11, 12), rozmarynie lekarskim (Rosmarinus officinalis) (13), mięcie pieprzowej (Mentha piperita) (13, 14), wyce (Vicia) (15, 16), hyzopie lekarskim (Hyssopus officinalis) (17), wawrzynku (Daphne pseudomezereum) (18), koprze morskim (= kowniatek morski = babia sól nadmorska) (Crithmum maritimum) (19, 20).
Przemiany farmakokinetyczne i biochemiczne
Pierwszy etap metabolizmu diosminy odbywa się w środowisku jelita cienkiego i obejmuje demetoksylację oraz hydrolizę. Natomiast oksydacja i koniugacja mają miejsce w wątrobie (21). Produktem hydrolizy diosminy przez jelitowe β-glukozydazy, zlokalizowane w błonie śluzowej jelita cienkiego, jest diosmetyna, a szybkość jej absorpcji zależy od hydrolizy wiązania β-glikozydowego. Różnice w międzyosobniczej aktywności enzymatycznej β-glukozydazy mogą być w pewnym stopniu czynnikiem determinującym zróżnicowaną biodostępność flawonoidów (22).
Badania in vitro dowiodły też, że 13C- i 14C-diosmina, inkubowana z ludzką florą jelitową, jest przekształcana nie tylko do diosmetyny, ale też do luteoliny i kwasów fenolowych (23).
Na podstawie badań przeprowadzonych na szczurach, którym podano p.o. 3H-znakowaną diosminę, stwierdzono, że z przewodu pokarmowego reabsorbowana była szybko, a jej maksymalne stężenie we krwi wykryto między pierwszą a drugą godziną od podania (24).
Badanie farmakokinetyczne przeprowadzone u 5 osób, przyjmujących 10 mg/kg p.o. niezmikronizowanej diosminy, nie wykazało obecności związku macierzystego we krwi (czułość: 20 ng/ml), a stężenie maksymalne jej aglikonu diosmetyny notowane po 1 godz. od przyjęcia zmniejszało się powoli po 2 godz. i było jeszcze wykrywalne po 48 godz. (25).
Na podstawie badania farmakokinetycznego preparatu Daflon (450 mg zmikronizowanej diosminy i 50 mg hesperydyny), zarejestrowanego w Polsce jako lek, wykazano, że diosmina osiąga maksymalne stężenie we krwi po 60-120 min (26).
Intensywny metabolizm powodował niewielką kumulację związku w poszczególnych narządach, dopiero po dłuższym czasie od podania doustnego zaobserwowano wiązanie się diosminy do ścian naczyń krwionośnych (24).
W badaniu klinicznym leku Otrex (600 mg diosminy) zaobserwowano zwiększony wychwyt diosmetyny i/lub jej metabolitów w naczyniach żylnych do dziewiątej godziny od doustnego podania preparatu i utrzymywał się on jeszcze do 96 godzin od podania.
Eliminacja następowała z moczem (79%), z kałem (11%) i z żółcią (2,4%). W kale stwierdzono obecność diosminy, diosmetyny i innych metabolitów, zawierających radioaktywny 14C, co może wskazywać na złożony mechanizm wchłaniania i wydalania produktu w przewodzie pokarmowym (krążenie wątrobowo-jelitowe) (27).
W moczu nie stwierdzono obecności diosminy i diosmetyny, które eliminowane są głównie w formie koniugatów z kwasem glukuronowym. Dominującym metabolitem, wykrytym w próbkach moczu, jest kwas m-hydroksy-fenylopropionowy oraz małe ilości innych kwasów fenolowych, np. kwas 3-hydroksy-4-metoksybenzoesowy oraz 3-metoksy-4-hydroksy-fenylooctowy, a także kwas 3,4-dihydroksybenzoesowy (21, 24, 25). Po dożylnym podaniu szczurom diosminy eliminacja odbywała się głównie z moczem (24).
Mechanizm działania diosminy
Diosmina poprzez hamowanie enzymów, takich jak: lipoksygenaza, cyklooksygenaza, fosfolipaza, podobnie jak inne flawonoidy, może zmniejszać aktywność prostaglandyn E2 (PGE2) i tromboksanów (TxA2) (28, 29). Jest również inhibitorem aktywności leukocytów, ich migracji i adhezji (30). Mechanizm ten wskazuje na działanie ochronne diosminy oraz zdolności naprawcze w uszkodzonych tkankach naczyń krwionośnych. Diosmina poprawia napięcie ścian naczyń krwionośnych, zwiększa drenaż naczyń limfatycznych, wspomaga mikrokrążenie kapilarne, hamuje reakcje zapalne oraz obniża przepuszczalność ścian naczyń włosowatych (31-34).
Działanie farmakologiczne
Działanie przeciwdrobnoustrojowe
Hesperydyna i diosmina hamowały częściowo (40-60%) i w pełni odwracalnie aktywność syntazy ATP Escherichia coli (35). Istnieją doniesienia o hamowaniu przez diosminę i hesperydynę (formy glikozydowe) aktywności rotawirusów, wywołujących sporadycznie silne biegunki u niemowląt i małych dzieci (IC50 =10 μM), podczas gdy formy aglikonowe (diosmetyna, hesperetyna) takiej zdolności nie posiadały (36).
Dostępne są dowody potwierdzające możliwość zastosowania hesperydyny w profilaktyce przeciwko zakażeniu SARS-CoV-2 i leczeniu uzupełniającym COVID-19. Hesperydyna może blokować przedostawanie się koronawirusa do komórek gospodarza przez receptory ACE2, co może zapobiegać infekcji. Aktywność przeciwwirusowa hesperydyny może stanowić opcję leczenia COVID-19 poprzez poprawę odporności komórkowej gospodarza na infekcje, a jej działanie przeciwzapalne może pomóc w kontrolowaniu burzy cytokin. Mieszanina hesperydyny z diosminą, podawana jednocześnie z heparyną, chroni przed żylną chorobą zakrzepowo-zatorową, która może zapobiegać progresji choroby (37).
Właściwości antyoksydacyjne
Zbadano skuteczność diosminy w zapobieganiu ostrej fazie stanu zapalnego u szczurów, jako skutku peroksydacji lipidów, wywołanej wewnątrzotrzewnowym podaniem karaginianu i CCl4. Peroksydację lipidów zmierzono m.in. poprzez spadek stężenia we krwi witamin A i E. Dootrzewnowe podawanie diosminy (150 mg/kg/tydzień) w ciągu 8 tygodni poprzedzających podanie substancji prozapalnych skutkowało znacznym obniżeniem się ilości markerów reakcji ostrej fazy stanu zapalnego we krwi (α1-, α2-, β-globuliny), wywołanego przez karaginian oraz obniżeniem peroksydacji lipidów wywołanej przez CCl4 w mikrosomach wątroby. Diosmina może więc pełnić ważną funkcję w naturalnej obronie antyoksydacyjnej organizmu (38).
Zbadano też wpływ diosminy i jej metabolitu diosmetyny na przeciwdziałanie uszkodzeniu błon komórkowych hepatocytów w warunkach in vitro wywołanego za pomocą EE (estolan erytromycyny) i na stres oksydacyjny wywołany przez tert-butylohydroksynadtlenek (TBHP). Działanie toksyczne spowodowało wyciek wewnątrzkomórkowych enzymów: dehydrogenazy mleczanowej, aminotransferazy asparaginianowej, lizosomalnego markera: AP (kwaśna fosfataza). Wyciek enzymów, mimo wcześniejszego potraktowania komórek EE, zmniejszył się wskutek 40-godzinnego działania diosmetyny, ale nie diosminy. Diosmetyna zmniejszyła też toksyczność TBHP, co wynikało z mniej nasilonej peroksydacji lipidów i ze zwiększonej aktywności glutationu. Diosmetyna wykazuje znacznie wyższe właściwości antyoksydacyjne niż diosmina (39).
Udowodniono też działanie antyoksydacyjne i neuroprotekcyjne hesperydyny i jej aglikonu – hesperetyny. Obie te substancje podobnie zmiatały wolne rodniki DPPH (1,1-diphenyl-2-picrylhydrazyl), jednakże hesperetyna działała silniej. Wykazano też przeciwwolnorodnikowe i antyoksydacyjne działanie hesperetyny w różnych, doświadczalnych modelach stresu oksydacyjnego, indukowanego przez: H2O2, ksantynę/oksydazę ksantynową, Fe2+/kwas L-askorbowy. Hesperetyna zmniejszała też uszkodzenie komórek mózgu wywołane przez podwyższone stężenie kwasu glutaminowego (40).
Kwas glutaminowy, obecny m.in. w hipokampie, zaliczany jest do aminokwasów pobudzających. Stymuluje on receptor NMDA (N-Methyl-D-asparaginowy), który z kolei reguluje napływ jonów wapniowych do komórki. Wzrost uwalniania kwasu glutaminowego może być główną przyczyną uszkodzenia neuronów w wielu ostrych i chronicznych zaburzeniach neurodegeneracyjnych, takich jak: epilepsja, choroba Alzheimera oraz pląsawica Huntingtona. Antagoniści postsynaptycznych receptorów NMDA przeciwdziałają tej patologicznej neurotransmisji (41). Takim selektywnym antagonistą okazała się właśnie hesperetyna, a w mniejszym stopniu również hesperydyna.
Hesperetyna chroniła też kultury komórkowe przed indukowaną β-amyloidem neurotoksycznością (IC50 = 97,2 μM), co może mieć znaczenie w chorobie Alzheimera (40).
Badania in vitro i in vivo
Działanie na układ szkieletowy
Przeprowadzono badanie wpływu na kości suplementu diety/nutraceutyku (DH), będącego połączeniem 9:1 diosminy i hesperydyny, wykorzystywanego dla poprawy funkcjonowania układu krążenia. Wykazano, że DH u szczurów z osteotomią kości udowej stymulował jej regenerację, u rosnących szczurów sprzyjał osiągnięciu szczytowej masy kostnej, u szczurów z osteopenią wywołaną owariektomią (OVX) całkowicie regenerował kości beleczkowe kości udowej i wytrzymałość wraz ze zwiększeniem powierzchniowego tworzenia kości i markeru różnicowania osteogennego w surowicy; hamował resorpcję kości u szczurów po OVX, jak również u szczurów po OVX leczonych teryparatydem. Badania farmakokinetyczne wykazały, że po podaniu doustnym diosmina i hesperydyna nie były wykrywane, a jedynym krążącym metabolitem była diosmetyna (aglikon diosminy), która okazała się selektywnym agonistą receptorów estrogenowych β, czego efektem jest stymulacja różnicowania osteoblastów i hamowanie sklerostyny (42).
Działanie przeciwzapalne
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Kocić I. Diosmina – skuteczność kliniczna i bezpieczeństwo stosowania. Forum Med Rodz 2014; 8(2):56-63.
2. Monograph. Diosmin. Altern Med Rev 2004; 9:308-11.
3. Gatusso G, Barrecca D, Gargiulli C i wsp. Flavonoid composition of citrus juices. Molecules 2007; 12:1641-73.
4. Farmakopea Polska. Wyd. VIII, Tom II. Pol Tow Farm, Warszawa 2008: 1569-71.
5. Janeczko Z. Polifenole roślinne w terapii schorzeń układu krążenia. Panacea 2004; 3(8):22-6.
6. Garner RC, Garner JV, Gregory S i wsp. Comparison of the absorption of micronized (Daflon 500 mg) and nonmicronized 14 C-Diosmin tablets after oral administration to healthy volunteers by accelerator mass spectrometry and liquid scintillation counting. J Pharm Sci 2002; 91(1):32-40.
7. Steinbruch M, Nunes C, Gama R i wsp. Is nonmicronized diosmin 600 mg as effective as micronized diosmin 900 mg plus hesperidin 100 mg on chronic venous disease symptoms? Results of a noninferiority study. Intl J Vasc Med 2020; 2020:4237204.
8. Gorinstein S, Huang D, Leontowicz H i wsp. Determination of naringin and hesperidin in citrus fruit by HPLC. The antioxidant potential of citrus fruit. Acta Chromatogr 2006; 17:108-22.
9. Vandercook CE, Tisserat B. Flavonoid changes in developing lemons grown in vivo and in vitro. Phytochem 1989; 28(3):799-803.
10. El-Domiaty MM, Wink M, Abdel Aal MM i wsp. Antihepatotoxic activity and chemical constituents of Buddleja asiatica Lour. Naturforsch C J Biosci 2009; 64:9-11.
11. El-Shafae AM, El-Domiaty MM. Improved LC methods for the determination of diosmin and/or hesperidin in plant extracts. J Pharm Biomed Anal 2001; 26:539-45.
12. http://www.anniesremedy.com/herb_detail203.php (dostęp 16 sierpnia 2021 roku).
13. Ożarowski A. Ziołolecznictwo – poradnik dla lekarzy. Wyd. III. PZWL, Warszawa 1982: 186-9, 231-2.
14. Sroka Z, Fecka I, Cisowski W. Antiradical and anti-H2O2 properties of polyphenolic compounds from an aqueous peppermint extract. Naturforsch C 2005; 60:826-32.
15. Andreeva OA, Ivashev M, Ozimina II i wsp. Diosmetin glycosides from caucasian vetch: isolation and study of biological activity. Pharm Chem J 1998; 32:11.
16. Ivashev MN, Andreeva OA, Bandyukova VA i wsp. Isolation of diosmin from plants of the Genus vicia and Hyssopus officinalis and its influence on blood coagulation. Pharm Chem J 1995; 29(10):707-9.
17. Wolski T, Baj T, Kwiatkowski S. Hyzop lekarski (Hyssopus officinalis L.). Zapomniana roślina lecznicza, przyprawowa oraz miododajna. Annales Univers Mariae Curie-Skłodowska, Lublin 2006; LXI:1-10.
18. Tanaka T, Makita H, Ohnishi M i wsp. Chemoprevention of 4-nitroquinoline 1-oxide-induced oral carcinogenesis in rats by flavonoids diosmin and hesperidin, each alone and in combination. Cancer Res 1997; 57(15):246-52.
19. Mabberley DJ. Mabberley’s Plant-Book. Cambridge Univ Press 2017; 247.
20. Renna M. Reviewing the prospects of Sea Fennel (Crithmum maritimum L.). Plants (Basel) 2018; 7(4):92.
21. Hitzenberger G. Therapeutic effectiveness of flavonoids illustrated by Daflon 500 mg. Wien Med Wochenschr 1997; 147(18):410-2.
22. Nèmeth K, Plumb GW, Berrin JG i wsp. Deglycosylation by small intestinal epithelial cell beta-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans. Eur J Nutr 2003; 42(1):29-42.
23. Lyseng-Williamson KA, Perry CM. MPFF: A review of its use in CVI, venous ulcers and haemorrhoids. Drugs 2003; 63:71-100.
24. Oustrin J, Fauran MJ, Commanay L. A pharmacokinetic study of 3H-diosmine, Arzneimittelfors 1977; 27(9):1688-91.
25. Cova D, De Angelis L, Giavarini F i wsp. Pharmacokineticks and metabolism of oral diosmin in healthy volunteers. Int J Clin Pharmacol Ther Toxicol 1992; 30:29-33.
26. Ulotka informacyjna preparatu Daflon 500 mg, firmy Servier, 2004.
27. Charakterystyka produktu leczniczego Otrex 600.
28. Labrid C. Pharmacologic properties of Daflon 500 mg. Angiology 1994; 45:524-30.
29. Manthey JA. Biological properties of flavonoids pertaining to inflammation. Microcircul 2000; 7:29-34.
30. Ramelet AA. Pharmacologic aspects of a phlebotropic drug in CVI associated edema. Angiology 2000; 51:19-23.
31. Ramelet AA. Clinical benefits of Daflon 500 mg in the most severe stages of CVI. Angiology 2001; 52:49-56.
32. Smith PD. Neutrophil activation and mediators of inflammation in CVI. J Vasc Res 1999; 36:24-36.
33. Bergan J, Schmid-Schonbein GW, Takase S. Therapeutic approach to CVI and its complications: place of Daflon 500 mg. Angiology 2001; 52:43-7.
34. Le Devehat CC, Khodabandehlou T, Vimeux M i wsp. Evaluation of haemorheological and microcirculatory disturbances in CVI. Int J Mikrocirc Clin Exp 1997; 17:27-33.
35. Chinnam N, Dadi PK, Sabri SA i wsp. Dietary bioflavonoids inhibit Escherichia coli ATP synthase in a differential manner. Int J Biol Macromolec 2010; 46(5):478-86.
36. Bae EA, Han MJ, Lee M i wsp. In vitro inhibitory effect of some flavonoids on rotavirus infectivity. Biol Pharml Bull 2000; 23(9):1122-4.
37. Haggag YA, El-Ashmawy NE, Okasha KM. Is hesperidin essential for prophylaxis and treatment of COVID-19 Infection? Med Hypotheses 2020; 144:109957.
38. Freneix-Clerc M, Dumon MF, Carbonneau MA i wsp. In vivo study of the antilipoperoxidant effect of 3’,5,7-trihydroxy-4’-methoxy flavone 7 rutinoside. Annales de Biologie Clinique (Paris) 1994; 52(3):171-7.
39. Villa P, Cova D, Francesco L i wsp. Protective effect of diosmetin non in vitro cell membrane damage and oxidative stress in cultured rat hepatocytes. Toxicol 1992; 73(2):178-89.
40. Jungsook C. Antioxidant and neuroprotective effects of hesperidin and its aglycone hesperetin. Arch Pharm Res 2006; 29(8):699-706.
41. Zając M, Pawełczyk E, Jelińska A. Chemia leków, Akademia Medyczna im. Karola Marcinkowskiego w Poznaniu 2006: 68.
42. Bhattacharyya S, Pal S, Mohamed R i wsp. A nutraceutical composition containing diosmin and hesperidin has osteogenic and anti-resorptive effects and expands the anabolic window of teriparatide. Biomed Pharmacother 2019; 118:109207.
43. Crespo ME, Galvez J, Cruz T i wsp. Anti-inflammatory activity of diosmin and hesperidin in rat colitis induced by TNBS. Planta Med 1999; 65(7):651-3.
44. Park Sang-a, Bong Sim-Kyu, Lee Jin Woo i wsp. Diosmetin and its glycoside, diosmin, improve atopic dermatitis-like lesions in 2,4-dinitrochlorobenzene-induced murine models. Biomol Ther 2020; 28(6):542-8.
45. Pari L, Srinivasan S. Antihyperglycemic effect of diosmin on hepatic key enzymes of carbohydrate metabolism in streptozotocin-nicotinamide-induced diabetic rats. Biomed Pharmacother 2010; 64:477-81.
46. Sánchez NA, Conesa CM, Ortega VV. Effects of IFN α and diosmin on metastatic murine-lung melanoma. Rev Esp Patol 2008; 41(2):123-9.
47. Ciolino HP, Wang T, Chao YG. Diosmin and diosmetin are agonists of the aryl hydrocarbon receptor that differentially affect cytochrome p450 1a1 activity. Cancer Res 1998; 58:2754-60.
48. Savineau JP, Marthan R. Diosmin-induced increase in sensitivity to Ca2+ of the smooth muscle contractile apparatus in the rat isolated femoral vein. Br J Pharmacol 1994; 111:978-80.
49. Martinez AL, Gonzales-Trujano ME, Chavez M i wsp. Hesperidin produces antinociceptive response and synergistic interaction with ketorolac in an arthritic gout-type pain in rats. Pharmacol Biochem Behav 2011; 97:683-9.
50. Carballo-Villalobos AI, González-Trujano ME, Pellicer F i wsp. Antihyperalgesic effect of hesperidin improves with diosmin in experimental neuropathic pain. Biomed Res Int 2016; 2016:8263463.
51. Chudek J. Skuteczność i tolerancja diosminy w leczeniu chorych z przewlekłą niewydolnością żylną w codziennej praktyce klinicznej. Problemy Med Rodz 2008; 10(4):45-51.
52. Glinski W, Chodynicka B, Roszkiewicz J i wsp. Effectiveness of a micronized purified flavonoid fraction (MPFF) in the healing process of lower limb ulcers. An open multicentre study, controlled and randomized. Minerva Cardioangiol 2001; 49(2):107-14.
53. Araujo D, Viana F, Osswald W. Diosmin therapy alters the in vitro metabolism of noradrenaline by the varicose human saphenous vein. Pharmacol Res 1991; 24(3):253-6.
54. Sher E, Codignola A, Biancardi E i wsp. Amine uptake inhibition by diosmin and diosmetin in human neuronal and neuroendocrine cell lines. Pharmacol Res 1992; 26(4):395-402.
55. Godeberge P. Daflon 500 mg in the treatment of hemorrhoidal disease: a demonstrated efficacy in comparison with placebo. Angiology 1994; 45:574-8.
56. Buckshee K, Takkar D, Aggarwal N. Micronized flavonoid therapy in internal hemorrhoids of pregnancy. Int J Gynaecol Obstet 1997; 57(2):145-51.
57. Sarabia M, Leon S, Vivas J i wsp. Calcium dobesilate versus PFF in the treatment of hemorrhoidal crises:a randomized, controlled study with an initial double-blind, double dummy period. Curr Ther Res 2001; 62(7):524-9.
58. Diana G, Catanzaro M, Ferrara A i wsp. Attivita della diosmina pura nel trattamento della malattia emorroidaria. Clin Ter 2000; 151:341-4.
59. Pecking AP, Fèvrier B, Wargon C i wsp. Efficacy of Daflon 500 mg in the treatment of lymphedema (secondary to conventional therapy of breast cancer). Angiology 1997; 48(1):93-8.
60. Pecking AP. Evaluation by lymphoscintigraphy of the effect of a micronized flavonoid fraction (Daflon 500 mg) in the treatment of upper limb lymphedema. Intern Angiol 1995; 3(1):39-43.
61. Keenoy BM, Vertommen J, De Leeuw I. The effect of flavonoid treatment on the glycation and antioxidant status in type I diabetic patients. Diabet Nutr Metabol 1999; 12(4):256-63.
62. Valensi PE, Behar A, de Champvallins MM i wsp. Effects of a purified micronized flavonoid fraction on capillary filtration in diabetic patients. Diabet Med 1996; 13(10):882-8.
63. Lacombe C, Lelievre JC, Bucherer C i wsp. Activity of Daflon 500 mg on the hemorheological disorders in diabetes. Int Angiol 1989; 8(4):45-8.
64. Hasanoglu A, Ara C, Ozen S i wsp. Efficacy of micronized flavonoid fraction in healing of clean and infected wounds. Int J Angiol 2001; 10(1):41-4.
65. Serfaty D, Magneron AC. Premenstrual syndrome in France: epidemiology and therapeutic effectiveness of 1000 mg of micronized purified flavonoid fraction in 1473 gynecological patients. Contracept Fertil Sex 1997; 25(1):85-90.
66. Meggiorini ML, Cascialli GL, Luciani S i wsp. Randomized study of the use of synthetic diosmin in premenstrual and vascular dysplastic mastodynia. Minerva Ginecol 1990; 42(10):421-5.
67. Dos Santos SF, Fernandes MS, Martins MD i wsp. Prevention of amphotericin b nephrotoxicity through use of phytotherapeutic medication. Rev Esc Enferm USP 2015; 49:73-8.
68. Lacombe C, Bucherer C, Lelievre JC. Hemorheological improvement after Daflon 500 mg treatment in diabetes. Int Angiol 1988; 7(2):21-4.
69. Rajnarayana K, Reddy MS, Krishna DR. Diosmin pretreatment affects bioavailability of metronidazole. Eur J Clin Pharmacol 2003; 58(12):803-7.
70. Meyer OC. Safety and security of Daflon 500 mg in venous insufficiency and in hemorrhoidal disease. Angiology 1994; 45:579-84.
71. Podlewski JK, Chwalibogowska-Podlewska A. Leki współczesnej terapii. Encyklopedia dla lekarzy i farmaceutów. Wyd. XX. Tom I. Medical Tribune Polska, Warszawa 2010.


