*Agnieszka Łebek-Szatańska, Karolina M. Nowak, Lucyna Papierska
Zastosowanie badań scyntygraficznych w diagnostyce chorób nadnerczy
Usefulness of scintigraphy imaging in the diagnostics of adrenal diseases
Klinika Endokrynologii, Centrum Medyczne Kształcenia Podyplomowego, Szpital Bielański, Warszawa
Kierownik Kliniki: prof. dr. hab. med. Wojciech Zgliczyński
Streszczenie
Badania scyntygraficzne są wykorzystywane w diagnostyce endokrynologicznej już od kilkudziesięciu lat. Ich wykonanie należy rozważyć, jeśli tomografia komputerowa oraz rezonans magnetyczny nie są w stanie w pełni i jednoznacznie scharakteryzować patologii nadnerczy. W praktyce najczęściej wykonuje się scyntygrafię z 123I-MIBG oraz scyntygrafię receptorów somatostatynowych z tektreotydem (w ocenie guzów pochodzących z rdzenia nadnerczy), rzadziej scyntygrafię ze znakowanym norcholesterolem, NP-59 (w chorobach kory nadnerczy). Rozwój dokładniejszych metod obrazowania przestrzennego, między innymi pozytronowej tomografii emisyjnej (PET), jak również wynalezienie nowych radiofarmaceutyków o lepszych parametrach fizykochemicznych, przekłada się na coraz szersze zastosowanie tych badań. Najbardziej dostępne z nich, PET z 18F-fluorodeoksyglukozą, jest najczęściej wykorzystywane w celu odróżnienia guzów łagodnych od złośliwych. PET z 68Ga-peptydami stanowi z kolei alternatywę dla klasycznej scyntygrafii receptorów somatostatynowych, ma jednak lepszą od niej czułość. W artykule omawiamy poszczególne typy badań scyntygraficznych oraz ich miejsce w procesie diagnostyczno-terapeutycznym w chorobach nadnerczy.
Summary
Scintigraphy has been used in the diagnostics of endocrine diseases for the last several decades so far. Its performance should be considered if adrenal pathology cannot be fully and unequivocally described by means of computed tomography and magnetic resonance. In practice, 123I-MIBG and somatostatin receptors scintigraphy, using tectreotide, are most commonly carried out (to evaluate the masses originating from adrenal medulla). Less frequently, radiolabelled norcholesterol NP-59 scintigraphy (in adrenal cortex diseases) is performed. The development of more accurate methods of spatial imaging, including positron emission tomography (PET), as well as inventing new radiopharmaceuticals with better physicochemical parameters, translates into growing application of these tests. The most available PET tracer, 18F-fluorodeoxyglucose, is most often utilized to distinguish between benign and malignant tumors. In turn, PET imaging with 68Ga-conjugated peptides constitutes alternative for classic somatostatin receptors scintigraphy, yet with higher sensitivity. In the article below, we discuss different types of radionuclide imaging and their place in the diagnostic and therapeutic process in the field of adrenal gland diseases.

Wstęp
Zmiany guzkowe nadnerczy stanowią wyzwanie zarówno dla endokrynologów, jak i radiologów. W dobie coraz większej ich wykrywalności niezbędna jest wiarygodna identyfikacja uwidocznionych zmian. Podobna sytuacja może zaistnieć w trakcie diagnostyki zespołów nadmiernego wydzielania hormonów, kiedy konieczne jest wskazanie ich źródła. Najważniejszy cel stawiany diagnostyce obrazowej to odróżnienie zmian łagodnych od złośliwych. Czynność hormonalną guzów nadnerczy oceniamy przede wszystkim w badaniach biochemicznych i hormonalnych, jednak w przypadkach wątpliwych badania scyntygraficzne mogą stanowić ich przydatne uzupełnienie. Dodatkowo, jeżeli zmiany w nadnerczach są obustronne, pomagają w wytypowaniu strony dominującej wydzielniczo, która powinna być zoperowana jako pierwsza.
Ultrasonografia jest badaniem, w którym najczęściej przypadkowo stwierdzamy guzy w okolicy nadnerczy, ale do ich pełnej oceny konieczne jest przeprowadzenie dalszego obrazowania – najczęściej tomografii komputerowej, która już na pierwszym etapie pozwala odróżnić zmiany z pewnością łagodne od potencjalnie złośliwych. Badaniem „drugiego wyboru” jest rezonans magnetyczny z wykorzystaniem metody przesunięcia chemicznego, co pozwala na ocenę zawartości lipidów w zmianie. U niektórych pacjentów wykonanie tych wszystkich badań nie pozwala na jednoznaczną charakterystykę guza. Stąd potrzeba zastosowania metod tzw. obrazowania funkcjonalnego, jakie oferuje medycyna nuklearna. Stosując te metody, dysponujemy trzema rodzajami obrazowania: konwencjonalną scyntygrafią planarną, tomografią emisyjną pojedynczego fotonu SPET (SPECT) oraz pozytonową tomografią emisyjną (PET) (1). Różnice polegają na sposobie uzyskiwania obrazu i jego jakości. W konwencjonalnej scyntygrafii uzyskuje się obraz dwuwymiarowy, natomiast SPECT i PET generują obrazy przestrzenne – poszczególnych warstw pacjenta. SPECT polega na rekonstrukcji obrazów planarnych uzyskanych w wielu płaszczyznach w wyniku obrotu mechanizmu pomiarowego. Standardem stają się techniki hybrydowe: dostępna już powszechnie SPET/CT (dzięki fuzji obrazów uzyskanych metodą SPET z obrazami z tomografii komputerowej), a w przyszłości – dopiero rozwijana obecnie fuzja SPECT/MR. We wszystkich wymienionych metodach stosowane są tzw. radiofarmaceutyki (związki farmaceutyczne zawierające promieniotwórcze znaczniki) oraz rejestracja kamerą gamma. W „klasycznych” metodach scyntygraficznych jako znaczniki stosowane są radioizotopy, które same są źródłem promieniowania gamma. Z kolei w metodzie PET używa się substancji znakowanych izotopami ulegającymi rozpadowi beta plus. Powstałe w jego wyniku pozytony (antyelektrony) po przebyciu kilku mm zderzają się z elektronami w tkankach pacjenta. Następuje wówczas proces anihilacji („unicestwienia”) cząsteczek z emisją dwóch fotonów gamma o przeciwnym zwrocie. Fotony te wykrywane są przez położone dokładnie naprzeciw siebie pary detektorów, co pozwala na bardzo dokładną ocenę miejsca anihilacji pary pozyton-elektron (1-3). Dzięki temu rozdzielczość PET jest lepsza niż SPECT (4-5 vs 7-8 mm (2)). Ograniczeniem tej metody jest znacznie większy koszt badań PET (zarówno jeśli chodzi o urządzenia rejestracyjne, jak i radioizotopy). Znaczniki wykorzystywane w pozytonowej tomografii emisyjnej mają zwykle krótszy czas rozpadu niż te stosowane w SPECT, co może być zaletą (krótszy czas badania), ale też stanowi problem: niektóre „krótko żyjące” izotopy muszą być produkowane na miejscu, a więc ośrodek diagnostyczny musi dysponować cyklotronem. Każdy radiofarmaceutyk wykazuje indywidualną charakterystykę fizjologicznego wychwytu. Znajomość tych miejsc i stopnia akumulacji wskaźnika pozwala na odróżnienie gromadzenia patologicznego od stanów prawidłowych (4).
Obrazowanie rdzenia nadnerczy
Guzy wywodzące się z rdzenia nadnerczy występują znacznie rzadziej niż te wywodzące się z kory nadnerczy. Ich rozpoznanie jest bardzo istotne przede wszystkim z powodu zagrożenia przełomem katecholaminowym, ryzyka złośliwości (ok. 10%), możliwości radykalnego leczenia operacyjnego, a w końcu ze względu na ich genetyczne podłoże (w ponad 1/3 przypadków), a więc potencjalne występowanie w rodzinie chorego (3). W przypadku guzów typu pheochromocytoma/paraganglioma (PCC/PGL) obrazowanie funkcjonalne ma pozycję zdecydowanie bardziej ugruntowaną niż w przypadku chorób kory nadnerczy. Scyntygrafia MIBG jest badaniem przydatnym na wszystkich etapach postępowania diagnostyczno-terapeutycznego z guzami chromochłonnymi, a scyntygrafia receptorów somatostatynowych – wartościowym badaniem uzupełniającym (ryc. 1). Jest ona szczególnie cenna w przypadku pozanadnerczowej lokalizacji guza (ok. 1/4 tych zmian nie gromadzi MIBG, ale ma receptory dla somatostatyny (2)). Oba badania są łatwo dostępne. Obrazowanie metodą PET, jako dokładniejsze, zaczyna odgrywać coraz większą rolę również w diagnostyce PCC/PGL; jest to możliwe dzięki opracowaniu nowych, ultraczułych znaczników. Najłatwiej dostępnym z nich jest nadal „uniwersalna” 18F-fluorodeoksyglukoza, ale wyprodukowane zostały też inne, bardziej specyficznie wiążące się z rdzeniem nadnerczy: 18F-DOPA, 18F-fluorodopamina, 11C-HED, a także 68Ga-związane peptydy.
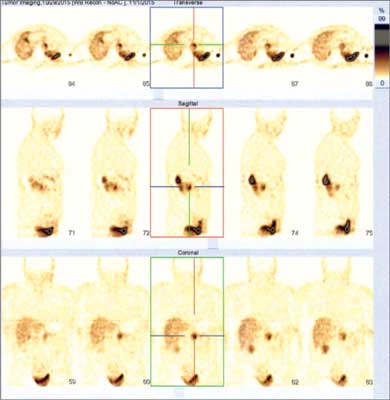
Ryc. 1. Scyntygrafia receptorów somatostatynowych. Obraz planarny guza chromochłonnego lewego nadnercza u 52-letniej pacjentki z obciążonym wywiadem rodzinnym, badanie przedoperacyjne
Scyntygrafia MIBG
MIBG (metajodobenzyloguanidyna, iobenguane) jest analogiem guanidyny, strukturalnie przypominającej norepinefrynę. Jest komercyjnie dostępna jako związek znakowany 123I lub 131I. Dostaje się do wnętrza komórek przez transporter dla norepinefryny (NET) i specyficznie kumuluje w rdzeniu nadnerczy i guzach, które się z niego wywodzą. Wychwyt znacznika w prawidłowych nadnerczach jest słaby, ale obecny. Ten fizjologiczny wychwyt bywa trudny do odróżnienia od rozrostu rdzenia lub bardzo małych guzów chromochłonnych. Z kolei fałszywie pozytywne wyniki mogą być spowodowane akumulacją znacznika w innych guzach neuroendokrynnych, tj. rakowiak, rak rdzeniasty tarczycy, ganglioneuroma czy rak neuroendokrynny skóry (z komórek Merkla). Opisywano również wychwyt MIBG w gruczolakach i rakach kory nadnerczy, angiomiolipoma czy haemangioma (4). Wysokie stężenia katecholamin we krwi mogą zmniejszać akumulację MIBG w guzie. Niektóre pokarmy (tj. czekolada, wanilina, sery pleśniowe) powodują opróżnienie ziarnistości, co może przejściowo zwiększać stężenie krążących katecholamin i przez to powodować redukcję wychwytu znacznika (2).
Scyntygrafia z 123I-MIBG ma tę wyższość nad 131I-MIBG, że cechuje się mniejszą aktywnością promieniowania, krótszym czasem badania (24 vs 48-72 godz.), a zapewnia lepszą jakość obrazów. Część leków modyfikuje wychwyt i magazynowanie MIBG, w związku z czym może wpływać na wynik scyntygrafii. Preparaty, takie jak: trójcykliczne leki przeciwdepresyjne, opioidy, sympatykomimetyki (w tym efedryna i pseudoefedryna, dostępne w lekach przeciwgrypowych bez recepty), blokery kanałów wapniowych (tj. werapamil, diltiazem) powinny być odstawione na 2-3 dni przed badaniem. Labetalol powoduje fałszywie negatywne wyniki i zalecane jest wstrzymanie przyjmowania leku na 10 dni, a środków antypsychotycznych w formie depot – co najmniej na miesiąc. Działania niepożądane po podaniu 123I-MIBG są bardzo rzadkie i można ich uniknąć przez powolne podawanie znacznika (2-4).
Scyntygrafia receptorów somatostatynowych (SRS)
Pierwszym, testowanym in vivo, radiofarmaceutykiem stosowanym w tym badaniu była pochodna oktreotydu, czyli analogu receptorów somatostatynowych, znakowana jodem (123I). Kolejną pochodną, o lepszych parametrach fizycznych i farmakodynamicznych, okazał się być 111In-Pentetreotide (Octreoscan). Wiąże się on specyficznie z receptorami SST, głównie podtypu 2 i 5 (5). Dalszy rozwój w dziedzinie radioznaczników doprowadził do wprowadzenia związku znakowanego technetem, 99mTc-HYNICTOC (polskiej produkcji Tektrotyd). Jego przewaga nad oktreotydem polega na tym, że przy tych samych aktywnościach uzyskuje się obrazy o lepszej jakości i rozdzielczości. Jest to też znacznik tani, łatwy w produkcji, a samo badanie krótkie; obrazy uzyskuje się już po 1 i 4 godz., podczas gdy w Octreoscanie po 4 i 24 godzinach od podania znacznika. Poza tym przygotowanie do badania nie wymaga blokowania wychwytu przez tarczycę. Wymagane jest jedynie dobre nawodnienie pacjenta w celu przyspieszenia eliminacji niezwiązanego znacznika. W niektórych przypadkach wskazane może być podanie środków przeczyszczających, co minimalizuje artefakty wynikające z gromadzenia znacznika w przewodzie pokarmowym.
Scyntygrafia SRS jest badaniem o podstawowym znaczeniu w diagnostyce guzów neuroendokrynnych. Z badania na grupie kilkuset pacjentów z NET (w tym pheochromocytoma) wynika, iż czułość scyntygrafii technetowej wynosi 80%, swoistość – 92%, pozytywna wartość predykcyjna – ok. 98%, a trafność – 82%. Niska wartość predykcyjna ujemna – jedynie 47% (a więc stosunkowo duży odsetek wyników fałszywie ujemnych) – związana była natomiast z obecnością guzów o niskim stopniu zróżnicowania (widocznych za to w 18F-FDG PET) lub bardzo małych (5). Inne prace demonstrowały podobne parametry, jednocześnie wskazując na przewagę tektrotydu nad oktreotydem, a nieco mniejszą czułość i trafność badania SRS w porównaniu do PET z 68Ga-petydami (6).
PET z 68Ga-peptydami
Obecność receptorów somatostatynowych (SSTR) w guzie może posłużyć do obrazowania także metodą PET. Znacznikami w tych badaniach są tzw. 68Ga-DOTA-peptydy: DOTATOC, DOTATE, DOTANOC. Wychwyt radiofarmaceutyku zależy od gęstości receptorów SST na powierzchni komórki, jak również od stopnia internalizacji kompleksów ligand-receptor i dotyczy w największym stopniu receptora SSTR2, który występuje najczęściej na powierzchni komórek paraganglioma. Peptydy DOTA różnią się powinowactwem do innych receptorów SST, głównie 3-5. Obrazy są uzyskiwane szybko, 45-90 min od podania znacznika. Ze uwagi na czułość metody i łatwość wykonania badania, PET z 68Ga-peptydami jawi się jako idealny sposób obrazowania funkcjonalnego guzów neuroendokrynnych. Wysokie koszty i ograniczona dostępność badania uniemożliwiają niestety ich szersze stosowanie (4, 6).
Inne znaczniki w PET
Najbardziej rozpowszechnionym PET-znacznikiem jest 18F-fluorodeoksyglukoza. Jest ona wychwytywana przy użyciu błonowych transporterów dla glukozy, a po fosforylacji kumuluje się w komórce, w stopniu adekwatnym do jej aktywności metabolicznej. Obrazy są uzyskiwane ok. 60 minut po podaniu znacznika. Stężenie glukozy jest istotnym czynnikiem wpływającym na odczyt scyntygrafii, stąd wymaga się, aby pacjent pozostawał co najmniej 6 godzin na czczo przed badaniem. Gromadzenie 18F-FDG w prawidłowych nadnerczach oraz nieczynnych hormonalnie guzach jest niewielkie (mniej intensywne niż wychwyt wątroby), natomiast najbardziej intensywne spotykane jest w przerzutach nowotworowych do nadnerczy oraz w szybko rosnących lub złośliwych pheochromocytoma. Ograniczeniem metody jest fakt, iż duże gromadzenie znacznika może być widoczne również w aktywnych metabolicznie, wydzielających gruczolakach nadnerczy. SUV (standaryzowany wskaźnik wychwytu) jest łatwym i najczęściej używanym parametrem charakterystyki guza. Wartości SUVmax prawidłowych nadnerczy wahają się zwykle w granicach 0,95-2,46 (średnio 1,39 dla lewego nadnercza, a 1,68 – dla prawego) (7).
18F-FDOPA jako pochodna monoaminy, dihydroksyfenyloalaniny (DOPA), z której powstają wszystkie endogenne katecholaminy, jest wychwytywana i metabolizowana przez guzy typu PCC/PGL oraz inne z komórek układu APUD (ang. amine precursor uptake and decarboxylation, guzy neuroendokrynne). Zaletą 18F-FDOPA PET jest brak wychwytu przez prawidłowe nadnercza, stąd nadzieje na potencjalne zastosowanie tego badania w przyszłości, zwłaszcza w przypadkach wyczerpania innych dostępnych metod.
Wybór metody scyntygraficznej w obrazowaniu pheochromocytoma/paraganglioma (PCC/PGL)
Pheochromocytoma (guzy chromochłonne) i paraganglioma (przyzwojaki) są to najczęściej guzy łagodne i wolno rosnące. Złośliwość definiowana jest jako zdolność tworzenia ognisk przerzutowych komórek chromafinowych w miejscach, w których fizjologicznie one nie występują. Częstość tworzenia przerzutów zależy od lokalizacji guza, jego rozmiaru i podłoża genetycznego. Heterogenność guzów o typie PCC/PGL powoduje, iż nie ma uniwersalnej metody ich obrazowania, a określony typ badania może być bardziej lub mniej przydatny w zależności od uwarunkowań klinicznych.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Graban W, Kobylecka M, Królicki L: Medycyna nuklearna. [W:] Pruszyński B (red.): Radiologia. Diagnostyka obrazowa: rtg, TK, USG, MR i medycyna nuklearna. Wydawnictwo Lekarskie PZWL, Warszawa 2005.
2. Więcek A, Januszewicz A, Narkiewicz K, Prejbisz A: Diagnostyka nadciśnienia tętniczego. [W:] Więcek A, Januszewicz A, Szczepańska-Sadowska E et al. (red.): Hipertensjologia: patogeneza, diagnostyka i leczenie nadciśnienia tętniczego. Medycyna Praktyczna, Kraków 2015.
3. Williams Textbook of Endocrinology. 13th ed. by Elsevier. Section IV Adrenal Cortex and Endocrine Hypertension.
4. Taïeb D, Timmers HJ, Hindiè E et al.; European Association of Nuclear Medicine: EANM 2012 guidelines for radionuclide imaging of phaeochromocytoma and paraganglioma. Eur J Nucl Med Mol Imaging 2012; 39(12): 1977-1995.
5. Artiko V, Afgan A, Petrović J et al.: Evaluation of neuroendocrine tumors with 99mTc-EDDA/HYNIC TOC. Nucl Med Rev Cent East Eur 2016; 19(2): 99-103.
6. Madrzak D, Mikołajczak R, Kamiński G: Influence of PET/CT 68Ga somatostatin receptor imaging on proceeding with patients, who were previously diagnosed with 99mTc-EDDA/HYNIC-TOC SPECT. Nucl Med Rev Cent East Eur 2016; 19(2): 88-92.
7. Kandathil A, Wong KK, Wale DJ et al.: Metabolic and anatomic characteristics of benign and malignant adrenal masses on positron emission tomography/computed tomography: a review of literature. Endocrine 2015; 49(1): 6-26.
8. Rufini V, Treglia G, Castaldi P et al.: Comparison of metaiodobenzylguanidine scintigraphy with positron emission tomography in the diagnostic work-up of pheochromocytoma and paraganglioma: a systematic review. Q J Nucl Med Mol Imaging 2013; 57(2): 122-133.
9. Ilias I, Chen CC, Carrasquillo JA et al.: Comparison of 6-18F-fluorodopamine PET with 123I-metaiodobenzylguanidine and 111In-pentetreotide scintigraphy in localization of nonmetastatic and metastatic pheochromocytoma. J Nucl Med 2008; 49(10): 1613-1619.
10. van der Harst E, de Herder WW, Bruining HA et al.: [123I]metaiodobenzylguanidine and [111In] octreotide uptake in begign and malignant pheochromocytomas. J Clin Endocrinol Metab 2001; 86(2): 685-693.
11. Chang CA, Pattison DA, Tothill RW et al.: 68Ga-DOTATATE and 18F-FDG PET/CT in Paraganglioma and Pheochromocytoma: utility, patterns and heterogeneity. Cancer Imaging 2016; 16(1): 22.
12. Johnbeck CB, Knigge U, Kjær A: PET tracers for somatostatin receptor imaging of neuroendocrine tumors: current status and review of the literature. Future Oncol 2014; 10(14): 2259-2277.
13. Fikri AS, Kroiss A, Ahmad AZ et al.: Localization and prediction of malignant potential in recurrent pheochromocytoma/paraganglioma (PCC/PGL) using 18F-FDG PET/CT. Acta Radiol 2014; 55(5): 631-640.
14. Rubello D, Bui C, Casara D et al.: Functional scintigraphy of the adrenal gland. Eur J Endocrinol 2002; 147(1): 13-28.
15. Spyridonidis TJ, Apostolopoulos DJ: Is there a role for nuclear medicine in diagnosis and management of patients with primary aldosteronism? Hell J Nucl Med 2013; 16(2): 134-139.
16. Bednarek-Papierska L: Taktyka postępowania diagnostycznego i terapeutycznego w przypadku obustronnych incydentaloma nadnerczy przebiegających z podkliniczną hiperkortyzolemią. Post Nauk Med 2013; 3: 1-46.
17. Di Martino M, García Sanz I, Muñoz de Nova JL et al.: NP-59 test for preoperative localization of primary hyperaldosteronism. Langenbecks Arch Surg 2017; 402(2): 303-308.
18. Chen YC, Chiu JS, Wang YF: NP-59 SPECT/CT imaging in stage 1 hypertensive and atypical primary aldosteronism: a 5-year retrospective analysis of clinicolaboratory and imaging features. Scientific World Journal 2013; 2013: 317934.
19. Spyridonidis T, Giannakenas C, Lakiotis V, Apostolopoulos DJ: Adverse reactions following NP-59 administration. Nucl Med Commun 2008; 29(8): 749-750.
20. Mendichovszky IA, Powlson AS, Manavaki R et al.: Targeted Molecular Imaging in Adrenal Disease-An Emerging Role for Metomidate PET-CT. Diagnostics (Basel) 2016; 6(4). pii: E42.
21. Funder JW, Carey RM, Mantero F et al.: The Management of Primary Aldosteronism: Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2016: jc20154061.
22. Bardet S, Chamontin B, Douillard C et al.: SFE/SFHTA/AFCE consensus on primary aldosteronism, part 4: Subtype diagnosis. Ann Endocrinol (Paris) 2016; 77(3): 208-213.
23. Chen YC, Su YC, Chiu JS, Tseng CE: Diagnosis of primary aldosteronism in chronic kidney disease by I-131 NP-59 SPECT/CT imaging. Clin Nucl Med 2012; 37(2): e30-2.
24. Nakahama H, Fukuchi K, Yoshihara F et al.: Efficacy of screening for primary aldosteronism by adrenocortical scintigraphy without discontinuing antihypertensive medication. Am J Hypertens 2003; 16(9 Pt 1): 725-728.
25. Simon DR, Palese MA: Noninvasive adrenal imaging in hyperaldosteronism. Curr Urol Rep 2008; 9(1): 80-87.
26. Nomura K, Kusakabe K, Maki M et al.: Iodomethylnorcholesterol uptake in an aldosteronoma shown by dexamethasone-suppression scintigraphy: relationship to adenoma size and functional activity. J Clin Endocrinol Metab 1990; 71(4): 825-830.
27. Wong KK, Gandhi A, Viglianti BL et al.: Endocrine radionuclide scintigraphy with fusion single photon emission computed tomography/computed tomography. World J Radiol 2016; 8(6): 635-655.
28. Wong KK, Chondrogiannis S, Fuster D et al.: Additional value of hybrid SPECT/CT systems in neuroendocrine tumors, adrenal tumors, pheochromocytomas and paragangliomas. Rev Esp Med Nucl Imagen Mol 2017; 36(2): 103-109.
29. Powlson AS, Gurnell M, Brown MJ: Nuclear imaging in the diagnosis of primary aldosteronism. Curr Opin Endocrinol Diabetes Obes 2015; 22(3):150-156.
30. Burton TJ, Mackenzie IS, Balan K et al.: Evaluation of the sensitivity and specificity of (11)C-metomidate positron emission tomography (PET)-CT for lateralizing aldosterone secretion by Conn’s adenomas. J Clin Endocrinol Metab 2012; 97(1): 100-109.
31. Katabami T, Ishii S, Obi R et al.: Contralateral adrenal suppression on adrenocortical scintigraphy provides good evidence showing subclinical cortisol overproduction from unilateral adenomas. Endocr J 2016; 63(12): 1123-1132.
32. Papierska L, Ćwikła J, Rabijewski M: Adrenal 131I-6β-iodomethylnorcholesterol scintigraphy in choosing the side for adrenalectomy in bilateral adrenal tumors with subclinical hypercortisolemia. Abdom Imaging 2015; 40(7): 2453-2460.
33. Yu KC, Alexander HR, Ziessman HA et al.: Role of preoperative iodocholesterol scintiscanning in patients undergoing adrenalectomy for Cushing’s syndrome. Surgery 1995; 118(6): 981-986; discussion 986-987.
34. Vezzosi D, Tenenbaum F, Cazabat L et al.: Hormonal, Radiological, NP-59 Scintigraphy, and Pathological Correlations in Patients With Cushing’s Syndrome Due to Primary Pigmented Nodular Adrenocortical Disease (PPNAD). J Clin Endocrinol Metab 2015; 100(11): 4332-4338.
35. Terzolo M, Bovio S, Reimondo G et al.: Subclinical Cushing’s syndrome in adrenal incidentalomas. Endocrinol Metab Clin North Am 2005; 34(2): 423-439.
36. Mansmann G, Lau J, Balk E et al.: The clinically inapparent adrenal mass: update in diagnosis and management. Endocr Rev 2004; 25(2): 309-340.
37. Metser U, Miller E, Lerman H et al.: 18F-FDG PET/CT in the evaluation of adrenal masses. J Nucl Med 2006 ;47(1): 32-37.
38. Watanabe H, Kanematsu M, Goshima S et al.: Adrenal-to-liver SUV ratio is the best parameter for differentiation of adrenal metastases from adenomas using 18F-FDG PET/CT. Ann Nucl Med 2013; 27(7): 648-653.
39. Taïeb D, Sebag F, Pacak K: A Large Adrenal Tumor With Marked 18F-Fluorodeoxyglucose Uptake. JAMA 2017; 318(1): 84-85.
40. O’Neil B, Lowrance WT, Heilbrun ME: PET Scans With 18F-Fluorodeoxyglucose to Diagnose Adrenal Tumors. JAMA 2017; 318(16): 1614.
41. Mpanaka I, Lyra VD, Kaltsas G, Chatziioannou SN: High 18F-FDG uptake by the remaining adrenal gland four months after surgery and initiation of mitotane treatment in two patients with adrenocortical carcinoma. Hell J Nucl Med 2011; 14(2): 168-172.
42. Leboulleux S, Deandreis D, Escourrou C et al.: Fluorodesoxyglucose uptake in the remaining adrenal glands during the follow-up of patients with adrenocortical carcinoma: do not consider it as malignancy. Eur J Endocrinol 2011; 164(1): 89-94.

