© Borgis - Nowa Stomatologia 3/2004, s. 133-136
Małgorzata Nędzi-Góra, Jan Kowalski, Renata Górska
Ocena korelacji pomiędzy poziomem IL-1b oraz metaloproteinazy – 8, 9 i TIMP-1 w krwi obwodowej pacjentów z przewlekłym zapaleniem przyzębia
Evaluation of correlations between il-B and mmp-8,9 and timp-1 levels in peridental blood of patients with chronic periodontis
z Zakładu Chorób Błony Śluzowej i Przyzębia IS AM w Warszawie
Kierownik Zakładu: prof. dr hab. n. med. R. Górska

Podstawową rolę w etiopatogenezie przewlekłego zapalenia przyzębia odgrywają Gram-ujemne bakterie beztlenowe. Mogą one w sposób bezpośredni niszczyć tkanki przyzębia poprzez działanie produktów przemiany materii, enzymów oraz endo- i egzotoksyn. Ponadto bakterie inicjują pośrednie mechanizmy degradacji tkanek przyzębia. Kolonizacja powierzchni zęba i pogłębiającej się kieszonki rosnącą liczbą bakterii Gram-ujemnych powoduje wzrost poziomu lipopolisacharydów bakteryjnych. LPS stymulują komórki stacjonarne w przyzębiu (keratynocyty, fibroblasty, komórki endotelialne) oraz komórki nacieku zapalnego (neutrofile, makrofagi, leukocyty PMN, limfocyty) do syntezy i wydzielania enzymów, szerokiego spektrum cytokin pro- i przeciwzapalnych (IL-1b, TNF-a) oraz lipidowych mediatorów stanu zapalnego (prostaglandyn, prostacyklin, leukotrienów i lipoksyn). Kluczową rolę w etiopatogenezie choroby przyzębia odgrywają cytokiny prozapalne, a wśród nich interleukina 1-b. Wykazano, że stymuluje ona chemotaksję neutrofilów i monocytów (a więc komórek pierwszej linii obrony), zwiększa syntezę białek ostrej fazy, aktywuje limfocyty T i pobudza limfocyty B (komórki odpowiedzi swoistej) do produkcji przeciwciał. IL-1b stymuluje również syntezę fosfolipazy A2 i produkcję prostaglandyny E2, która wraz z interleukiną 6 pobudza osteoklasty do niszczenia kości wyrostka zębodołowego. Ponadto IL-1b oraz inne cytokiny prozapalne (np. TNF-a), a także bezpośrednio lipopolisacharydy bakteryjne stymulują komórki nacieku zapalnego oraz komórki przyzębia do syntezy i wydzielania enzymów niszczących macierz kolagenową, tzw. metaloproteinaz macierzy (MMPs, matrix metalloproteinases) oraz zmniejszają wydzielanie ich tkankowych inhibitorów (TIMPs, tissue inhibitors of metalloproteinases) (1).
Chociaż mechanizm wzajemnego oddziaływania cytokin i enzymów nie jest do końca poznany wydaje się, że odgrywają one zasadniczą rolę w patomechanizmie choroby przyzębia. Poznanie wzajemnych oddziaływań IL-1b oraz metaloproteinaz może być również użyteczne ze względu na zastosowanie nowych metod leczenia zapalenia przyzębia z uwzględnieniem preparatów o charakterze inhibitorów metaloproteinaz oraz inhibitorów receptorów dla IL-1.
CEL PRACY
Celem pracy była ocena poziomu wybranych czynników prozapalnych (IL-1b, MMP-8, MMP-9) i przeciwzapalnych (TIMP-1) w krwi obwodowej osób zdrowych i pacjentów z chorobą przyzębia oraz ocena korelacji pomiędzy poziomami ww. mediatorów. Ponadto podjęto próbę oceny różnych technik pomiaru stężenia IL-1b w krwi obwodowej.
MATERIAŁ I METODY
Badanie przeprowadzono u 70 osób w wieku 20-65 lat (35 kobiet i 35 mężczyzn, średnia wieku 43,4), u których na podstawie wywiadu, badania klinicznego oraz analizy zdjęć radiologicznych rozpoznano przewlekłe zapalenie przyzębia, umiarkowane lub ciężkie.
Badanie kliniczne obejmowało pomiar następujących parametrów klinicznych:
– głębokość kieszonki (PD) (mm),
– kliniczna utrata przyczepu łącznotkankowego (CAL) (mm),
– wskaźnik płytki wg O´Leary´ego (PI) (%),
– wskaźnik krwawienia wg O´Leary´ego (BI) (%).
Badanie przeprowadzono z użyciem Florida Probe – sondy o stałej sile nacisku sprzężonej z komputerem, oraz standardowej kalibrowanej sondy periodontologicznej WHO.
W trakcie doboru grupy badanej w szczególności uwzględniano następujące kryteria:
1. Brak w wywiadzie schorzeń ogólnych.
2. W badaniu klinicznym co najmniej 30% kieszonek badanych ze stwierdzoną utratą przyczepu łącznotkankowego.
3. W każdym kwadrancie co najmniej 2 zęby.
4. W badaniu klinicznym co najmniej jedno miejsce pomiarowe z CAL> 5 mm.
Utworzono również dla celów porównawczych grupę kontrolną, do której zakwalifikowano 30 osób w wieku 20-35 lat (16 kobiet i 14 mężczyzn, średnia wieku 29,4), u których na podstawie wywiadu nie stwierdzono współistniejącego schorzenia ogólnoustrojowego. U osób tych nie stwierdzano zmian zapalnych w obrębie tkanek przyzębia, a CAL nie przekraczał 1 mm.
W celu analizy stężeń wybranych związków pobierano 8-10 ml krwi z żyły łokciowej do probówki bez dodatku antykoagulantów. Po wykrzepieniu odwirowywano osocze w centryfudze przy przeciążeniu 150 G (2400 obr/10 minut). Odwirowane osocze schładzano do tepmeratury 2-4 stopnie Celsjusza i przesyłano do laboratorium, gdzie było zamrażane od momentu wykonania badań. Pomiaru stężenia IL-1b, MMP-8, MMP-9 i TIMP-1 dokonywano za pomocą techniki immunoenzymatycznej (ELISA) z użyciem znakowanych przeciwciał monoklonalnych firmy R&D Systems (Quantikine). Ponadto u 20 pacjentów pomiar IL-1b wykonano z użyciem testu OptEIA (Pharmingen), umożliwiającego laborantowi samodzielne przygotowanie stężeń testowych. Do badań kwalifikowano tylko osocze klarowne, bez śladu hemolizy. Zgodnie z zaleceniami producenta testu każdą próbkę oznaczano dwukrotnie.
Otrzymane wyniki poddano analizie statystycznej z użyciem testu t-Studenta dla zmiennych niepowiązanych, przy założeniu znamienności statystycznej dla p<0,05. Wzajemną relację wariancji dla serii zmiennych wyliczano z użyciem testu Levene´a. Analizę korelacyjną wybranych zmiennych przeprowadzono z użyciem testu Pearsona przy założeniu znamienności dla p<0,05.
WYNIKI
Na wykresie 1 przedstawiono średnie stężenia IL-1b, MMP-8, MMP-9, TIMP-1 w krwi obwodowej osób z grupy badanej i grupy kontrolnej. Stwierdzono znamiennie wyższe stężenie IL-1b w krwi obwodowej osób chorych (4,16 pg/ml vs 1,12 pg/ml), któremu jednocześnie towarzyszyło znamiennie niższe stężenie MMP-8 (4 pg/ml vs 6,25 pg/ml). Średnie stężenia MMP-9 i TIMP-1 w krwi obwodowej były nieznacznie wyższe u osób z grupy badanej.
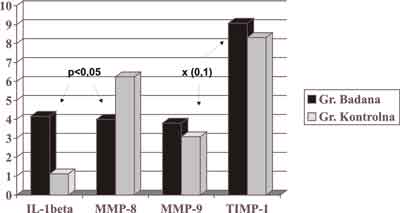
Wykres 1. Średnie stężenie wybranych IL-1b, MMP-8, MMP-9, TIMP-1 w krwi obwodowej.
LEGENDA:
p<0,05 – różnica znamienna statystycznie,
x (0,1) – średnie stężenia pomnożone przez wartość 0,1.
Tabela 1 przedstawia analizę korelacyjną stężeń IL-1b, MMP-8, MMP-9 i TIMP-1 w krwi obwodowej osób z grupy badanej. Wykazano bardzo silny związek wprost proporcjonalny pomiędzy stężeniem IL-1b i stężeniem MMP-9 (współczynnik Pearsona wynosi 0,76). Stwierdzono również słabą korelację pomiędzy IL-1b a TIMP-1 (0,38) oraz między MMP-9 a TIMP-1 (0,32).
Tabela 1. Korelacja stężeń IL-1b, MMP-8, MMP-9, TIMP-1 w krwi obwodowej.
| IL-1b | MMP-8 | MMP-9 | TIMP-1 |
| IL-1b | X | 0,18 | 0,76 | 0,38 |
| MMP-8 | 0,18 | X | 0,18 | -0,14 |
| MMP-9 | 0,76 | 0,18 | X | 0,32 |
| TIMP-1 | 0,38 | -0,14 | 0,32 | X |
LEGENDA:
PD – głębokość kieszonki
CAL – kliniczna utrata przyczepu łącznotkankowego
BI – wskaźnik krwawienia
PI – wskaźnik płytki
XXX – korelacja znamienna statystycznie (p<0,05)
W tabeli 2 przedstawiono wyniki badania korelacji pomiędzy wybranymi parametrami klinicznymi stanu przyzębia a IL-1b, MMP-8, MMP-9, TIMP-1. Nie stwierdzono korelacji dla żadnej z badanych par zmiennych.
Tabela 2. Korelacja pomiędzy IL-1b, MMP-8, MMP-9, TIMP-1 parametrami klinicznymi stanu przyzębia.
| IL-1b | MMP-8 | MMP-9 | TIMP-1 |
| PD | 0,16 | 0,09 | 0,10 | -0,14 |
| CAL | 0,11 | 0,19 | 0,06 | 0,06 |
| BI | 0,23 | 0,30 | 0,04 | -0,09 |
| PI | 0,21 | 0,03 | 0,13 | 0,10 |
| Liczba zębów | -0,07 | -0,33 | 0,01 | 0,25 |
LEGENDA:
PD – głębokość kieszonki
CAL – kliniczna utrata przyczepu łącznotkankowego
BI – wskaźnik krwawienia
PI – wskaźnik płytki
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Page R.C.: The role of inflammatory mediators in pathogenesis of periodontal disease, J. Periodontal. Res. 1991, 26, 3, 230-42. 2. Chang Y.C., et al.: Regulation of matrix metalloproteinase production by cytokines, pharmacological agents and periodontal pathogens in human periodontal ligament fibroblast cultures. J. Periodontal. Res. 2002, 37:196-203. 3.Unemori E.N., et al.: Constitutuve expression of a 92-kD gelatinase (type V collagenase) by rhumatoid synovial fibroblasts and its induction in normal human fibroblasts by inflammatory cytokines. J. Clin. Invest, 1991, 88, 1656-62. 4.Saren P., et al.: TNF-alpha and IL-1 beta selectively induce expression of 92 kDa gelatinase by human macrophages. J. Immunol. 1996, 157, 4159-65. 5.Johnatty R.N., et al.: Cytokine and chemokine regulation of proMMP-9 and TIMP-1 production by human peripheral blood lymphocytes, J. Immunol. 1997, 1, 2327-33. 6. Hanemaijer R., et al.: Matrix metalloproteinase-8 is expressed in rhumatoid synovial fibroblasts and endothelial cells. Regulation by TNFa and doxycycline, J. Biol. Chem. 1997, 272, 31504-31509. 7.Uchida M., et al.: Regulation of matrix metalloproteinase (MMPs) and tissue inhibitors of metalloproteinases (TIMPs) by bone resorptive factors in osteoblastic cells, J. Cell. Physiol. 2000, 185, 207-14. 8.Overrall C.M., et al.: Trancriptional and post-transcriptional regulation of 72-kDa gelatinas/type IV collagenase by transforming growth factor-b1 in human fibroblasts, J. Biol. Chem. 1991, 266, 14064-71. 9.Salo T., et al.: Trnsforming growth factor-b1 up-regulates type IV collagenase expression in cultured human keratinocytes, J. Biol. Chem. 1991, 266, 11436-41. 10.Palosaari H., et al.: The expression of MMP-8 in odontoblasts and dental pulp cells is down regulated by TGF-b1, J. Dent. Res. 2000, 79, 77-84. 11.Ito A., et al.: Degradation of IL-1b by matrix metalloproteinases, J. Biol. Chem. 1996, 271, 14657-60. 12.Schonbeck U., et al.: Generation of biologically active IL-1b by matrix metalloproteinases: a novel caspase-1-independent pathway of IL-1b processing, J. Immunol. 1998, 161, 3340-3346. 13.Eberhardt W., et al.: Amplification of IL-1 beta-induced matrix metalloproteinase-9 expression by superoxide in rat glomerular mesangial cells is mediated by increased activities of NF-kappa B and activating protein-1 and involves activation of the mitogen-activated protein kinase pathways. J. Immunol. 2000, 165:5788-5797. 14.Chang Y.C., et al.: Regulation of MMPs and TIMPs by IL-1beta during corneal ulceration and infection. Invest Ophthalmol Vis Sci, 2003, 44, 2020-2025.

