© Borgis - Nowa Stomatologia 3/2000, s. 23-28
Piotr Wychowański1, Elżbieta Urbanowska2, Jolanta Malec1, Hanna Markiewicz3, Andrzej Wojtowicz1
Inżynieria tkankowa. Cz. 2. Ocena wykorzystania autogennej masy płytkowej i Bio-Oss w gojeniu się ubytków kostnych po wyłuszczeniu torbieli żuchwy
The evaluation of the effect of autogenic platelled rich plasma combined with Bio-Oss on bone healing process after mandibular cystectomiae
1z Zakładu Chirurgii Stomatologicznej Instytutu Stomatologii Akademii Medycznej w Warszawie
Kierownik Zakładu: dr hab. med. Andrzej Wojtowicz
2Bank Komórek Krwiotwórczych Kliniki Hematologii, Onkologii i Chorób Wewnętrznych Akademii Medycznej w Warszawie
Kierownik Kliniki: prof. dr hab. W. Wiktor-Jędrzejczak
3z Zakładu Radiologii Stomatologicznej i Szczękowo-Twarzowej Instytutu Stomatologii Akademii Medycznej w Warszawie
Kierownik Zakładu: dr n. med. Hanna Markiewicz

Wstęp
Proces regeneracji (rekonstytucja kształtu i funkcji uszkodzonych tkanek) znacznie różni się od reparacji, która najczęściej występuje w procesie naturalnego gojenia się odtwarzając ciągłość tkanek bez przywrócenia im zróżnicowania i funkcji, najczęściej w postaci blizny łącznotkankowej. Regeneracja tkanek jest możliwa dzięki aktywacji kaskady czynników wzrostowych oddziałujących najczęściej autokrynowo lub parakrynowo (11, 12, 13, 14, 27).
Inżynieria tkankowa wykorzystująca osiągnięcia medycyny i chirurgii, biologii komórki i biologii molekularnej, chemii, polimerów oraz fizjologii, w praktyce oznacza rekonstrukcję tkanek na wzór procesów embrionalnych – jest powtórzeniem ich tworzenia się i różnicowania („biomimetyka”) (19, 26). Dla potrzeb klinicznych wprowadzono pojęcie sterowanej regeneracji tkanek (GTR, guided tissue regeneration) (9,18, 24) i węższe określenie sterowanej regeneracji kości (GBR guided bone regeneration)(5, 6, 7, 10, 31). Procesy te zależą od dostarczonych, lub stymulowanych miejscowo czynników wzrostowych, białek morfogenetycznych kości (BMPs), sterujących kolejnością tworzenia i różnicowania się tkanek.
Marx i wsp. (21, 22), oraz Lynch i wsp.(19) zaproponowali dla potrzeb GTR i GBR wykorzystanie autogennej masy płytkowej, uzyskiwanej poprzez zagęszczanie płytek krwi na drodze tzw. tromboforezy. Trombocyty zawierają w znacznym stężeniu m.in. naturalne tkankowe czynniki wzrostowe: PFGF (platelet-derived growth factor – płytkopochodny czynnik wzrostu), TGFb (transforming growth factor beta-transformujący czynnik wzrostu beta), niezbędne w procesach regeneracji tkanek (2, 3, 4, 8).
Materiał i metody
Badania przeprowadzono wśród pacjentów Zakładu Chirurgii Stomatologicznej Akademii Medycznej w Warszawie. Do planu badawczo-terapeutycznego kwalifikowano pacjentów ogólnie zdrowych, leczonych z powodu rozległych torbieli obejmujących część zębodołową i trzon żuchwy. Pacjentom zaproponowano zabieg operacyjnego usunięcia torbieli z wypełnieniem jamy w kości autogenną masą płytkową i materiałem Bio-Oss (zgoda-postanowienie Terenowej Komisji Nadzoru nad Dokonywaniem Badań na Ludziach przy Akademii Medycznej z dn. 7 X/98 i 10 VI/99). Pacjenci zostali poinformowani na piśmie o istocie i etapach zabiegu (badanie podstawowych parametrów krwi, badanie parametrów krzepliwości krwi, tromboforeza, oraz właściwy zabieg chirurgiczny) oraz wyrazili zgodę na zaproponowane leczenie (dokument zgody). Po przygotowaniu ogólnym pacjenta do zabiegu chirurgicznego (wywiad, badanie przedmiotowe, rentgenodiagnostyka, analizy laboratoryjne krwi i moczu) leczono endodontycznie zęby, których korzenie tkwiły w torbieli. Następnie wdrażano leczenie operacyjne w osłonie antybiotykowej (Dalacin C 0,5 g x 3/dobę). Wyłuszczenie torbieli przeprowadzano w znieczuleniu miejscowym metodą Partsh II. Materiał uzyskany śródoperacyjnie od pacjenta badano histopatologicznie. Do wypełniania powstałych w ten sposób ubytków kostnych stosowano mieszaninę autogennej masy płytkowej (15, 23, 25, 28, 29) i Bio-Oss (Geistlich-Biomaterials).
Przygotowanie masy płytkowej (PRP, platelet rich plasma)
Metoda zaproponowana przez Marxa i Lyncha (19) zakłada sortowanie i izolację płytek. Za pomocą urządzenia (Compact Advanced Platelet Sequestration System) CAPSS możliwe jest uzyskanie 15 ml osocza bogatego w płytki ze 150 ml pobranej krwi obwodowej.
Osocze bogatopłytkowe PRP uzyskuje się z krwi autogennej wykorzystując aparat do separacji komórek krwi metodą tromboferezy.
Autorzy użyli aparatu Cobe Spectra (firmy Gambro), który pozwala na oddzielenie i skoncentrowanie płytek w czasie zabiegu bez wpływu na przebieg i tempo przeprowadzanych zabiegów chirurgicznych (ryc. 1).
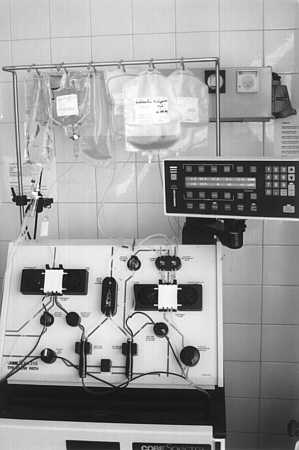
Ryc. 1. Cobe-Spectra, system do izolacji komórek krwi, wykorzystany do izolacji i zagęszczenia płytek krwi.
PRP jest pozyskiwane w ciągu 40 min. Separator pobiera ok. 400-450 ml krwi pacjenta przez cewnik wprowadzony do żyły głównej (tempo przepływu krwi wynosi 50 ml na minutę przy prędkości wirowania 5600 obr/min). W chwili pobrania do krwi dodawany jest cytrynian w stosunku 1:5, który wiążąc jony wapnia działa przeciwzakrzepowo. Krew po odwirowaniu w wirówce separatora jest podzielona na trzy podstawowe składniki w zależności od ich gęstości w kolejności od najmniej do najbardziej gęstych: osocze niskopłytkowe PPP, następnie bogatopłytkowe PRP, najgęstsza jest warstwa zawierająca erytrocyty RBC (1). Składnik PPP to osocze bezkomórkowe stanowiące ok. 200 ml, które powraca do pacjenta podobnie jak zagęszczone czerwone krwinki RBC. PRP zawierają fibrynogen i czynniki krzepnięcia a powstanie fibryny dostarcza naturalnej matrycy niezbędnej dla gojenia się uszkodzonych tkanek.
Zastosowanie PRP w zabiegach regeneracji kości wymaga zainicjowania procesu koagulacji poprzez zastosowanie mieszaniny złożonej z 10 ml 10% chlorku wapnia i 10 000 jednostek trombiny (Polfa). Równolegle do PRP ulegajacej wolnej konsolidacji (koagulacji) dodawano w trakcie zabiegu chirurgicznego porcję Bio-Oss powoli mieszając. Ten specyficzny, złożony przeszczep autoksenogenny PRP-Bio-Oss, powstały w wyniku powyższych procedur umieszczano w łożu tkankowym w kilku porcjach (ryc. 2). Powstająca w PRP fibryna działa jak klej tkankowy, który łączy przeszczep z tkanką kostną ograniczającą jamę po wyłuszczonej torbieli, co pomaga chirurgowi w uformowaniu tkanek.

Ryc. 2. Przeszczep autokesenogenny, masa płytkowa Bio-Oss, preparat histologiczny, pow. X 100, barwienie hematoksylina-eozyna.
Sieć fibrynowa działa jako fundament dla tworzenia kości, do wrastania naczyń, do dyfuzji tlenu w przeszczepie po tym jak czynniki wzrostowe w płytkach zainicjowały osteogenezę (16, 17, 18, 30).
Przypadek 1
Pacjentka P. A. lat 16 zgłosiła się do Zakładu Chirurgii Stomatologicznej Akademii Medycznej w Warszawie z powodu rozległej torbieli przedniego odcinka trzonu żuchwy rozciągającej się na część zębodołową żuchwy obejmując korzenie zębów 31, 32, 33 (ryc. 3). W wywiadzie pacjentka zgłaszała uraz okolicy bródki około 3 lata temu, któremu towarzyszyło samoistnie ustępujące rozchwianie zębów. Około dwóch tygodni temu pojawiły się silne dolegliwości bólowe okolicy wargi dolnej po stronie lewej, którym towarzyszyła wzmożona ciepłota ciała oraz ogólne złe samopoczucie. Miejscowo pojawiło się obrzmienie wargi dolnej i bródki. Pacjentka w ramach pierwszej pomocy była leczona w Rejonowej Poradni Stomatologicznej metodą nacięcia wewnątrzustnego, sączkowaniem i antybiotykoterapią. Kontrolne badanie radiologiczne metodą wewnątrzustną wykazało obecność wyraźnie ograniczonego ogniska osteolitycznego z otoczką osteosklerotyczną. Zmiana ta obejmowała swoim zasięgiem zęby 31, 32, 33 rozprzestrzeniając się w okolicznej części zębodołowej żuchwy i przyległej części trzonu żuchwy. Pacjentkę skierowano do Zakładu Chirurgii Stomatologicznej Instytutu Stomatologii Akademii Medycznej w Warszawie. Badanie pantomograficzne potwierdziło obecność obszaru osteolitycznego o wyraźnie zaznaczonej otoczce osteosklerotycznej (ryc. 3). Badanie żywotności zębów 31, 32, 33 dało wynik negatywny. Na podstawie wywiadu i badania podmiotowego oraz badania radiologicznego postawiono rozpoznanie wstępne: „cystis radicularis 31, 32, 33”. W związku z tym pacjentce przeleczono endodontycznie zęby 31, 32, 33 (ryc. 4) oraz zaplanowano przeprowadzenie zabiegu wyłuszczenia torbieli (metoda Partsh II) wraz z resekcją wierzchołków korzeni zębów 31, 32, 33. Ze względu na młody wiek pacjentki oraz znaczną rozległość ubytku kostnego zdecydowano się na wypelnienie ubytku w kości po usuniętej torbieli autogenną masą płytkową z materiałem Bio-Oss celem uzyskania szybszego i pełniejszego efektu regeneracji tkanki kostnej.
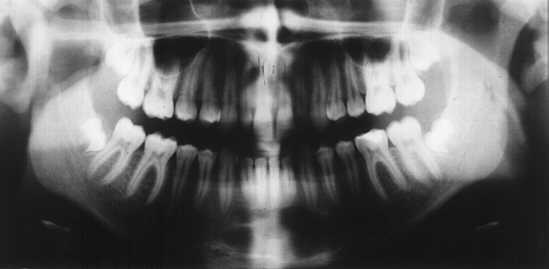
Ryc. 3. Pantomogram, (pacjent A.P., l .16), rozległa torbiel korzeniowa zębów 31, 32, 33, widoczna otoczka osteosklerotyczna.
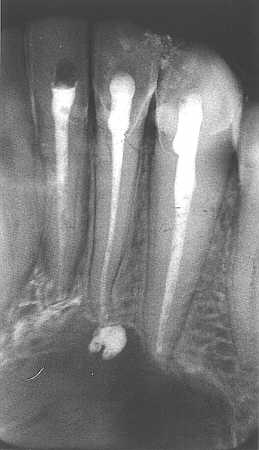
Ryc. 4. Zdjęcie zębowe (pacjent A.P., l.16), torbiel korzeniowa zębów 31, 32, 33; zęby po leczeniu endodontycznym.
Przypadek 2
Pacjent C.M. lat 34 zgłosił się do Zakładu Chirurgii Stomatologicznej Akademii Medycznej w Warszawie z powodu bolesnego obrzmienia lewego policzka, które pojawiło się dwa dni temu. Obrzmieniu towarzyszyły objawy ogólne zapalenia. Klinicznie stwierdzono niechełbocące, twarde, nieprzesuwalne spłycenie przedsionka jamy ustnej w jego bocznym odcinku po stronie lewej. Radiologicznie zaobserwowano rozległy ubytek osteolityczny części zębodołowej i trzonu żuchwy obejmujący korzeń zęba 34 rozprzestrzeniajacy się w rzucie brakujących zębów 35 i 36. Nie obejmował on korzeni zęba 37, natomiast kontaktował się z przebiegiem nerwu zębodołowego dolnego i bródkowego po stronie lewej. Zaobserwowano wyraźną otoczkę osteosklerotyczną ubytku kostnego. Na podstawie przeprowadzonych badań postawiono rozpoznanie wstępne: „cystis radicularis 34”. W związku z powyższym wykonano leczenie endodontyczne zęba 34. Następnie zaplanowano zabieg wyłuszczenia torbieli metodą Partsh II z następowym wypełnieniem ubytku kostnego autogenną masą płytkową z materiałem Bio-Oss.
Zabieg 1 wykonano w znieczuleniu miejscowym Marcainą wykonując obustronne iniekcje w okolice otworów żuchwowych oraz iniekcję podśluzówkową w przednim odcinku przedsionka jamy ustnej. Usunięto ją dłutem i kleszczami Luera odsłaniając przednią ścianę torbieli. Torbiel wyłuszczono w całości a pobrany materiał tkankowy wysłano do badania histopatologicznego. Wierzchołki korzeni zębów 31, 32, 33 zresekowano (ryc. 5). Powstałą po zabiegu lożę kostną wypełniono materiałem Bio-Oss zmieszanym z przygotowaną uprzednio autogenną masą płytkową (ryc. 6). Po umieszczeniu przeszczepu masy płytkowej z Bio-Oss okno w przedniej ścianie ubytku kostnego żuchwy pokryto warstwą filmu biologicznego uzyskanego z konsolidującej masy płytkowej (bez Bio-Oss), co pozwoliło na niestosowanie błony zaporowej (ryc. 7). Ranę zaszyto na głucho (ryc. 8). Jako osłonę pozabiegową zlecono Dalacin C per os 0,3 g co 8 godzin przez 6 dni.

Ryc. 5. Pacjent A.P. l. 16, zdjęcie śródoperacyjne wewnątrzustne, widoczna torbiel po usunięciu zewnętrznej blaszki kostnej.
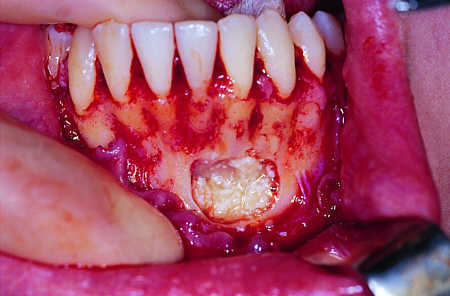
Ryc. 6. Pacjent AP 1.16, zdjęcie śródoperacyjne wewnątrzustne, jama po wyłuszczeniu torbieli wypełniona masą płytkową z Bio-Oss.

Ryc. 7. Pacjent A.P. l. 16, zdjęcie śródoperacyjne wewnątrzustne, jama po wyłuszczeniu torbieli i wypełnieniu jej przeszczepem zaopatrzona autogenną błoną fibrynową z zawartością masy płytkowej bez Bio-Oss.
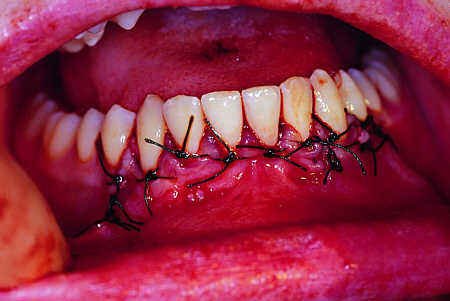
Ryc. 8. Pacjent A.P. l. 16. zdjęcie śródoperacyjne wewnątrzustne, zaszyta rana pooperacyjna.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Antonaides H.N.: Human platelet derived growth factor (PDGF): Purification of PDGF-I and PDGF-II and separation of their reduced sub-units. Proct Natl Acad Sci USA 1981, 78:7314-7317. 2. Antonaides H.N., Williams L.T.:. Human platelet derived growth factor: Structure and functions. Fed. Proc. 1983, 42:2630-2634. 3. Beck L.S.et al.: One systemic administration of transforming growth factor- beta, reverses age or glucocorticoid-impaired wound healing. J. Clin. Invest. 1993, 93:2841-2849. 4. Bowen- Pope D.F. et al.:Production of platelet derived growth factor like molecules reduced expression of platelet derived growth factor receptors accompany transformation by a wide spectrum of agents. Proc. Natl. Acad. Sci. USA 1984, 81:2396-2400. 5. Canalis E. et al.: Insuline-like growth factor I mediates selective anabolic effects of parathyroid hormone in bone cultures. J. Clin. Invest. 1989, 83:60-65. 6. Caplan A.I.: Bone development and repair. Bioesseys 1987, 6:171-175. 7. CaplanA.I.: Mesenchymal stem cells. J. Orthop. Res. 1991, 9:641-650. 8. Celeste A.J. et al.: Identification of transforming growth factor beta to family members present in bone-inductive protein purified bovinebone. Proc. Natl. Acad. Sci. USA 1990, 87:9843-9847. 9. Davies J.C. et al.: Compromised soft tissue wounds: Correction of wound hypoxia. In: Hunt TK (ed). Problem Wounds: The role of Oxygen. New York: Elsevier, 1988, 143-152. 10. Delmas P.D., Malaval L.: The proteins of bone. Physiology and Pharmacology of Bone. Berlin: Springer 1993, 673-724. 11. Dequeker J.: Bone structure and function. Rheumatology. St Louis: Mosby, 1994, 7-9. 12. Greenlagh D.G.: The role of growth factors in wound healing. J Trauma 1996, 41:159-167. 13. Hunt T.K. et al.: Defences of the wound. Surgical Infectious Disease. New York: Appelton-Lange. 14. Hussain M.Z. et al.: Wound micro-environment. Wound Healing: Biochemical and Clinical Aspects. Philadelphia: Saunders, 1991, 162-196. 15. Johnson A. et al.: The C-sis gene encodes a precursor of the B chain of platelet gerived growth factor. Embryol. J. 1984, 921-928. 16. Johnson K. et al.: Oxygen as an isolated variable influences resistance to infection. Ann. Surg. 1988, 208:783-787. 17. Knighton D. et al.: Regulation of wound healing angiogenesis. Effect of oxygen gradients and inspired oxygen concentration. Surgery 1981, 90:262-270. 18. Knighton D.R. et al.: Regulation of repair: Hypoxic control of macrophage mediated angiogenesis. Soft and hard tissue repair. New York Praeger, 1984, 41-49. 19. Lynch S. et al.: Tissue Engineering aplications in maxillofacial surgery and periodontitis. Quintessence Pub. Co. Inc. Chicago 1999. 20. Marx R.E.: Radiation injury to tissue. In: Kindwall ER. Hyperbaric Medicine Practice. Flagstaff, AZ: Best Publishing Company, 1994, 447-504. 21. Marx R.E. et al.: Platelet-rich plasma:Growth factor enhancement for bone grafts. Oral. Surg. Oral. Med. Oral. Pathol. 1998, 85:638-646. 22.Marx R.E.: Clinical applications of bone biology to mandibular and maxillary reconstruction. Clin. Plast. Surg. 1994, 21:377-392. 23. Miyazano K. et al.: Receptors for transforming growth factor beta. Adv. Immunol. 19944, 55:181-220. 24. Mohan S., Baylink D.J.: Bone growth factors. Clin. Orthop. Relat. Res. 1991, 263:30-43. 25. Mustoe T.A. et al.: Reversal of impaired wound healing in irradiated rats by platelet derived growth factor-BB: Requirement of an active bone marrow. Am. J. Surg. 1989, 158:348-350. 26. Pochwalski M. i wsp.: Inżynieria tkankowa: zastosowania w stomatologii: masa płytkowa, Cz.I. Nowa Stomatologia 1-2/2000 str.17-22. 27. Pierce G.F. et al.: PDGF-BB, TGF-beta 1, and basic FGF i dermal wound healing: Neo-vessel and matrix formation and cessation of repair. Am. J. Pathol. 1992, 140:1375-1388. 28. Roberts A.B., Spron M.B.: Physiologic actions and clinical applications of transforming growth factor beta (TGF-beta). Growth Factors 1993, 8: 1-9. 29. Ross R. Et al.: The biology of platelet-derived growth factor. Cell 1986;46:155-169. 30. Singh J.P. et al.: Phylogenetic analysis of platelet derived growth factor by radio-receptor assay. J. Cell. Biol. 1982, 95:667-671. 31. Wergedal J.E. et al.: Skeletal growth factor and other factors known to be present in bone matrix stimulate proliferation and protein synthesis in human bone cells. J. Bone. Miner. Res. 1990, 5:179-186.








