Urszula Jędrasiak, Izabella Radomska, Małgorzata Kępińska
Parametry białokrwinkowe we krwi pępowinowej donoszonych noworodków – na podstawie badań własnych
Leukocytic parameters in the umbilical blood of full-term neonates – on the basis of authors experience
z Kliniki Neonatologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: dr med. Izabella Radomska

Ochrona organizmu przed różnymi czynnikami patogenetycznymi to podstawowa funkcja układu immunologicznego. Podobnie jak inne układy, jest on u noworodka zarówno morfologicznie jak i czynnościowo niedojrzały. Używa się nawet określenia „fizjologiczne, wrodzone niedobory odporności”. Mimo, że większość komponentów układu jest obecna po urodzeniu, dokładniejsze badania wykazują nieprawidłowości pra wie każdej jego składowej. Układ odpornościowy kształtuje się od wczesnych tygodni życia płodowego (ok. 6 hbd), jednak intensywny jego rozwój ma miejsce dopiero po urodzeniu. Sterylność środowiska wewnątrzmacicznego, napływ matczynych immunoglobulin, wyższa aktywność komórek T supresorowych wygaszają zjawiska obrony immunologicznej.
Obrona immunologiczna składa się z dwóch podstawowych mechanizmów: nieswoistych, do których należy układ fagocytozy i układ dopełniacza oraz swoistych, które współtworzą limfocyty T i B. Mechanizmy nieswoiste stanowią pierwszą linię obrony gospodarza. Komórki fagocytujące szybko odpowiadają na zakażenie. Migrują bezpośrednio do źródła zakażenia, pochłaniają i niszczą obce organizmy, uwalniają substancje bakteriobójcze. W następstwie pochłonięcia dochodzi do uwolnienia wewnątrzkomórkowych produktów, w tym toksycznych metabolitów tlenowych, proteaz, fosfolipaz, defensyn, które zabijają zarówno organizmy Gram (+) jak i Gram (-) oraz wiele gatunków grzybów. Funkcja granulocytów, sam proces fagocytozy jak i wspomagające ją czynniki humoralne: swoiste przeciwciała oraz układ dopełniacza są nawet u dojrzałego noworodka niedostatecznie wykształcone. Defekty zarówno ilościowe jak i jakościowe procesu fagocytozy, przyczyniają się znacznie do stanu względnego niedoboru odporności noworodka i powodują, że pierwsza linia obrony może zawieść. Noworodek rodzi się z dużą liczbą fagocytów: granulocytów obojętnochłonnych, monocytów oraz komórek NK. Liczba limfocytów, komórek T-supresorowych i pomocniczych jest prawidłowa. Ta selektywna leukocytoza jest wynikiem wzrostu we krwi poziomu katecholamin i kortyzonu w odpowiedzi na stres porodowy. Znany jest fakt niższych wartości leukocytozy we krwi pępowinowej noworodków urodzonych w czasie planowanego cięcia cesarskiego. Poród siłami natury wydaje się być zjawiskiem immunologicznie dobroczynnym (3, 20).
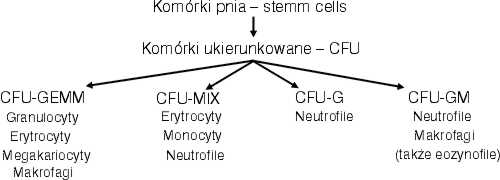
Do 14 hbd granulocyty nie są wytwarzane przez płód (1, 4). Ich liczba rośnie w II trymestrze osiągając wartość średnią 2,5 tys/mm3 w 22 hbd. W miarę rozwoju płodu czynność leukopoetyczną przejmuje szpik kostny. Wcześniej proces hematopoezy ma miejsce w woreczku żółciowym. Według ostatnich badań wykorzystujących płody poronione w II trymestrze wątroba i śledziona nie są miejscami produkcji i magazynowania neutrofili (1). Głównym narządem leukopoezy jest szpik kostny. Cykl żółciowy neutrofila obejmuje trzy fazy: szpik-krew-tkanki. Proces leukopoezy zachodzący w szpiku jest regulowany przez szereg reakcji między komórkami krwiotwórczymi a komórkami zrębowymi (12). Te ostatnie poprzez substancje pozakomórkowe regulują kontakty między komórkami mikrośrodowiska szpiku. Komórki progenitorowe, tak zwane komórki pnia, mają zdolność samoodnowy i różnicowania, dając początek wielu klonom komórek. Relatywnie mała ilość pluripotentnych komórek pnia daje początek dużej liczbie funkcjonalnie różnych, dojrzałych komórek efektorowych (8, 12). Zmienność jest charakterystyczną cechą komórek progenitorowych. Niektóre komórki pnia dają początek pojedynczym koloniom neutrofilów, niektóre koloniom mieszanym, złożonym z wielu typów komórek. I tak CFU-GEMM (Colony Forming Unit – Granulocytes, Erythrocytes, Megakariocytes, Macrophages) może różnicować się w kierunku zarówno granulocytów jak i erytrocytów i megakariocytów. CFU-GM (granulocyte-macrophage progenitor) pod wpływem GM-CS (granulocyte-macrophage colony stimulating factor) wytwarza skupiska neutrofili i monocytów a także czasem eozynofile i komórki tuczne. CFU-G (granulocyte progenitor) różnicuje się tylko w kierunku neutrofili pod wpływem czynnika G-CSF (granulocyte colony stimulating factor) oraz niektórych interleukin. M-CSF (macrophage colony stimulating factor) stymuluje tylko kolonie monocytów czyli makrofagów. Komórki fagocytujące pochodzą więc z tej samej wspólnej komórki macierzystej szpiku, która różnicuje się w określone linie. Chociaż CFU-GM, CFU-G, CFU-M są względnie nieaktywne u osobników dorosłych, u noworodków wykazują wysoki podstawowy rytm namnażania, co może ograniczyć możliwość przyspieszenia produkcji fagocytów nie tylko w czasie infekcji (1, 4, 5).
Na rycinie 1 przedstawiono schematyczne powstawanie komórek fagocytujących krwi.
Ryc. 1. Wskaźniki neutrofilowe krwi pępowinowej w badanej grupie noworodków.
Krew pępowinowa, podobnie jak krew płodu zawiera 10-50 razy większe stężenie CFU-GM i CFU-MIX (Colony Forming Unit mający zdolność różnicowania się w kierunku wielu różnych linii komórkowych, często utożsamianych z GEMM) niż krew dorosłych (1). Dojrzewanie macierzystych komórek krwiotwórczych w kierunku neutrofili podlega regulacji przez glikoproteinę G-CSF oraz niektóre interleukiny np. IL-3, IL-6, IL-11 (3, 7, 11). Proces rozwoju od komórki macierzystej do dojrzałego granulocyta wynosi średnio 10 dni (4-14). G-CSF wzmaga dojrzewanie progenitorów neutrofili, przyspiesza uwalnianie neutrofili ze szpiku do krwi a także wzmaga funkcję makrofagów (chemotaksję, fagocytozę). W szpiku możemy wyróżnić dwa przedziały neutrofili: przedział komórek dzielących się (mieloblasty, promielocyty, mielocyty) oraz pulę komórek, które utraciły zdolność dzielenia się (metamielocyty, granulocyty o jądrze pałeczkowatym, granulocyty o jądrze wielopłatowym). Jest to pula zmagazynowanych neutrofili stanowiących tzw. rezerwę szpikową, w miarę potrzeby uwalnianą do krwi. Stosunek liczby granulocytów pałeczkowatych do całkowitej liczby neutrofili jest wyższy w szpiku niż we krwi, co świadczy o tym, że do krwi uwalniają się głównie dojrzałe granulocyty. Rezerwa szpikowa noworodka jest 7 razy mniejsza w przeliczeniu na kg masy ciała niż u osoby dorosłej. Jest to istotny niedobór w przypadku infekcji (2, 3, 5).
Neutrofile przechodzące do krwi dzielą się na dwie pule: krążącą i marginalną. Obie pule komórek są w równowadze. Zawierają mniej więcej taką samą liczbę komórek na kg masy ciała i takie same ich proporcje. Pula marginalna czyli rezerwa dyspozycyjna to granulocyty obojętnochłonne przylegające do postkapilarnych naczyń żylnych, przygotowane do diapedezy, zatrzymane w zatokach naczyniowych i rozgałęzieniach naczyń włosowatych w śledzionie, wątrobie i szpiku. To właśnie ta pula uruchamiana jest jako pierwsza w przypadku infekcji. Ruch granulocytów na drodze szpik – krew – tkanki jest zawsze jednokierunkowy. Nie ma powrotu granulocytów z puli tkankowej do puli krążącej.
Adrenalina, związany z jej wyrzutem do krwi stres, wysiłek fizyczny, powodują wzmożone przechodzenie neutrofili z puli marginalnej do krążącej, powodując przejściową neutrofilię. Długi, np. 3-minutowy głośny płacz noworodka może podwoić liczbę granulocytów we krwi (1). Odwrotny ruch neutrofili z puli krążącej do marginalnej występuje 1-2 godz. po eksperymentalnym podaniu endotoksyny bakteryjnej do krwiobiegu. Stres okołoporodowy, wyrzut do krwi amin katecholowych i sterydów są odpowiedzialne za neutrofilię występującą w pierwszych dobach życia. O ile katecholaminy mają wpływ na pulę marginalną to hydrokortyzon indukuje uwalnianie rezerwy szpikowej i zmniejsza migrację granulocytów do tkanek. Okres życia granulocytów we krwi jest krótki. T1/2 wynosi 6-8 godz. Krwinki opuszczają krwiobieg raczej przypadkowo niż według ich wieku, jak ma to miejsce w przypadku erytrocytów i płytek krwi (1, 6). W ciągu kilku minut po rozwoju lokalnej infekcji neutrofile gromadzą się przy nabłonku naczyń i dzięki zdolności do odkształcania się poprzez wsuwanie pseudopodiów przechodzą między komórkami śródbłonka do tkanki. Czas życia neutrofila w tkankach jest krótki. Trwa 1-2 dni. Neutrofile nie zaangażowane w procesy zapalne usuwane są poprzez układ moczowy, oddechowy, pokarmowy a także przez wątrobę i śledzionę. Istnieją pewne różnice w rozmieszczeniu neutrofili w krążeniu tętniczym i żylnym (1). Próbka krwi tętniczej może zawierać nawet o 1/3 mniej granulocytów niż próbka krwi żylnej, pobranej jednocześnie. Nie obserwuje się różnic w proporcji komórek. Stosunek I/T (immature-to-total ratio) jest identyczny. Szybki, pulsacyjny przepływ krwi tętniczej spycha relatywnie większe komórki krwi na obrzeża naczyń, podczas gdy do próbki krwi kierowany jest centralny strumień zawierający mniejsze komórki. Średnica dojrzałego granulocyta wynosi 12-15 µm a średnica erytrocyta 7,5 µm.
Prawidłowa liczba neutrofili zależy od wieku i rasy. Wartości te wahają się od 1,8 do 7,0 x 109 G/l, średnio 4,0 x 109 G/l (9). Wydaje się, że wartości między 2 tygodniem a pierwszym rokiem życia mogą być nieznacznie niższe. Zakażone noworodki mogą szybko rozwinąć neutropenię. Jest to spowodowane zmniejszoną rezerwą szpikową oraz dużym zużyciem krwinek w puli krążącej. Zdolność szpiku do odpowiedzi na stres jest zmniejszona, wtórnie do niewystarczającego wytwarzania CSF (colony stimulating factor).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Al-Mulla Z., Christensen R.: Neutropenia in the neonate Clinics in Perinatology 1995, 22:711-739. 2. Baley J.E. et al.: Neonatal neutropenia. Am. J. Dis. Child. 1988, 142:1161-1166. 3. Ballow M. et al.: Development of the immune system in very low birth weight (less than 1500 g) premature infants: concentration of plasma immunoglobulins and patterns of infections. Pediatr. Res. 1986, 20:899-904. 4. Borkowski W.M.: Problemy hematologiczne okresu noworodkowego. Neonatologia pod red. Danuty Łozińskiej i Ireny Twarowskiej, PZWL 1993. 5. Campbell J.: Neonatal Pneumonia Seminars in respiratory Infections 1996, 11(3):155-162. 6. Carr D. et al.: Neutrophil chemotaxis an adhesion in preterm babies. Arch. Dis. Child 1992, 67:813-817. 7. Chabior M.: Cellular and humoral components of neutrophil chemotaxis in neonates wit bacterial infection Mater Med. Pol., 1994, 26 (2):49-53. 8. Haeney M.: Infection determinants at extremes of age. Journal of Antimicrobial Chemotherapy 1994, 34, Suppl. A, 109. 9. Hanson L.A. et al.: Breast feeding: overwiev and breast milk immunology. Acta Paediatr. Jp. 1994, Oct 36 (5):557-61. 10. Harris D.T. et al.: Phenotypic and functional immaturity of human umbilical cord blood T lymphocytes Proc. Natl Acad Sci. USA 1992, 89:10006-10010. 11. Iwaszko-Krawczuk W.: Udział leukocytów w zjawiskach odpornościowych u noworodków. Postępy w neonatologii Tom 3 1992, Red. Irena Twarowska. Klinika Neonatologii IGiP Akademii Medycznej. 12. Jakóbisiak M.: Podstawy immunologii. Warszawska Akademia Medyczna 1992. 13. Mostov K.E.: Transepithelial transport of immunoglobulins. Annu Rev. Immunol., 1994, 12:63-84. 14. Nahmias A.J., Kourtis A.P.: The pregnant woman, placenta, fetus and infectious agents. Clinics in Perinatology 1997, Jun 24, 497-521. 15. Perez E., Weisman L.: Novel approaches to the prevention and therapy of neonatal bacterial sepsis. Clinics in Perinatology. 1997 March 24, 213-226. 16. Rosenthal J., Cairo M.S.: The role of cytokines in modulating neonatal myelopoiesis and host defense Cytokines Moi Ther 1995 Sep 1 (3) 167-176. 17. Schroten H. et al.: Inhibitor of adhesion of S-fimbriated E. coli to buccal epithelial cells by human skim milk is predominantly mediated by mucins and depends on the period of lactation. Acta Paediatr. 1993, Jan 82 (1):6-11. 18. Sievers E.L., Dale D.C.: Non-malignant neutropenia. Blood Reviews 1996, 10:95-100. 19. Smith D.J., Taubman M.A.: Emergence of immune competence in saliva. Crit. Rev. Oral Biol. Med. 1993, 4(3-4):335-341. 20. Thilaganathan B. et al.: Labor: an immunologically beneficial process for the neonate. Am. J. Obstet-Gynecol 1994 Nov 171 (5):1271-2. 21. Traczyk W.Z., Trzebski A.: Fizjologia człowieka z elementami fizjologii stosowanej i klinicznej. PZWL 1990. 22. Wolach B. et al.: Some aspects of the humoral immunity and fagocytic function in newborn infants. Isr. J. Med. Sci., 1994, 30 (5-6):331-5. 23. Wolfe M., Wandstrat T.L.: Hematopeietic growth factors. Neonatal Netw 1996, Sep 15 (6):7-11. 24. Yu J.: Regulation and reconstitution of human hematopoiesis. Formos Med. Assoc. 1996 Apr 95 (4):281-293.

