© Borgis - Anestezjologia Intensywna Terapia 2/2005, s. 82-86
Bogumiła Wołoszczuk-Gębicka
Wpływ sewofluranu na zapotrzebowanie na miwakurium podawane w ciągłym wlewie u dzieci*)
Effect of sevoflurane on mivacurium requirement in children
Klinika Anestezjologii i Intensywnej Terapii Instytutu „Pomnik-Centrum Zdrowia Dziecka” p-o.
kierownika: dr n. med. B. Wołoszczuk-Gębicka
Summary
Background. Sevoflurane, like other volatile halogenated agents, potentiates the neuromuscular block produced by mivacurium. The dose of mivacurium should therefore be reduced appropriately from that used during opioid/nitrous oxide anaesthesia. The purpose of the study was to determine the dose requirements for mivacurium, when administered by continuous infusion to maintain a stable 90-99% twitch depression in children, during N2 O/O2 -fentanyl or sevoflurane anaesthesia. Methods. Twenty-four ASA I or II children, aged 3-11 yrs, were randomly allocated to two groups to receive N2 O/O2 -fentanyl or N2 O/O2 /sevoflurane(1HAC) anaesthesia. Electromyographic response of the adductor pollicis to train-of-four stimulation, applied to the ulnar nerve, was recorded using a Relaxograph (Datex, Helsinki, Finland). A 0.2 mg kg-1 bolus dose of mivacurium was followed by a continuous infusion delivered by an infusion pump working in a closed loop system with the Relaxograph and a personal computer, programmed to maintain a stable 90-99% block. Results. The mivacurium requirement was significantly decreased in the sevoflurane group (6.5 ± 2.6 mcg kg-1 min-1), when compared with the fentanyl group (13.0 ± 6.5 mcg kg-1 min-1) (p= 0.007). There was a significant negative correlation of the mivacurium requirement with the duration of neuromuscular block after the first bolus dose of mivacurium (R2 = 0.35 for all patients, R2 = 0.52 for the fentanyl group). Discussion and conclusion. The mechanism of potentiation of neuromuscular block by volatile anaesthetic agents is not fully understood, but it is obvious and clinically significant. Since mivacurium requirement is related to serum pseudocholinesterase activity, the duration of action of the intubating dose may serve as an indicator of mivacurium requirement during anaesthesia. Due to large individual variability, monitoring of neuromuscular transmission during mivacurium infusion should be mandatory during longer procedures in children.

Miwakurium (Mivacron, GSK, Wielka Brytania) niedepolaryzujący środek zwiotczający o krótkim działaniu, stosowany jest podczas krótkich znieczuleń wymagających intubacji tchawicy lub podczas znieczuleń o nieprzewidywalnym czasie trwania. Rozkładany jest w osoczu przez pseudocholinoesterazę (PChE) [1], więc jego eliminacja zachodzi niezależnie od działania wątroby i nerek, chociaż u chorych z ciężką niewydolnością tych narządów, u których obserwuje się niższe stężenia PChE, nieco dłuższe jest działanie miwakurium [2, 3, 4].
Rozwijanie się zwiotczenia po podaniu miwakurium jest niezbyt szybkie, co powoduje, że nie jest to właściwy środek zwiotczający w przypadku konieczności szybkiej intubacji. Miwakurium, podobnie jak niektóre inne środki zwiotczające o budowie benzylizochinolonowej uwalnia histaminę, co może być przyczyną wystąpienia objawów niepożądanych; przy powolnym podawaniu środka i nieprzekraczaniu zalecanych dawek ilość uwalnianej histaminy jest niewielka [5]. W anestezjologii dziecięcej miwakurium jest często stosowane z wziewnymi środkami znieczulenia ogólnego, które istotnie nasilają jego działanie [3, 6, 7, 8, 9, 10, 11, 12]. Sewofluran nasila działanie miwakurium silniej niż halotan i izofluran [13].
Celem pracy było porównanie zapotrzebowania na miwakurium u dzieci znieczulanych N2 O/O2 i sewofluranem w porównaniu z dziećmi znieczulanymi N2 O/O2 i fentanylem.
METODYKA
Po uzyskaniu zgody Komisji Bioetycznej Instytutu „Pomnik-Centrum Zdrowia Dziecka” oraz świadomej zgody rodziców, do badań zakwalifikowano dzieci w wieku 3-11 lat, spełniających kryteria stanu fizycznego I i II stopnia wg ASA, znieczulanych do planowych operacji wymagających intubacji tchawicy i zwiotczenia mięśni. Dzieci z chorobami nerwowo-mięśniowymi, chorobliwie otyłe (z masą ciała> 97 centyla wg norm dla dzieci warszawskich), z niewydolnością wątroby lub nerek lub otrzymujące leki wpływające na przewodnictwo nerwowo-mięśniowe nie zostały włączone do badań.
Dzieci zostały losowo podzielone na dwie grupy ze względu na sposób znieczulenia. W jednej grupie znieczulenie przeprowadzono sewofluranem i podtlenkiem azotu z tlenem, w drugiej grupie podawano podtlenek azotu z tlenem i fentanyl.
Dzieci premedykowano midazolamem (Midanium, Polfa, Polska), w dawce 0,3 mg kg-1 podawanej doustnie lub, u dzieci najmłodszych, doodbytniczo.
W grupie SEWO dzieci wprowadzano wziewnie N2 O i sewofluranem w stężeniu 5-7%. Od chwili zniknięcia odruchu rzęsowego znieczulenie podtrzymywano mieszaniną N2 O/O2 (60%/40%) i sewofluranem w stężeniu 2,5% w powietrzu końcowo-wydechowym, co odpowiada wartości 1 MAC (w tlenie) dla tej grupy wieku [14]. Dzieci z grupy FENT wprowadzano tiopentalem (Thiopental, Biochemie Gmbh, Austria) w dawce 5 mg kg-1 i fentanylem (Fentanyl, Polfa W-wa, Polska) oraz N2 O/O2 (70%/30%), a znieczulenie podtrzymywane było frakcjonowanymi dawkami fentanylu 1-3 mcg kg-1 i podtlenkiem azotu z tlenem (60%/40%).
Do czasu podania środka zwiotczającego dzieci oddychały samoistnie przez maskę twarzową. Po iniekcji środka zwiotczającego i intubacji tchawicy prowadzono wentylację mechaniczną, utrzymując stężenie CO2 w granicach 35-45 mm Hg (4,67-6 kPa). Z chwilą zakończenia zabiegu przerywano podawanie sewofluranu i stosowano do oddychania 100% O2 . Po obudzeniu się dziecka i ustąpieniu zwiotczenia mięśni usuwano rurkę z tchawicy.
Monitorowano częstość akcji serca (EKG), ciśnienie tętnicze (metodą oscylometryczną), wysycenie krwi tętniczej tlenem, ciepłotę ciała odbytnicy i ręki, wykorzystywanej do monitorowania przewodnictwa nerwowo-mięśniowego oraz stężenie O2 , CO2 , N2 O i sewofluranu w gazach wdechowych i wydechowych. Dzieci ogrzewano materacem w celu utrzymania ciepłoty ciała powyżej 36,0°C, a badana ręka była dodatkowo chroniona przed utratą ciepła.
Przewodnictwo nerwowo-mięśniowe monitorowano metodą elektromiograficzną (Relaxograph, Datex, Finlandia). Po wprowadzeniu do znieczulenia unieruchamiano badaną rękę i przyklejano naskórne elektrody: stymulujące, odbiorcze i uziemiającą. Stosowano stymulację ciągiem czterech pobudzeń ( train-of-four – TOF, 2 Hz przez 2 s), powtarzanym co 20 sekund. Dla uzyskania lepszej stabilizacji zapisu elektromiograficznego stymulacja prowadzona była co najmniej przez 10 minut przed podaniem środka zwiotczającego [15].
Po ustabilizowaniu się zapisu elektromiograficznego podawano dożylnie 0,2 mg kg-1 miwakurium i intubowano tchawicę. W chwili samoistnego powrotu pierwszej odpowiedzi na pierwsze pobudzenie ciągu czterech (T1 ) do 5% wartości kontrolnej włączano wlew miwakurium z początkową szybkością 10 mcg kg-1 min-1. Szybkość wlewu była następnie tak dobierana przez komputer pracujący w pętli sprzężenia zwrotnego z monitorem przewodnictwa i pompą infuzyjną, aby utrzymać T1 w zakresie 1-10% [16, 17]. Blok przewodnictwa nerwowo-mięśniowego uznawano za stabilny, gdy T1 zmieniało się w ciągu 10 minut nie więcej niż o 2% przy niezmiennej szybkości wlewu (ryc. 1). Dane opisujące przewodnictwo nerwowo-mięśniowe (T1 i TR) zapisywano w postaci pliku komputerowego kompatybilnego z plikiem programu MS Excel.
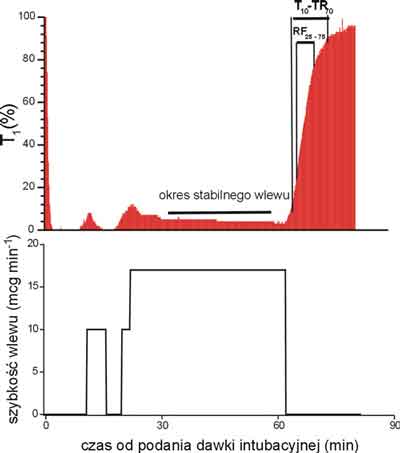
Ryc. 1. Przykład stabilizacji bloku przewodnictwa nerwowo-mięśniowego pod wpływem miwakurium podawanego w ciągłym wlewie u 5-letniego chłopca znieczulonego N2 O/O2 i fentanylem. Górna część ryciny przedstawia przewodnictwo nerwowo-mięśniowe, dolna – szybkość podawania miwakurium przez pompę infuzyjną sterowaną przez komputer pracujący w układzie sprzężenia zwrotnego z monitorem przewodnictwa nerwowo-mięśniowego.
Wszystkie dane liczbowe podane zostały w postaci średniej±SD oraz zakresu obserwowanych wartości. Wyniki w grupie SEWO i FENT porów-nano za pomocą testu t-Studenta, posługując się pakietem STATISTICA, wersja 5,0, (StatSoft, Tulsa, Oklahoma, USA). Korelację pomiędzy poszczególnymi parametrami obliczono za pomocą tego samego pakietu.
WYNIKI
Badaniami objęto łącznie 24 dzieci: 12 w grupie SEWO i 12 w grupie FENT. U żadnego nie obserwowano objawów ubocznych związanych z uwalnianiem histaminy.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Cook DR, Stiller RL, Weakly J, Chakravorti S, Brandom BW, Welch RM: In vitro metabolism of mivacurium chloride (BW B1090U) and succinylcholine. Anesth Analg 1989; 68: 452-456.
2. Head-Rapson AG, Devlin JC, Parker CJ, Hunter JM: Pharmacokinetics and pharmacodynamics of the three isomers of mivacurium in health, in end-stage renal failure and in patients with impaired renal function. Br J Anaesth 1995; 75: 31-66.
3. Head-Rapson AG, Devlin JC, Parker CJ, Hunter JM: Pharmacokinetics of the three isomers of mivacurium and pharmacodynamics of the chiral mixture in hepatic cirrhosis. Br J Anaesth 1994; 73: 613-618.
4. Head-Rapson AG, Parker CJ, Hunter JM: Pharmaco-dynamics of mivacurium chloride in patients with hepatic cirrhosis. Br J Anaesth 1993; 71: 227-231.
5. Harbut P, Stadtmüller-Bielawska B, Wysoczańska-Harbut J, Kübler A: Kliniczne zastosowanie miwakurium. Anest Inten Terap 1996; 28: 3-7.
6. Sarner JB, Brandom BW, Woelfel SK, Dong ML, Horn MC, Cook DR, McNulty BF, Foster VJ: Clinical pharmacology of mivacurium chloride (BW B1090U) in children during nitrous oxide – halothane and nitrous oxide – narcotic anesthesia. Anesth Analg 1989; 68: 116-121.
7. Brandom BW, Sarner JB, Woelfel SK, Dong ML, Horn MC, Borland LM, Cook DR, Foster VJ, McNulty BF, Weakly JN: Mivacurium infusion requirements in pediatric surgical patients during nitrous oxide – halothane and during nitrous oxide – narcotic anesthesia. Anesth Analg 1990; 71: 16-22.
8. Kaplan RF, Garcia M, Hannallah RS: Mivacurium induced blockade during sevoflurane and halothane anaesthesia in children. Can J Anaesth 1995; 42: 16-20.
9. Wulf H. Hauschild S, Proppe D, Ledowski T: Augmentation of neuromuscular blocking effect of mivacurium by desflurane, sevoflurane, isoflurane in comparison with TIVA. Anesth Rean 1998; 23: 88-92.
10. Neidhart G, Pabelick C, Kuhn I, Leuwer M, Vettermann J: Effects of halothane, enflurane and isoflurane on pharmaco-dynamics of mivacurium in children. Anesthesiology 1996; 31: 293-297.
11. Bevan JC, Reimer EJ, Smith MF, deV. Scheppers L, Bridge HS, Martin GD, Bevan DR: Decreased mivacurium require-ment and delayed neuromuscular recovery during sevoflurane anesthesia in children and adults. Anesth Analg 1998; 87: 772-777.
12. Lowry DW, Mirakhur RK, Caroll M, McCarthy GJ, Hudges DA, O´Kare RA: Potency and time-course of mivacurium during sevoflurane, isoflurane and intravenous anaesthesia. Can J Anaesth 1999; 46: 29-33.
13. Wołoszczuk-Gębicka B: Mivacurium infusion and sponta-neous recovery of neuromuscular transmission in children anaesthetized with nitrous oxide and fentanyl, halothane, isoflurane or sevoflurane. Paed Anaest 2002; 12: 511-518.
14. Katoh T, Ikeda K: Minimum alveolar concentration of sevoflurane in children. Br J Anaesth 1992; 68: 139-141.
15. Viby-Mogensen J, Engbaek J, Eriksson LI, Gramstad I, Jensen E, Jensen FS, Kościelniak-Nielsen Z, Skovgaard LT, Řstergaard D: Good Clinical Research Practice (GCRP) in pharmacodynamic studies of neuromuscular blocking agents. Acta Anesthesiol Scand 1996; 40: 59-74.
16. Wołoszczuk-Gębicka B, Łapczyński T: An algorithm of computerized administration of muscle relaxants. Int J Art Org 1996; 19: 205.
17. Wołoszczuk-Gębicka B, Łapczyński T, Szreter T: A computerized method of the administration of muscle relaxants. Int J Art Org 1996; 19: 216.
18. Meretoja OA, Wirtavuori K, Taivainen T, Olkkola KT: Time course of potentiation of mivacurium by halothane and isoflurane in children. Br J Anaesth 1996; 76: 235-238.
19. Lejus C, Delacroche O, Legendre E, Rivault O, Renaudin M, Pinaud M: Does sevoflurane inhibit serum cholinesterase in children? Anaesthesia 2002; 57: 44-48.
20. Brandom BW, Meretoja OA, Simhi E, Taivanen T, Woelfel SK, Gronert BJ, Cook DR: Age-related variability in the effects of mivacurium in paediatric surgical patients. Can J Anaesth 1998; 45: 410- 416.
21. Lien CA, Belmont MR, Abalos A, Hass D, Savarese JJ: The nature of spontaneous recovery from mivacurium-induced neuromuscular block. Anesth Analg 1999; 88: 648-653.

