© Borgis - Postępy Nauk Medycznych 7/2010, s. 520-523
*Tadeusz Dębniak, Jan Lubiński
Inheritance and genetics of human malignancies
Zasady dziedziczenia predyspozycji do nowotworów
International Hereditary Cancer Center, Department of Genetics and Pathology, Pomeranian Medical University, Szczecin, Poland
Head of Department of Genetics and Pathology: prof. zw. dr hab. med. Jan Lubiński
Streszczenie
Nowotwory złośliwe powstają w wyniku genetycznie uwarunkowanej predyspozycji oraz, w różnym stopniu, wpływu czynników środowiskowych. Czynniki genetyczne są odpowiedzialne za predyspozycję jednogenową oraz wielogenową, „wysoką” oraz „umiarkowaną”. Szacuje się, że około 30% wszystkich nowotworów powstaje w wyniku wysokiej, genetycznie uwarunkowanej predyspozycji. W zależności od rodzaju uszkodzeń i miejsca uszkodzenia DNA różny jest typ dziedziczenia oraz charakterystyka rodowodowo-kliniczna. Rodowodowo dziedziczenie jednogenowe autosomalne dominujące na ogół charakteryzuje występowanie zachorowań w każdym kolejnym pokoleniu (pionowa transmisja), zarówno u mężczyzn jak i u kobiet; u blisko 50% krewnych. W tym typie chorób genetycznych mutacje konstytucyjne (tj. obecne we wszystkich komórkach organizmu) w pojedynczym genie są główną przyczyną zachorowania. Oceniając rodowód rodziny obciążonej nowotworami należy również pamiętać o tzw. fenokopiach – pojawianiu się przypadkowych, niezwiązanych z nosicielstwem danej mutacji zachorowań na nowotwory w rodzinie. W przypadku wielogenowej predyspozycji na nowotwory zachorowuje zwykle tylko pojedyncza osoba w rodzinie. Wielogenowa predyspozycja do nowotworów może być związana z wysokim lub umiarkowanie zwiększonym ryzykiem zachorowania. Wydaje się, że uszkodzenia DNA umiarkowanie zmieniające ryzyko zachorowania odpowiadają głównie za mało nasilone rodzinne agregacje zachorowań. Taki patomechanizm może mieć ważne znaczenie kliniczne, bowiem słaba rodzinna agregacja nowotworów jest częsta. Współdziałanie „słabych” mutacji i polimorfizmów w wielu genach oraz dodatkowo wpływ czynników środowiskowych może znacząco zwiększać ryzyko nowotworów złośliwych różnych narządów.
Summary
Human cancers are caused by genetic and environmental factors. Genetic susceptibility can be divided into monogenic and polygenic predisposition; the risk of cancer development can be defined as "high” or "moderate”. It is estimated that around 30% of all malignancies are caused by "high-risk” genetic predisposition. Depending on the position and type of DNA changes the pattern of inheritance as well as clinical and pedigree characteristics may be different. Pedigrees of monogenic diseases with autosomal dominant inheritance are characterised by occurrence of disorder in all generations (vertical transmission), among men and women, among 50% of the relatives. Such diseases are caused by constitutional mutations of single genes, present in all cells of the body. Evaluation of the pedigree and clinical data of families with aggregations of cancers should exclude phenocopies (accidental malignancy not related to mutation responsible for the aggregation of malignant tumors). In polygenic type of inheritance single individuals can be affected. DNA alterations associated with "moderate” risk are responsible for moderate cancer familial aggregations. Such patomechanism may have significant clinical impact, since moderate cancer familial aggregations are frequent. Associations of "weak” mutations and polymorphisms of many genes and additional influence of environmental factors can significantly increase the risk of cancer development.

It is estimated that around 30% of all malignancies are caused by "high-risk” genetic predisposition (1). This hypothesis is supported by results of studies performed on monozygotic twins. If one of them is affected with prostate or breast cancer, the risk od the same disease diagnosed in second twin is 40 or 30% (2). This concordance among twins is even higher when cancers of different site of origin are included- f.e. breast cancer in one person, stomach cancer in the sibling.
Genetic susceptibility can be divided into monogenic and polygenic predisposition; the risk of cancer development can be defined as "high” or "moderate”.
MONOGENIC PREDISPOSITION TO CANCERS
In this type of susceptibility diseases are caused by constitutional mutations of single genes, present in all cells of the body. Mutations of genes are present in all human malignancies. However, in majority of cases somatic mutations are detected, which are present in malignant tissues only. To date clinical genetics of malignancies focued on optimalisation of medical care is based mainly upon diagnosis of monogenic disorders, characterized by autosomal dominant type of inheritance.
According to Mendel"s model of inheritance each individual has two copies (alleles) of gene, responsible for a specific feature or disease, localized in the same position (locus) on homologous chromosomes. Each child inherits one allele from the father, the second one from the mother. In autosomal dominant type of inheritance an inborn mutation of a single allele leads to tumorigenesis (3). This principle is true in case of proto-oncogenes, like RET gene, when its constitutional mutatios predispose to MEN2 syndrome. In majority of cancer patients mutations of tumor-suppresor genes (anti-oncogenes, like p53) or DNA-repair genes (like MSH2) are detected. On the molecular level these genes are recessive, carriers of mutations are affected with disease as the result of secondary mutation, appearing during the life of the carrier, leading to inactivation of the second allele (4).
Pedigrees of monogenic diseases with autosomal dominant inheritance are characterised by occurrence of disorder:
a) in all generations (vertical transmission);
b) among men and women;
c) among almost 50% of the relatives (5).
The example of such pedigree is presented on figure 1. In this family anticipation can be observed- in each consecutive generation younger age of disease onset.
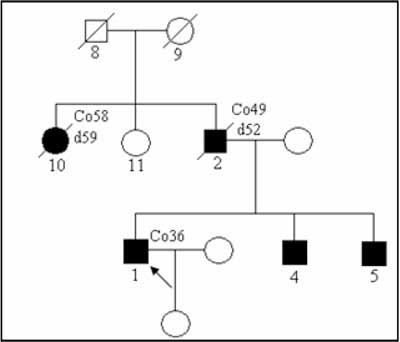
Fig. 1. The Lynch syndrome family – autosomal dominant type of inheritance.
Characteristic features of monogenic dominant type of inheritance are not observed in cases of:
a) germline (in sex cells) mutations de novo – ancestors of the proband (individual seeking genetic counseling) have not been affected, mutation is transmitted to descendants – figure 2;
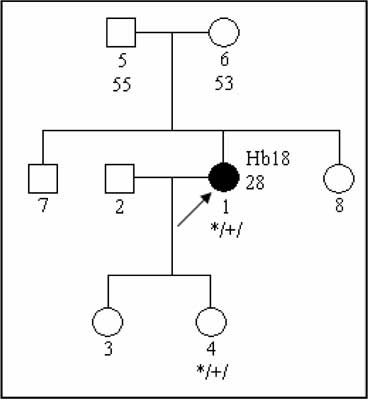
Fig. 2. Pedigree of the family with a disease caused by de-novo VHL mutation.
b) mosaic mutations, which are present in some tissues. Such mutations arise de novo in the embryo, single individuals are usually affected, mutations are transmitted to next generations only if ther are present in the sex cells;
c) low-penetrant mutations; penetration is defined as the proportion of mutation carriers affected with a malignancy. In many genetic syndromes it can reach 0.8-0.9, in families with lower mutation penetration only a single individuals are affected (6); the example of such pedigree is presented on figure 3;
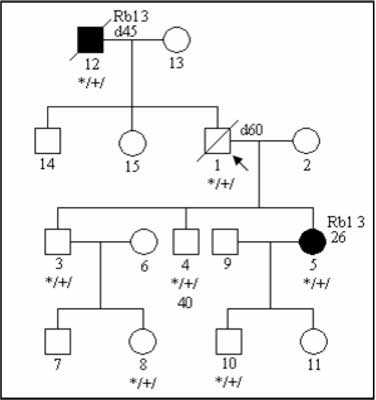
Fig. 3. Pedigree of the family with low-penetrant RB1 mutation.
d) mutations which lead to a disease affecting one gender only; f.e. both men and women carry BRCA1 mutations, however ovarian cancer will occur only among female carriers
e) "small” families- with a few relatives.
Evaluation of pedigree of the cancer-prone family should include "phenocopy” consideration- occurrence of the accidental cancers in the family, independent of the presence or absence of particular cancer-susceptibility gene mutations (7). An example of a pedigree with 4 breast cancers caused by germline BRCA1 mutation and one breast cancer in a female without BRCA1 alteration. Ancestors of the proband do not have increased cancer risk caused by BRCA1 mutation.
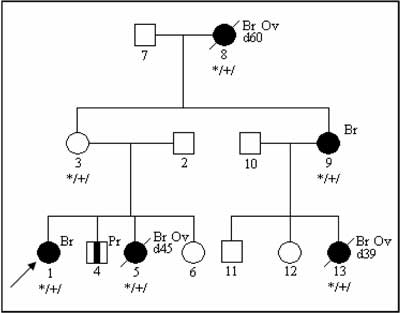
Fig. 4. Phenocopy – breast cancer in a non-carrier of BRCA1 mutation.
Abbreviations used on figures 1-4:
Co36 – colorectal cancer diagnosed at 36
d52 – died at age 52
Rb1 3 – retinoblastoma diagnosed at 3rd year of life
Hb – hemangioblastoma
Ov – ovarian cancer
Pr – prostate cancer
*/+/ – individual carrying constitutional mutation
*/-/ – individual carrying wild typej
Polygenic type of inheritance
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Lynch HT, Fusaro RM, Lynch J: Hereditary cancer in adults. Cancer Detect Prev 1995; 19: 219-33.
2. Lichtenstein P, De Faire U, Floderus B et al.: The Swedish Twin Registry: a unique resource for clinical, epidemiological and genetic studies. J Intern Med 2002; 252: 184-205.
3. Knudson A: Mutation and cancer: a statistical study. Prc Natl Acad Sci USA 1971; 68: 820-3.
4. Friedman JM: Genetics and epidemiology, congenital anomalies and cancer. Am J Hum Genet 1997; 60: 469-73.
5. Marra G, Boland CR: Hereditary nonpolyposis colorectal cancer the syndrome, the genes, historical perspectives. J Natl Cancer Inst 1995; 87: 1114-24.
6. Lubiński J: Hereditary tumors. prophylactics, early diagnosis, treatment. Biotechnologia 1996; 35: 202-7.
7. Friedman JM, Dill FJ, Hayyden MR et al.: Genetyka, wydanie I polskie pod redakcją J. Limona. Elsevier Urban & Partner, Wrocław 2000.
8. Lubinski J, Korzeń M, Górski B et al.: Genetic contribution to all cancers: the first demonstration using the model of breast cancers from Poland stratified by age at diagnosis and tumour pathology, Breast Cancer Res Treat 2008.
9. Cybulski C, Gliniewicz B, Sikorski A et al.: Epistatic relationship between the cancer susceptibility genes CHEK2 and p27. Cancer Epidemiol Biomarkers Prev 2007; 16: 572-6.
10. Serrano-Fernández P, Debniak T, Górski B et al.: Synergistic interaction of variants in CHEK2 and BRCA2 on breast cancer risk. Breast Cancer Res Treat 2009 Sep; 117 (1): 161-5.




