© Borgis - Postępy Fitoterapii 3/2011, s. 169-174
*Adam Klimowicz1, Małgorzata Jeziorna1, Anna Nowak1, Stanisława Bielecka-Grzela2
Wpływ wybranych roślin leczniczych na aktywność glikoproteiny P
The influence of certain herbs on p-glycoprotein activity
1Samodzielna Pracownia Farmakoterapii Dermatologicznej Katedry Chorób Skórnych i Wenerycznych Pomorskiego Uniwersytetu Medycznego w Szczecinie
Kierownik Pracowni: prof. dr hab. Adam Klimowicz
2Samodzielna Pracownia Dermatologii Estetycznej Katedry Chorób Skórnych i Wenerycznych Pomorskiego Uniwersytetu Medycznego w Szczecinie
Kierownik Pracowni: dr hab. Stanisława Bielecka-Grzela, prof. PUM
Summary
Adenosine-triphosphate (ATP)-binding cassette (ABC) superfamily is a great group of transporters localised inside cell membrane. They translocate a great variety of cationic, hydrophobic and amphoteric compounds, including drugs, out of the cells, at the expense of ATP hydrolysis. Up to now about 50 proteins belonging to this family, has been identified, from which P-glycoprotein (P-gp) seems to be one of the most important transporters. By regulation of transmembrane efflux it plays a crucial role in cell protecting from accumulation of exogenic as well as endogenic toxic compounds. A lot of drugs, differing in chemical structure and pharmacological properties as well, are the subjects for P-gp. Except drugs, a couple of other substances, including food components, herbal products, diet supplements or ingredients of frequently applied spices, can influence of P-gp activity drug concentration. These compounds can decrease or increase drug concentration and then can influence on therapeutic effect as well as can induce side-effects in certain cases. For instance, the influence of grapefruit as well as orange juice on the pharmacokinetics of some therapeutics is well-known example. In the paper the impact on P-gp activity of certain plants ingested as food components or as OTC herbal products is presented. Due to the content of compounds active against P-gp, the following herbals: St John’s wort, Curcuma longa, black pepper and long pepper, milk thistle, hot red pepper, Ginkgo biloba and/or green tea should be taken into consideration. In certain cases they can interact unfavourable with some drugs administered at the same time.

Rodzina białek ABC (ATP – binding cassette) stanowi dużą grupę transporterów zlokalizowanych w obrębie błony komórkowej. Wykorzystują one energię uzyskiwaną z hydrolizy ATP do transportu rozmaitych substancji kationowych, hydrofobowych i amfoterycznych, w tym również leków (1). Dotychczas zidentyfikowano blisko 50 białek należących do tej rodziny, z których najistotniejszym oraz najlepiej poznanym jest glikoproteina P (P-gp). Została ona odkryta w 1976 roku przez Juliano i Linga (2) w komórkach jajnika chomika chińskiego. Białko to o masie cząsteczkowej 170 kDa transportuje substraty z zewnętrznej i wewnętrznej warstwy błony komórkowej, w wyniku czego następuje zmniejszenie ich stężenia cytoplazmatycznego. Poprzez regulację transportu przezbłonowego, P-gp chroni komórki zarówno przed egzogennymi, jak i endogennymi substancjami toksycznymi. Jej stężenie jest zwykle wysokie w błonie komórkowej komórek nowotworowych, gdzie odpowiada ona za zjawisko oporności wielolekowej (MDR – multidrug resistance), usuwając lipofilne leki na zewnątrz komórki (3, 4). Białko to występuje również w komórkach nabłonka przewodu pokarmowego, w kanalikach nerkowych i żółciowych, w jądrach, w komórkach śródbłonka bariery krew-mózg, w nadnerczach oraz w limfocytach B, T, komórkach NK. W roku 2008 badacze japońscy Ito i wsp. (5) opublikowali artykuł opisujący udział tego białka w transporcie leków w skórze.
Glikoproteina P wpływa na absorpcję ksenobiotyków w jelitach, w niektórych przypadkach ogranicza biodostępność leków doustnych, ułatwiając ich wydalanie przez błonę śluzową jelita, nerki oraz z żółcią (6). Białko to wpływa na wchłanianie leków w przewodzie pokarmowym, ich zwrotne wydzielanie do światła jelita. Odgrywa znaczącą rolę w dystrybucji leków w organizmie, w transporcie ksenobiotyków do komórek docelowych oraz w regulacji ich metabolizmu wątrobowego. Substratami P-gp jest wiele leków, często o odmiennej budowie i właściwościach farmakologicznych. Należą do nich między innymi leki immunosupresyjne (cyklosporyna A, takrolimus), glikokortykosteroidy (kortyzol, kortykosteron, deksametazon), leki przeciwpadaczkowe (fenytoina), glikozydy nasercowe (digoksyna), antybiotyki makrolidowe, azolowe leki przeciwgrzybicze, beta-adrenolityki i inne (7). Wiele substancji jest równocześnie inhibitorami lub induktorami tego białka. Induktorami są między innymi deksametazon, fenobarbital, rifampicyna, natomiast inhibitorami werapamil, erytromycyna czy ketokonazol (8).
Obok leków na aktywność P-gp może wpływać również wiele innych substancji, w tym pokarmy, preparaty ziołowe, suplementy diety, czy składniki powszechnie stosowanych przypraw. Ziołolecznictwo, przyjmowanie preparatów witaminowych oraz różnorodnych suplementów diety staje się coraz powszechniejsze wśród współczesnego społeczeństwa, często pomimo braku naukowych dowodów skuteczności. Szacuje się, iż ponad 1/3 mieszkańców krajów rozwiniętych oraz ponad 80% mieszkańców krajów rozwijających się stosuje preparaty ziołowe w celu poprawy kondycji zdrowotnej oraz leczenia wielu powszechnych chorób (9). W przypadku preparatów ziołowych oraz suplementów diety często nie wyjaśniony pozostaje mechanizm ich działania, jak również brak informacji dotyczących potencjalnych działań niepożądanych oraz interakcji. Panująca powszechnie opinia, iż są to substancje nieszkodliwe, prowadzi do równoczesnego przyjmowania tych preparatów z tradycyjnym leczeniem farmakologicznym. Taki sposób postępowania może być przyczyną interakcji, często o istotnym znaczeniu klinicznym. Powyższe działania niepożądane mogą być szczególnie ważne w przypadku leków o wąskim zakresie terapeutycznym (10).
Obok preparatów ziołowych, na aktywność enzymów metabolizujących leki mogą wpływać również niektóre pokarmy oraz stosowane w dużych ilościach przyprawy. Istnieje również szereg innych środków spożywczych wpływających na P-gp, która, jak wspomniano wcześniej, bierze udział we wchłanianiu, metabolizmie, dystrybucji oraz wydalaniu leków. Substancje te mogą zmniejszać lub zwiększać stężenie leków, a tym samym wpływać na efekt terapeutyczny oraz powodować szereg działań niepożądanych. Najbardziej znanym przykładem jest sok grejpfrutowy i pomarańczowy, których powtarzająca się konsumpcja może mieć wpływ na farmakokinetykę, prowadząc do kumulacji różnych substancji, także wykazujących działanie farmakologiczne (11, 12).
Dziurawiec (Hypericum perforatum)
Jednym z najlepiej poznanych surowców zielarskich wpływających na aktywność P-gp jest ziele dziurawca (Hypericum perforatum L.) należące do rodziny dziurawcowatych (Hipericaceae). Roślina ta zawiera w swoim składzie kilkadziesiąt cennych składników, wśród których można wymienić flawonoidy, pochodne floroglucyny oraz naftodiantrony (13). Do głównych flawonoidów zaliczamy hiperozyd, naftodiantronów – hiperycynę i pseudohiperycynę, zaś do pochodnych floroglucyny – hiperforynę. Wyciąg z dziurawca jest substancją o udowodnionej skuteczności w leczeniu depresji, hamującą wychwyt zwrotny neurotransmiterów, takich jak serotonina, norepinefryna i dopamina (14, 15). Działanie antydepresyjne jest przypisywane głównie hiperforynie (ryc. 1) oraz w mniejszym stopniu hiperycynie (ryc. 2) (16).
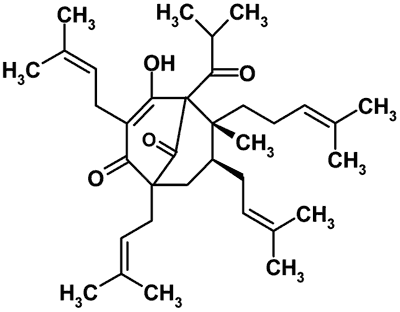
Ryc. 1. Wzór chemiczny hiperforyny.
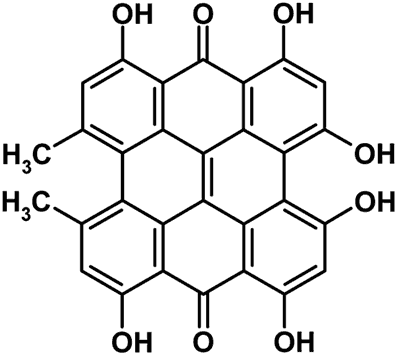
Ryc. 2. Wzór chemiczny hiperycyny.
Ziele dziurawca zwiększa aktywność zarówno enzymów cytochromu P450, jak i glikoproteiny P poprzez aktywację PXR (pregnane-X-receptor) (17). Receptor PXR kontroluje transkrypcję genów kodujących P-gp (MDR1) oraz enzymy cytochromu P450. Jednoczesne stosowanie wyciągu z tego ziela oraz leków metabolizowanych przez enzymy CYP 3A4 cytochromu P450, jak również substratów dla P-gp, może doprowadzić do znaczącego zmniejszenia stężenia tych leków. Doustne przyjmowanie preparatów dziurawca przez 14 dni powodowało u zdrowych ochotników 1,4-krotne zwiększenie ekspresji P-gp (18). Do leków, których biodostępność może ulec zmniejszeniu podczas jednoczesnego przyjmowania z produktami zawierającymi Hypericum perforatum, należą między innymi alprazolam, amitryptylina, cyklosporyna, digoksyna, erytromycyna, feksofenadyna, talinolol, takrolimus, simwastatyna, werapamil oraz warfaryna (19, 20, 21).
Przewlekłe zażywanie ziela dziurawca wraz z cyklosporyną A prowadzi do znaczącego obniżenia stężenia tego leku w osoczu, a tym samym zwiększa ryzyko odrzucenia przeszczepu u pacjentów po transplantacji (22). Okazuje się, iż działanie dziurawca na P-gp może być różne w zależności od podanej jego ilości. Podanie pojedynczej dawki (900 mg) tego ziela wraz z popularnym lekiem przeciwhistaminowym feksofenadyną spowodowało zwiększenie Cmax tego leku o około 45%, natomiast przewlekłe przyjmowanie obu tych substancji przez 14 dni obniżało stężenie feksofenadyny o 35% (23).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Kaczmarski M, Kurzawski M, Droździk M. Transportery leków. Probl Ter Monitor 2008; 19:49-58. 2. Marchetti S, Mazanti R, Beijnen JH i wsp. Clinical relevance of drug-drug and herb-drug interactions mediated by the ABC transporter ABCB1 (MDR1, P-glycoprotein). Oncologist 2007; 12:927-41. 3. Tan-don VR, Kapoor B, Bano G i wsp. P-glycoprotein: pharmacological relevance. Indian J Pharmacol 2006; 38:13-24. 4. Zhou S, Lim LY, Chowbay B. Herbal modulation of P-glycoprotein. Drug Metab Rev 2004; 36:57-104. 5. Ito K, Nguyen HT, Kato Y i wsp. P-glycoprotein is involved in absorptive drug transport in skin. J Control Rel 2008; 131:198-204. 6. Jakoniuk D. Rola transportu błonowego w zjawisku odporności wielolekowej. Post Biol Kom 2004; 31:703-15. 7. Droździk M, Droździk A, Myśliwiec K. Rola glikoproteiny P (gp-170) w transporcie leków. Farm Pol 2003; 59:115-8. 8. Jeziorna M, Klimowicz A, Bielecka-Grzela S. Wpływ glikoproteiny P oraz wybranych izoenzymów cytochromu P-450 na azolowe leki przeciwgrzybiczne. Post Dermatol Alergol 2009; 26:533-8. 9. Zhou SF, Zhou ZU, Li C i wsp. Identification of drugs that interact with herbs in drug development. Drug Discov Today 2007; 12:664-73. 10. Yang XX, Hu ZP, Duan W i wsp. Drug-herb interactions: Elimination toxicity with hard drug design. Curr Pharm Design 2006; 12:4649-64. 11. Saito M, Hirata-Koizumi M, Matsumoto M i wsp. Undesirable effects of citrus juice on the pharmacokinetics of drugs. Focus on recent studies. Drug Safety 2005; 28:677-94. 12. Yin OQP, Gallagher N, Li A i wsp. Effect of grapefruit juice on the pharmacokinetics of nilotinib in healthy participants. J Clin Pharmacol 2010; 50:188-94. 13. Obach RS. Inhibition of human cytochrome P450 enzymes by constituents of St. John?s wort, an herbal preparation used in treatment of depression. J Pharmacol Exp Ther 2000; 294:88-95. 14. Bilia AR, Gallori S, Vincieri FF. St. John?s wort and depression: efficacy, safety and tolerability – an update. Life Sci 2002; 70:3077-96. 15. Calapai G, Crupi A, Firenzuoli F i wsp. Serotonin, norepinephrine and dopamine involvement in the antidepressant action of Hypericum perforatum. Pharmacopsych 2001; 34:45-9. 16. Wurglies M, Schubert-Zsilarecz M: Hypericum perforatum. A ‘modern’ herbal antidepressant. Pharmacokinetics of active ingredients. Clin Pharmacokinet 2006; 45:449-68. 17. Moore LB, Goodwin B, Jones SA i wsp. St John’s wort induces hepatic drug metabolism through activation of the pregnane X receptor. Proc Natl Acad Sci USA 2000; 97:7500-2. 18. Dürr D, Stieger B, Kullak-Ublick GA i wsp. St John’s wort induces intestinal P-glycoprotein/MDR1 and intestinal and hepatic CYP3A4. Clin Pharmacol Ther 2000; 68:598-604. 19. Nuggehally R. Herbal drug usage with modern medicine 1: Case study of an enzyme inducer St John’s wort – some perspectives. Int J Green Pharm 2008; 2:188-93. 20. Di YM, Li CG, Xue CC i wsp. Clinical drugs that interact with St John’s wort and implication in drug development. Pharm Res 2008; 14: 1723-42. 21. Zhou SF, Lai X. An update on clinical drug interactions with the herbal antidepressant St John’s wort. Curr Drug Metab 2008; 9:394-409. 22. Bauer S, Stormer E, Johne A i wsp. Alterations in cyclosporin A pharmacokinetics and metabolism during treatment with St John’s wort in renal transplant patients. Br J Pharmacol 2003; 55:203-11. 23. Wang Z, Hamman MA, Huang SM i wsp. Effect of St John’s wort on the pharmacokinetics of fexofenadine. Clin Pharmacol Ther 2002; 71:414-20. 24. Rengelshausen J, Banfied M, Riedel KD i wsp. Opposite effects of short-term and long-term St John’s wort intake on voriconazole pharmacokinetics. Clin Pharmacol Ther 2005; 78:25-33. 25. Wolanin K, Piwocka K. Kurkumina – od medycyny naturalnej do kliniki. Kosmos 2008; 57:53-65. 26. Lamer-Zarawska E, Niedworok J. Fitoterapia chorób wątroby i dróg żółciowych. W: Fitoterapia i leki roślinne.(red. E Lamer-Zarawska i wsp.). Wyd. Lek PZWL. Warszawa 2007; 348-56. 27. Romiti N, Tongiani R, Cervelli F i wsp. Effects of curcumin on P-glycoprotein in primary cultures of rat hepatocytes. Life Sci 1998; 62:2349-58. 28. Ammon HP. Pharmacology of Curcuma longa. Planta Med 1991; 57:1-7. 29. Kunchandy E, Rao MNA. Oxygen radical scavenging activity of curcumin. Int J Pharm 1990; 58:237-40. 30. Xia Y, Jin L, Zhang B i wsp. The potention of curcumin on insulin-like growth factor-1 action in MCF-7 human breast carcinoma cells. Life Sci 2007; 80:2161-9. 31. Anuchapreeda S, Leechanachai P, Smith MM i wsp. Modulation of P-glycoprotein expression and function by curcumin in multidrug-resistant human KB cells. Biochem Pharmacol 2002; 64:573-82. 32. Bajad S, Bedi KL, Singla AK i wsp. Antidiarrhoeal activity of piperine in mice. Planta Med 2001; 67:284-7. 33. Lin Z, Hoult JR, Bennett DC i wsp. Stimulation of mouse melanocyte proliferation by Piper nigrum fruit extract and its main alkaloid, piperine. Planta Med 1999; 65:600-3. 34. Aher S, Biradar S, Gopu L i wsp. Novel pepper extract for enhanced P-glycoprotein inhibition. J Pharm Pharmacol 2009; 61:1179-86. 35. Bhardwaj RK, Glaeser H, Becquemont L i wsp. Piperine, a major constituent of black pepper inhibits human P-glycoprotein and CYP 3A4. J Pharmacol Exp Ther 2002; 302: 645-50. 36. Zutshi RK Singh R, Zutshi U i wsp. Influence of piperine on rifampicin blood levels in patients of pulmonary tuberculosis. J Assoc Physicians India 1985; 33:223-4. 37. Velpandian T, Jasuja R, Bhardwaj RK i wsp. Piperine in food: interference in the pharmacokinetics of phenytoin. Eur J Drug Metab Pharmacokinet 2001; 26:241-7. 38. Jensen-Jarolim E, Gajdzik L, Haberl I i wsp. Hot spices influence permeability of hu-man intestinal epithelial monolayers. J Nutr 1998; 128:577-81. 39. Han Y, Tan TMC, Lim LY. In vitro and in vivo evaluation of the effects of piperine on P-gp function and expression. Toxicol Appl Pharmacol 2008; 230: 283-9. 40. Wu JW, Lin LC, Tsai TH. Drug-drug interactions of sylimarin on the perspective of pharmacokinetics. J Ethnopharmacol 2009; 121:185-93. 41. Pradhan SC, Girish C. Hepatoprotective herbal drug, sylimarin from experimental pharmacology to clinical medicine. Indian J Med Res 2006; 124:491-504. 42. Zhang S, Morris ME. Effects of the flavonoids biochanin A and sylimarin on P-glycoprotein mediated transport of digoxin and vinblastine in human intestinal Caco-2 cells. Pharm Res 2003; 20:1184-91. 43. Pisticelli S, Formentini E, Burstein AH i wsp. Effects of milk thistle on the pharmacokinetics of indinavir in healthy volunteers. Pharmacotherapy 2002; 22:551-6. 44. Gurley BJ, Barone GW, Williams DK i wsp. Effect of milk thistle (Sylibum marianum) and black cohosh (Cimicifuga racemosa) supplementation on digoxin pharmacokinetics in humans. Drug Metab Dispos 2006; 34:69-74. 45. Park KK, Surh YJ. Effects of capsaicin on chemically-induced two-stage mouse skin carcinogenesis. Cancer Lett 1997; 114:183-4. 46. Han Y, Tan TM, Lim LY. Effect of capsaicin on P-gp function and expression in Caco-2 cells. Biochem Pharmacol 2006; 71:1727-34. 47. Jad-czak D, Grzeszczuk M. Papryka ostra – cenna roślina przyprawowa i lecznicza. Panacea 2009; 3:14-6. 48. Imatake K, Matsui T, Moriyama M. The effect and mechanisms of action of capsaicin on gastric acid output. J Gastroenterol 2009; 44:396-404. 49. Pal D, Mitra AK. MDR- and CYP 3A4-mediated drug-herbal interactions. Life Sci 2006; 78:2131-45. 50. Hellum BH, Nilsen OG. In vitro inhibition of CYP 3A4 metabolism and P-glycoprotein mediated transport by trade herbal products. Basic Clin Pharmacol Toxicol 2008; 102:466-75. 51. Yang CY, Chao PD, Hou YC i wsp. Marked decrease of cyclosporine bioavailability caused by coadministration of ginkgo and onion in rats. Food Chem Toxicol 2006; 44:1572-8. 52. Li L, Stanton JD, Tolson AH i wsp. Bioactive terpenoids and flavonoids from Ginkgo biloba extract induce the expression of hepatic drug-metabolizing enzymes through pregnane X-receptor, constitutive androstane receptor, and aryl hydrocarbon receptor-mediated pathways. Pharm Res 2009; 26:872-82. 53. Fan L, Tao GY, Wang G i wsp. Effects of Ginkgo biloba extract ingestion on the pharmacokinetics of talindolol in healthy Chinese volunteers. Ann Pharmacother 2009; 43: 944-9. 54. Huo C, Wan SB, Lam WH i wsp. The challenge of developing green tea polyphenols as therapeutic agents. Immunopharmacol 2008; 16:248-52. 55. Fernández PL, López A, Pablos F i wsp. The use of catechins and purine alkaloids as descriptors for the differen-tation of tea beverages. Microchim Acta 2003; 142:79-84. 56. Hilal Y, Engelhardt U. Characterization of white tea – comparison to green and black tea. J Verbr Lebensm 2007; 2:414-21. 57. Brown MD. Green tea (Camellia sinensis) extract and its possible role in the prevention of cancer. Altern Med Rev 1999; 4:360-70. 58. Yang CS, Maliakal P, Meng X. Inhibition of carcinogenesis by tea. Ann Rev Pharmacol Toxicol 2002; 42:25-54. 59. Sadzuka Y, Sugiyama T, Sonobe T. Efficacies of tea components on doxorubicin induced antitumor activity and reversal of multidrug resistance. Toxicol Lett 2000; 114:155-62. 60. Wang E, Barecki-Roach M, Johnson WW. Elevation of P-glycoprotein function by a catechin in green tea. Biochem Biophys Res Commun 2002; 297:412-8.


