© Borgis - Postępy Fitoterapii 3/2011, s. 208-218
*Piotr Migas, Magdalena Heyka
Glistnik jaskółcze ziele (Chelidonium majus L.) we współczesnej terapii – wskazania i bezpieczeństwo stosowania
Greater celandine (Chelidonium majus L.) in modern therapy – indications and safety of use
Katedra i Zakład Farmakognozji z Ogrodem Roślin Leczniczych, Wydział Farmaceutyczny, Gdański Uniwersytet Medyczny
Kierownik Katedry i Zakładu: dr hab. Mirosława Krauze-Baranowska, prof. nadzw.
Summary
The perception that herbal drugs are completely safe results in registering them as OTC drugs or dietary supplements. That is why they are often used without previous consultation with physicians or pharmacists. As a result, a growing number of reports on adverse effects of raw materials and herbal drugs has been published. More information on contraindications, side effects, interaction is also found in the European Medicines Agency (EMEA) monographs even of well known medicinal raw materials. As a result, the plant materials which have been used in medicine for centuries are being gradually eliminated, including greater celandine herb.
In this article the biological activities of greater celandine extracts and alkaloids isolated from this plant are presented. The long-term drug use, including inconsistence with the indications and contraindications, as well as with other drugs can cause serious complications, mainly associated with liver dysfunction. However, it does not mean that greater celandine plant material as well as its extracts should be eliminated from the treatment. They should be used, as many other OTC drugs, under strict control by a patient who is aware of the risks.

Chelidonium majus L. – glistnik jaskółcze ziele jest rośliną występującą w stanie naturalnym w Europie, Azji oraz Ameryce Południowej. Przetwory z glistnika, tj. nalewki, napary stosowane są w medycynie tradycyjnej od wieków; pierwsze wzmianki o zastosowaniu glistnika w medycynie znajdują się w „Papirusie Ebersa” (lata 1550-1553 p.n.e) (1). Podstawowym wskazaniem do stosowania preparatów zawierających ziele glistnika jaskółczego ziela jest terapia dolegliwości ze strony przewodu pokarmowego, będących wynikiem stanów spastycznych w obrębie dróg żółciowych (2, 3). Niemniej w medycynie tradycyjnej wyciągi z Chelidonii herba znalazły zastosowanie również jako środki o działaniu uspokajającym (ułatwiają zasypianie), hipotensyjnym, przeciwbólowym, przeciwzapalnym, hepatoochronnym, antyalergicznym, znieczulającym, moczopędnym i przeciwobrzękowym. Szereg aktywności potwierdzono badaniami w warunkach in vitro, jak i in vivo na zwierzętach. Badania te ujawniły również aktywność przeciwwirusową, przeciwdrobnoustrojową i przeciwnowotworową wyciągów alkoholowych z ziela glistnika (2, 4, 5, 6).
Pomimo szerokiego zakresu aktywności biologicznej i ugruntowanej pozycji Chelidonii herba wśród surowców leczniczych, obserwuje się działania zmierzające do eliminacji surowca i jego przetworów z lecznictwa. Prezes Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, w ogłoszeniu z dnia 4 sierpnia 2010 r. pisze, że „nie poleca się stosowania produktów leczniczych zawierających ten surowiec roślinny”. Z treści ogłoszenia Prezesa URPL, WMiPB wynika, że „ryzyko stosowania surowca do celów leczniczych przeważa nad znikomą korzyścią terapeutyczną (3κ)”. Jednocześnie wskazuje się, że również European Medicines Agency (EMEA) podjęła działania celem wpisania Chelidonium maius na europejską listę ziół, których ryzyko stosowania przekracza akceptowane korzyści lecznicze (7).
Skład chemiczny
Alkaloidy
O aktywności biologicznej wyciągów z Chelidonium majus L., podobnie jak innych przedstawicieli rodziny Papaveraceae (Makowate), decydują w głównej mierze alkaloidy. Są to głównie alkaloidy izochinolinowe. Roślina zawiera ponadto również alkaloid chinolizydynowy – sparteinę (związek charakterystyczny dla rodziny Fabaceae – Bobowate) (8, 9, 10).
W zespole alkaloidów Chelidonium zidentyfikowano łącznie ponad 30 związków (tab. 1).
Tabela 1. Alkaloidy zidentyfikowane w Chelidonium majus L. (11, 12, 13).
| Pochodne benzenofenantrydyny |
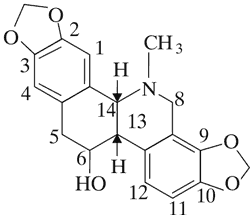
Chelidonina
 |
alfa-homochelidonina
 |
Sangwinaryna
 |
Oksysangwinaryna
 | Nitydyna
 | Norsangwinaryna
 |
Dihydronitydyna
 | Oksynitydyna
 | Chelerytryna
 |
Norchelerytryna
 | Dihydrochelidonina
 | Chelerubina
 |
Chelamidyna
 | Chelamina
 | Chelidimeryna
 |
| Pochodne benzenofenantrydyny | Chelelutyna
 |
Dihydrochelelutyna
 |
N-dimetylo-9,10-dihydroksysangwinaryna
 |
Dihydrosangwinaryna
 | Dihydrochelerubina
 | Dihydrochelerytryna
 |
Oksychelidonina
 | 10-Hydroksychelidonina
 | 10-Hydroksy-homochelidonina
 |
Norchelidonina
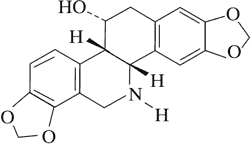 | Izochelidonina
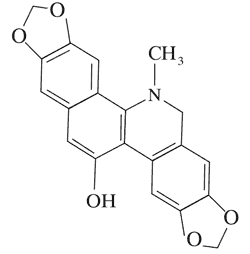 | |
| Pochodne protoberberyny | Koptyzyna
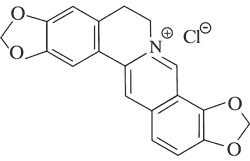 |
Berberyna
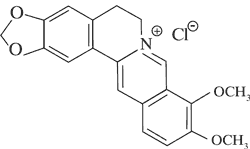 |
Dihydroberberyna
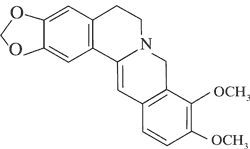 |
| Pochodne protoberberyny | Dihydrokoptyzyna
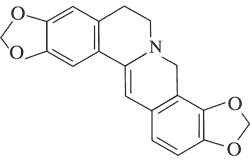 |
Stylopina
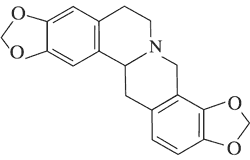 |
Korysamina
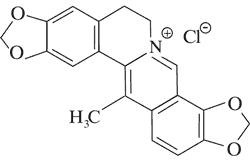 |
Tetrahydroberberyna
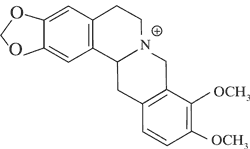 | | |
| Pochodne protopiny | Protopina
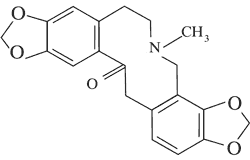 |
Allokryptopina
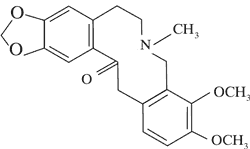 |
|
| Pochodne aporfiny | Magnofloryna
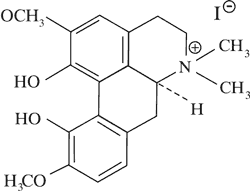 |
Korydyna
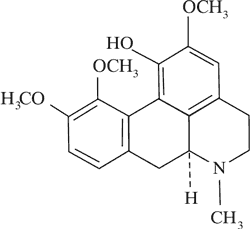 |
Norkorydyna
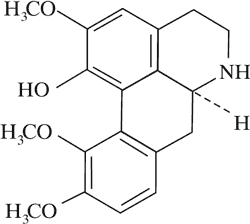 |
| Pochodne chinolizydyny | Sparteina
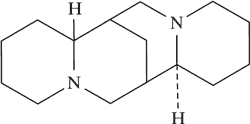 |
|
|
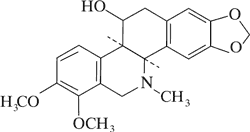
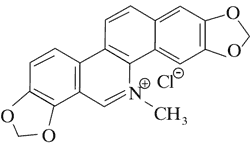
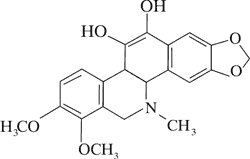
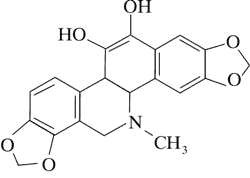
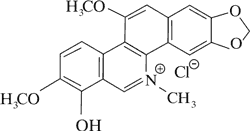
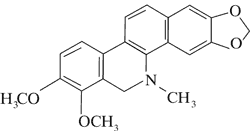
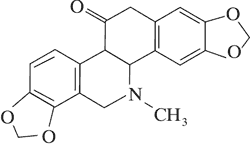
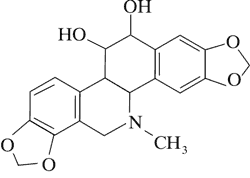
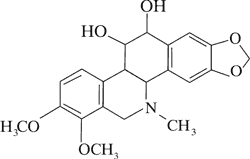
Dominującymi alkaloidami są chelidonina, chelerytryna, sangwinaryna, berberyna, koptyzyna i stylopina (9).
Badania fitochemiczne korzeni i ziela glistnika wskazują na znaczne różnice zarówno w składzie jakościowym, jak i ilościowym zespołu związków alkaloidowych.
Surowiec farmakopealny (FP VIII) – Chelidonii herba powinien zawierać nie mniej niż 0,6% alkaloidów w przeliczeniu na chelidoninę. Analizy ilościowe wskazują, że zawartość alkaloidów w zielu rośliny wynosi 0,1-1%, natomiast w korzeniach sięga 3% (9).
Istotny wpływ na zawartość poszczególnych alkaloidów w surowcu ma czas zbioru. Synteza alkaloidów ma charakter dynamiczny i istotny wpływ na jej przebieg ma światło i temperatura. Za przykład mogą posłużyć wyniki badań zawartości chelidoniny, sangwinaryny, berberyny i koptyzyny w zielu, korzeniach oraz soku mlecznym Ch. majus. Stężenie sangwinaryny w soku mlecznym w ciągu dnia może wzrosnąć nawet dwukrotnie, tj. od 1,5% rano do 3% wieczorem w miesiącach letnich. W tym samym czasie stężenie koptyzyny wzrasta od 6 do 10%. W ciągu nocy stężenie alkaloidów w soku stopniowo maleje. W efekcie o poranku ich zawartość w soku jest na zbliżonym poziomie. Podobne zmiany w stężeniu alkaloidów odnotowano w zielu i korzeniach Ch. majus. Jednocześnie wykazano, że korzenie glistnika, w porównaniu do ziela, syntetyzują do 20 razy więcej chelidoniny i sangwinaryny. Wykazano, że w zespole związków alkaloidowych Chelidonii radix dominuje chelidonina, podczas gdy w zielu – koptyzyna (13, 14, 15).
Kwasy organiczne
W zespole kwasów organicznych w zielu Ch. majus zidentyfikowano kwas: jabłkowy, cytrynowy i chelidonowy. Obecne są też pochodne kwasu cynamonowego i benzoesowego (1,2%): kwasu p-kumarowego (0,06%), ferulowego (0,02%), kawowego (0,4%), gentyzynowego (<0,01%), p-hydroksybenzoesowego (<0,01%). Są to głównie pochodne estrowe, mianowicie: kwas (–)-2-(E)-kawoilo-D-glicerynowy; kwas (–)-4-(E)-kawoilo-L-treoninowy; lakton kwasu (–)-2-(E)-kawoilo-L-treoninowego, a także już wcześniej wykryty w niektórych gatunkach Fabaceae, Brassicaceae i Urticaceae, kwas (+)-(E)-kawoilojabłkowy (16, 17).
Karotenoidy
Ilość związków karotenoidowych w wysuszonym zielu dochodzi do 1,36%, z czego 0,11% obecnych jest w kwiatach. Surowiec zawiera niewielkie ilości α- i β- karotenu oraz α- i β- kryptoksantyny. Głównym karotenoidowym związkiem w surowcu jest (E)-luteino-5,6-epoksyd. Na podstawie widma UV-Vis, czasów retencji i ko-chromatografii z wzorcami zidentyfikowano w surowcu: wiolaksantynę, flawoksantynę, chryzantemoksantynę, (9Z)-luteino-epoksyd, (13Z)-luteino-5,6-epoksyd oraz E- luteinę (18).
Flawonoidy
W liściach, łodygach i kwiatach dominują związki flawonoidowe z grupy flawonoli – pochodne kwercetyny i kemferolu. Ich zawartość w zielu sięga 2%. Interesującym jest brak związków flawonoidowych w owocach i nasionach rośliny (19).
Aktywność biologiczna substancji czynnych wyizolowanych z Chelidonium majus
Własności cytotoksyczne (20-26)
Aktywność cytotoksyczną alkaloidów Chelidonium majus – chelidoniny, sangwinaryny, chelerytryny, koptyzyny potwierdziły badania in vitro na NK/Ly mysich komórkach chłoniaka oraz izolowanym DNA. Ustalono, że mechanizm działania poszczególnych związków jest różny.
Chelerytyna, sangwinaryna i koptyzyna wbudowując się w strukturę DNA, izolowanego z komórek chłoniaka, powodują jej uszkodzenie, co prowadzi do apoptozy. Wykazano, że sangwinaryna powoduje nasilenie ekspresji proapoptycznego białka Bax jak również aktywuje kaskadę kaspazową. Uwalnianie proapoptycznych białek przez alkaloidy glistnika jaskółczego ziela do cytoplazmy, jest skorelowane z wpływem na przepuszczalność błony komórkowej.
W przeciwieństwie do wymienionych alkaloidów, chelidonina nie wykazuje powinowactwa do DNA i jest mniej cytotoksyczna wobec NK/Ly mysich komórek chłoniaka. Podkreśla się, że mechanizm działania związku jest podobny do winblastyny – hamuje polimeryzację tubulin i blokuje cykl komórkowy w fazie mitozy, zwiększa ilość zmienionych (rozwiązanych) chromatyn.
Cytotoksyczność alkaloidów Ch. majus wiąże się również z blokowaniem oddychania komórkowego, co prowadzi do śmierci komórki. Taki mechanizm działania wykazują chelerytryna, sangwinaryna, berberyna i koptyzyna, mające czwartorzędowy atom azotu w strukturze. Ponadto obecne w strukturze związków reaktywne ugrupowanie iminowe jest zdolne do hamowania aktywności enzymów i innych białek z grupą nukleofilową. Efektem tego jest hamowanie przez chelerytrynę aktywności kinazy proteinowej C, której zwiększona aktywność oraz ekspresja kodującego ją genu, są czynnikami etiopatogennymi niektórych nowotworów, np. niedrobnokomórkowego raka płuc. W badaniach in vitro potwierdzono, że stosowanie chelerytryny z cisplatyną zwiększa wrażliwość komórek nowotworowych na terapię cisplatyną.
Badania in vitro na komórkach mięsaka S180 potwierdziły zdolność berberyny do hamowania syntezy DNA i RNA. Ponadto związek dezaktywuje topoizomerazy, hamuje aktywność cyklooksygenazy II oraz odwrotnej transkryptazy RNA wirusów uczestniczących w procesie nowotworzenia. Berberyna hamuje proces angiogenezy poprzez inhibicję ekspresji metaloproteinaz. W badaniu in vitro na liniach komórkowych nowotworu przełyku, berberyna działa ponadto przeciwobrzękowo, hamując m.in. sekrecję interleukiny 6.
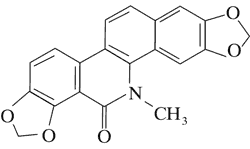
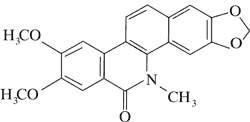
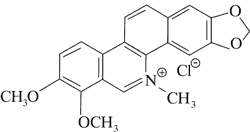
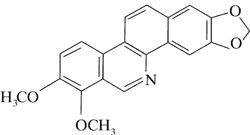
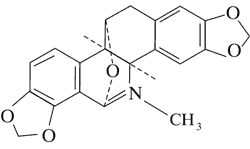
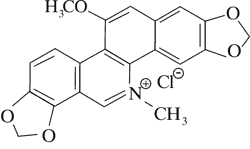
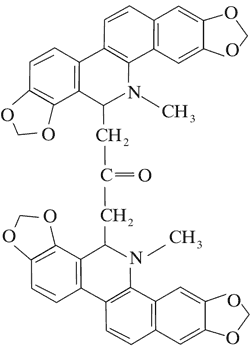
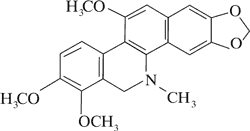
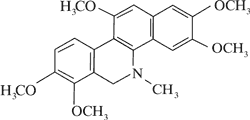
Doniesienia o aktywności cytotoksycznej alkaloidów Chelidonium majus dały początek badaniom nad ich stosowaniem w terapii nowotworów. Przykładem jest pochodna chelidoniny, zawierająca reszty kwasu tiofosforowego – Ukrain (ryc. 1).
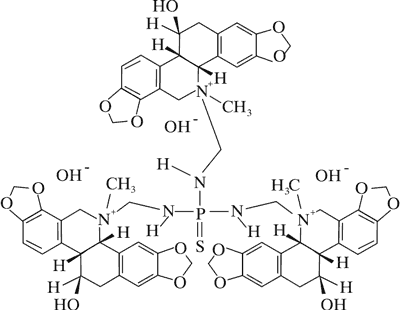
Ryc. 1. Ukrain (27).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Kawałko MJ. Historie ziołowe. KAW. Lublin 1986. 2. Yilmaz BS, Ozbek H, Citiglu GS i wsp. Analgesic and hepatoprotective effects of Chelidonium majus L. Ankara. J Fac Pharm 2007; 36:9-20. 3. Biswas SJ, Bhattacharjee N, Khuda-Bukhsh AR. Efficacy of a plant extract (Chelidonium majus L.) in combating induced hepatocarcinogenesis in mice. Food ChemToxicol 2008; 46:1474-87. 4. Haberlein H, Tschiersch KP, Boonen G i wsp. Chelidonium majus L.: Components with in vitro affinity for the GABAA receptor. Positive cooperation of alkaloids. Planta Med 1996; 62:227-31. 5. Hiller KO, Ghorbani M, Schilcher H. Antispasmodic and relaxant activity of chelidonine, protopine, coptisine, and Chelidonium majus extracts on isolated guinea-pig ileum. Planta Med 1998; 64:758-60. 6. Gilca M, Gaman L, Panait E i wsp. Chelidonium majus – an integrative review: traditional knowledge versus modern findings. Forsch Komplementmed 2010; 17:241-8. 7. www.urpl.gov.pl. 8. Barton D, Nakanishi K, Meth-Cohn O. Comprehensive natural products chemistry. Vol 4, Amino acids, peptides, porphyrins and alkaloids (red. JW Kelly). Elsevier, Amsterdam 1999. 9. Colombo ML, Bosisio E. Pharmacological activities of Chelidonium majus L. (Papaveraceae). Pharmacol Res 1996; 3:127-34. 10. Kopytko YF, Dargaeva TD, Sokolskaya TA i wsp. New methods for the quality control of a homeopathic matrix tincture of Greater Celandine. Pharm Chem 2005; 39:40-5. 11. Shafiee A, Jafarabadi AH. Corydine and norcorydine from the roots of Chelidonium majus. Planta Med 1998; 64:489. 12. Necas M, Dosta J, Kejnovska I i wsp. Molecular and crystal structures of (C)-homochelidonine, (C)-chelamine, and (K)-norchelidonine. J Molecul Struct 2004; 734:1-6. 13. Tome F, Colombo ML. Distribution of alkaloids in Chelidonium majus and factor affectiong their accumulation. Phytochem 1995; 40:37-9. 14. Wichtl M, Bisset NG. Herbal Drug and Pharmaceuticals. A Handbook for Practice on Scientific Basis. Medpharm, Stuttgart 2004. 15. Fulde G, Wichtl M. Analytic von Schollkrau. Dtsch Apoth Zgt 1994; 134:1031-5. 16. Boegge SC, Kesper S, Verspohl EJ i wsp. Reduction of ACh-induced contraction of rat isolated ileum by coptisine, (+)-caffeoylmalic acid, Chelidonium majus and Corydalis lutea extracts. Planta Med 1994; 62:173-4. 17. Hahn R, Nahrstedt A. Hydroxycinnamic acid derivatives caffeoylmalic and new caffeoylaldonic esters from Chelidonium majus. Planta Med 1993; 59:71-5. 18. Horvath G, Molnar P, Farkas A i wsp. Separation and identification of carotenoids in flowers of Chelidonium majus L. and inflorescences of Solidago canadensis L. Chromatographia 2010; 1-6. 19. Stancic-Rotaru M, Mititelu M, Crasmaru M i wsp. Spectroanalytical profile of flavonoids from Chelidonium majus L. Roum Biotechnol Lett 2003; 8:1093-100. 20. Vavreckova C, Gawlik I, Muller K. Benzophenanthridine alkaloids of Chelidonium majus; II. Potent inhibitory action against the growth of human keratinocytes. Planta Med 1996; 62:491-4. 21. Barreto MC, Pinto E, Arrabaca JD. Inhibtion mouse liver respiration by Chelidonium majus isoquinoline alkaloids., Toxicol Lett 2003; 146:37-47. 22. Shalimov SA, Grinevich YuA, Martynenko SV i wsp. Antimetastatic effect of the preparation of thiophosphorous acid and celandine alcaloids in vivo after removal of primary tumors. Exper Oncol 2003; 25:152-4. 23. Kaminsky VO, Lootsik MD, Stoika RS. Correlation of the cytotoxic activity of four different alkaloids, from Chelidonium majus (greater celandine), with their DNA intercalating properties and ability to induce breaks in the DNA of NK/Ly murine lymphoma cells. Central Europ J Biol 2006; 1:2-15. 24. Gao Z, Tang L, Su B i wsp. Effects of protein kinase C inhibitor, chelerythrine chloride, on drug-sensitivity of NSCLC cell lines. Chin J Lung Cancer 2007; 10:455-60. 25. Imanshahidi M, Hosseinzadeh H. Pharmacological and therapeutic effects of Berberis vulgaris and its active constituent, Berberine – review article. Phytother Res 2008; 22:999-1012. 26. Wongbutdee J. Physiological effects of berberine – Review article. Thai Pharma Health Sci J 2009; 4:78-83. 27. http://proukrain.com/. 28. Porter TG, Martin DL. Chelidonic acid and other conformationally restricted substrate analogues as inhibitors of rat brain glutamate decarboxylase. Biochem Pharmacol 1985; 34:4145-50. 29. Kuznetsova LP, Nikolskaya EB, Sochilina EE i wsp. Inhibition of enzymatic hydrolysis of acetylthiocholine with acetylcholinesterase by principal alkaloids isolated from Chelidonium majus and Macleya and by derivative drugs. Tsitologiya 2001; 43:1049-50. 30. Iagodina OV, Nikolskaia EB, Faddeeva MD. Inhibition of liver mitochondrial monoamine oxidase activity by alkaloids isolated from Chelidonium and Macleaya and by their derivative drugs. Tsitologiya 2003; 45:1032-7. 31. Ko FN, Chen I, Wu SJ i wsp. Antiplatelet effects of chelerythrine chloride isolated from Zanthoxylum simulans. Biochim Biophys Acta – Mol Cell Res 1990; 1052:360-5. 32. Vavreckova C, Gawlik I, Muller K. Benzophenanthridine alkaloids of Chelidonium majus; I. Inhibition of 5- and 12-lipoxygenase by a non-redox mechanism, Planta Med 1996; 62:397-401. 33. Rogelj B, Popovic T, Ritonja A i wsp. Chelidocystatin, a novel phytocystatin from Chelidonium majus. Phytochem 1998; 49:1645-9. 34. Song JY, Yang HO, Pyo SN i wsp. Immunomodulatory activity of protein bound polysaccharide extracted from Chelidonium majus. Archiv Pharmacal Res 2002; 25:158-64. 35. Gerencer M, Turecek PL, Kistner O i wsp. In vitro and in vivo anti-retroviral activity of the substance purified from the aqueous extract of Chelidonium majus L. Antiv Res 2006; 72:153-6. 36. Nawrot R, Lesniewicz K, Pienkowska J i wsp. A novel extracellular peroxidase and nucleases from a milky sap of Chelidonium majus. Fitoter 2007; 78:496-501. 37. Zuo GY, Meng FY, Hao XY i wsp. Antibacterial alkaloids from Chelidonium majus L. (Papaveraceae) against clinical isolates of methicillin-resistant Staphylococcus aureus. J Pharm Pharmaceut Sci: a publication of the Canad Soc Pharmaceut Sci 2008; 11:90-4. 38. Cirić A, Vinterhalter B, Savikin-Fodulović K i wsp. Chemical analysis and antimicrobial activity of methanol extracts of Celandine (Chelidonium majus L.) plants growing in nature and cultured in vitro. Arch Biol Sci 2008; 60:7-8. 39. Vahlensieck U, Hahn R, Winterhoff H i wsp. The effect of Chelidonium majus herb extract on choleresis in the isolated perfused rat liver. Planta Med 1995; 61:267-70. 40. Moro PA, Cassetti F, Giugliano G i wsp. Hepatitis from Greater celandine (Chelidonium majus L.): Review of literature and report of a new case. J Ethnopharmacol 2009; 124:328-32. 41. Benninger J, Schneider HT, Schuppan D i wsp. Acute hepatitis induced by greater celandine (Chelidonium majus). Gastroenterol 1999; 117:1234-7. 42. Stickel F, Poschl G, Seitz HK i wsp. Acute hepatitis induced by Greater Celandine. Scand J Gastroenterol 2003; 38:565-8. 43. Dalvi RR. Sanguinarine, it’s a potential as a liver toxic alkaloid present in the seeds of Argemone mexicana. Experiment 1985; 41:77-8. 44. Ulrichova J, Walterowa D, Vavreckowa C i wsp. Cytotoxicity of benzo(c)phenanthridinium alkaloids in isolated rat hepatocytes. Phytoter Res 1996; 10:220-3. 45. Jagiełło-Wójtowicz E, Jeleniewicz K, Chodkowska A. Effects of acute and 10 day treatment with benzophenanthridine type alkaloids from Chelidonium majus L. on some biochemical parameters in rats. Herba Polon. 2000; 46:303-7. 46. Adler M, Appel K, Canal T i wsp. Wirkung von Schöllkrautextrakten an humanen Hepatocyten in vitro. Toxicol Lett 2006; 164:210-11. 47. Mazzantia G, Di Sottoa A, Franchittob A i wsp. Chelidonium majus is not hepatotoxic in Wistar rats, in a 4 weeks feeding experiment. J. Ethnopharmacol 2009; 126:518-24. 48. ESCOP Monographs, Scientific Fundation for Herbal Medicinal Products, Stuttgart 2003. 49. Rifai K, Flemming P, Manns MP i wsp. 58-Jähriger Patient mit schwerer cholestatischer Hepatitis. Internist 2006; 46:749-751. 50. www.ConsumerReports.org. 51. www.emea.europa.eu








































