© Borgis - Postępy Fitoterapii 3/2011, s. 185-190
Barbara Król-Kogus, *Mirosława Krauze-Baranowska
Kozieradka pospolita (Trigonella foenum graecum L.) – tradycja stosowania na tle wyników badań naukowych
Fenugreek (Trigonella foenum-graecum L.) – traditional herb on the background of the research studies
Katedra i Zakład Farmakognozji z Ogrodem Roślin Leczniczych Gdańskiego Uniwersytetu Medycznego
Kierownik Katedry i Zakładu: dr hab. Mirosława Krauze-Baranowska, prof. nadzw.
Summary
Fenugreek is a plant providing two medicinal drugs – seed and herb, which posses an age-old tradition of usage, especially in Asia. In European countries fenugreek seeds are used as a hypolipidemic and lowering sugar level in blood agent. During the last few years several studies have been published, which revealed also antiphlogistic and antibacterial properties of seeds. This type of activity is due to a presence of steroidal saponins. On the other hand, the seeds have neurological activity comprising acetylocholinesterase inhibition and stimulation of neuron outgrowth. Numerous studies confirm multidirectional influence of fenugreek seeds on gastrointestinal tract, i.a. anti-ulcer, hepatoprotective activity and protection against colon cancer. Seeds of fenugreek are source of phytoestrogenes, and its use as a constituent of dietary supplements may arise controversies.

Wstęp
Kozieradka pospolita (Trigonella foenum-graecum L.) jest jednoroczną rośliną zielną, należącą do rodziny bobowatych (Leguminosae). Owocem jest brunatny strąk o długości 15-20 cm, zawierający ok. 15 twardych, żółtobrązowych nasion o romboidalnym kształcie i silnym aromacie.
W stanie naturalnym kozieradka występuje w rejonie Morza Śródziemnego: w Pakistanie, Turcji i Sudanie oraz Indiach i Chinach (1). W krajach europejskich T. foenum-graecum spotykana jest jako efemerofit. Jest uprawiana w Azji i Europie jako roślina pastewna. Wysoka zawartość białka, witamin oraz związków mineralnych powoduje, że nasiona kozieradki są cennym składnikiem pasz.
Wysuszone nasiona lub sporządzony z nich kleik, a także preparaty galenowe, są podawane doustnie jako środek odżywczy, pobudzający apetyt i wspomagający trawienie w dolegliwościach przewodu pokarmowego: dyspepsjach, wzdęciach, zapaleniu błony śluzowej żołądka (1, 2, 3) oraz chorobach wątroby (1). Są wykorzystywane również jako surowiec o działaniu wykrztuśnym w chorobach górnych dróg oddechowych (1). W medycynie tradycyjnej gorące okłady z nasion kozieradki (kataplazmy) są stosowane w leczeniu miejscowych stanów zapalnych skóry i tkanki podskórnej, m.in. czyraków, ropni i owrzodzeń (1, 2, 3). Kataplazmy sporządzane ze sproszkowanych nasion wykazują działanie zmiękczające, łagodzące stany zapalne oraz redukujące obrzęki, stąd też stosuje się je w leczeniu drobnych urazów, stłuczeń i siniaków (1, 2, 3).
Nasiona i liście kozieradki są w Azji popularnym warzywem, a wysuszone i sproszkowane nasiona, dodawane do potraw, stanowią cenioną przyprawę. Opisana w hinduskiej księdze leczniczych surowców roślinnych Ayurweda (2500-600 p.n.e.) pod nazwą methi, kozieradka pospolita od wieków wykorzystywana jest w medycynie azjatyckiej. Nasiona wzmagają laktację i wykorzystywane są jako środek mlekopędny (2, 4). Zgodnie z tradycyjną medycyną chińską i hinduską, nasiona methi polecane są w leczeniu cukrzycy jako środek obniżający poziom glukozy we krwi (1, 2).
W Iranie liście kozieradki są popularnym surowcem leczniczym w chorobach narządu wzroku: zapaleniu brzegów powiek (blepharitis marginalis), czyraku mnogim, a nawet w jaglicy (5).
Chemizm
Kozieradka jest bogatym źródłem związków biologicznie aktywnych o zróżnicowanej budowie chemicznej. Nasiona zawierają bogaty zespół flawonoidów, w którym obok wolnych flawonów (luteoliny (6) i trycyny (7, 8)), flawanonów (naryngeniny (7)) oraz flawonoli (kwercetyny (7)), występują także ich O-, C-, oraz C-O-glikozydy a także C-diglikozydy, m.in. witeksyna (ryc. 1), izowiteksyna, orientyna (ryc. 2) i izoorientyna (6, 7, 9, 10, 11), wicenina-1 oraz wicenina-2 (10, 12) oraz estry C-glikozydów (8, 11). Najnowsze badania potwierdziły występowanie w nasionach kozieradki izoflawonów – metabolitów wtórnych o charakterze fitoestrogenów (8), m.in. biochaniny A, formononetyny, daidzeiny i in. (8). Natomiast w zielu kozieradki dominują O-glikozydowe pochodne kemferolu i kwercetyny (13).
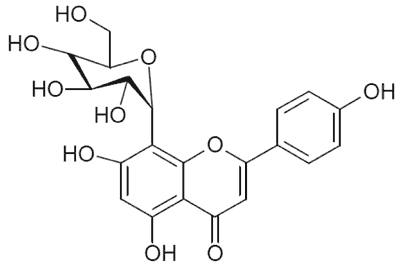
Ryc. 1. Witeksyna.
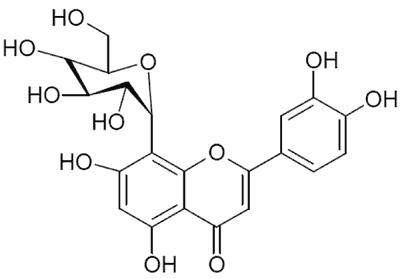
Ryc. 2. Orientyna.
Nasienie kozieradki jest znanym surowcem saponinowym, zawierającym saponiny steroidowe, w tym pochodne spirostanu i furostanu. Na przestrzeni lat określono strukturę praktycznie wszystkich związków z zespołu obejmującego wolne aglikony, tj. ?-5-nie-nasycone pochodne cyklopentanoperhydrofenantrenu i ich 25-epimery: diosgeninę i jamogeninę (14, 15, 16, 17), jukkageninę (16, 17) i lilageninę (16) oraz pochodne 5α-nasycone i ich 25-epimery: tigogeninę (14, 17) i neotigogeninę (14, 16, 17) oraz gitogeninę (14, 16, 17) i neogitogeninę (16, 17). Ponadto obok aglikonów, nasiona zawierają liczne glikozydy pochodne furostanu, różniące się zarówno rodzajem podstawników pięciopierścieniowego szkieletu, jak i budową łańcuchów cukrowych (18-26). Dotychczas zidentyfikowano jako pochodne glikozydowe: trigofenozydy A-G (18-21), trigoneozydy I-XIII (22, 23, 27) oraz glikozydy pochodne spirostanu (diosgeniny (ryc. 3)): grekuniny H-N (28) (w zielu kozieradki obecne są grekuniny A-G (28, 29)).
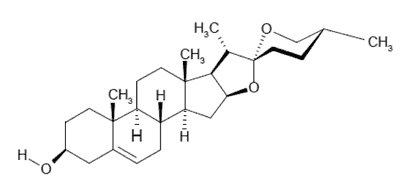
Ryc. 3. Diosgenina.
Zespół metabolitów wtórnych obejmuje również związki o budowie alkaloidowej, w tym alkaloid pirydynowy trygonelinę – N-metylobetainę kwasu nikotynowego (30, 31). Zawartość trygoneliny w świeżych nasionach jest znacznie wyższa niż w suszonych, ponieważ w podwyższonej temperaturze związek ulega rozkładowi do kwasu nikotynowego (witaminy PP) (32).
Ponadto nasiona kozieradki są bogatym źródłem śluzu (galaktomannany) (33, 34), witamin, w tym amidu kwasu nikotynowego (witaminy PP) (30), związków mineralnych (35) i substancji zapachowych (36).
Działanie farmakologiczne
Działanie hipoglikemiczne i przeciwhiperglikemiczne
Opisane już w starożytności, obniżające poziom glukozy we krwi, działanie nasion T. foenum-graecum, potwierdzono w warunkach in vivo na zwierzętach i ludziach (37). W eksperymentach na zwierzętach wykazano, że suplementacja diety nasionami kozieradki, w przebiegu cukrzycy indukowanej aloksanem, stymuluje obniżoną aktywność enzymów glikolitycznych, m.in. kinazy pirogronianowej (PK) i związanych z NADP enzymów lipogenicznych (m.in. dehydrogenazy glukozo-6-fosforanowej) oraz normalizuje podwyższoną aktywność enzymów glukoneogenicznych (glukozo-6-fosfataz i fruktozo-1,6-bisfosfataz) (38, 39).
Badania wskazują, że mechanizm działania ekstraktu z nasion kozieradki obejmuje także aktywację w adipocytach i komórkach wątroby insulinowej ścieżki sygnalizacyjnej (40).
W obecności wyciągu z nasion kozieradki obserwowano aktywację podjednostki β receptora insulinowego (IR-β), prowadzącą do szeregu przemian biochemicznych (fosforylacja białek, synteza przekaźników drugiego rzędu, aktywacja kinazy białkowej C), którego skutkiem była translokacja z przestrzeni międzykomórkowej do błony komórkowej insulinozależnego transportera glukozy GLUT-4, obecnego w adipocytach i tkance mięśniowej (39, 40) oraz zwiększony wychwyt glukozy. W przeciwieństwie jednak do insuliny, ekstrakt z nasion kozieradki nie powodował aktywacji kinazy białkowej B (40).
Działanie hipoglikemiczne surowca wynika prawdopodobnie z synergistycznego wpływu różnych związków chemicznych. Dzięki obecności znacznych ilości galaktomannanów, nasiona kozieradki przyjmowane doustnie w postaci kleiku, opóźniają opróżnianie żołądka (41) i redukują poposiłkowy wzrost stężenia glukozy (42, 43). Hamują aktywność enzymów rozkładających węglowodany (41) oraz obniżają poziom glukozy w moczu (43).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1.Wichtl M. Herbal drugs and phytopharmaceuticals: a handbook for practice on a scientific basis. CRC Press, New York 2004. 2. Mills S, Bone K. The essential guide to herbal safety. Elsevier, St Louis 2005. 3. Kapoor LD. Handbook of ayurvedic medicinal plants: Herbal reference library. CRC Press, Boca Raton 2001. 4. Dweck AC. Isoflavones, phytohormones and phytosterols. J Appl Cosm 2006; 24(1):17-32. 5. Miraldi E, Ferri S, Mostaghimi V. Botanical drugs and preparations in the traditional medicine of West Azerbaijan (Iran). J Ethnopharmacol 2001; 75(2-3):77-87. 6. Prati S, Baravelli V, Fabbri D i wsp. Composition and content of seed flavonoids in forage and grain legume crops. J Sep Sci 2007; 30(4):491-501. 7. Shang M, Cai S, Han J i wsp. Studies on flavonoids from fenugreek (Trigonella foenum graecum L.). Zhongguo Zhongyao Zazhi 1998; 23(10):614-6. 8. Wang G, Tang W, Yao Q i wsp. New flavonoids with 2BS cell proliferation promoting effect from the seeds of Trigonella foenum-graecum L. J Nat Med 2010; 64 (3):358-61 9. Adamska M, Lutomski J. C-flavonoid glycosides in the seeds of Trigonella foenum graecum. Planta Med 1971; 20(3): 224-9. 10. Wagner H, Iyengar MA, Hörhammer L. Vicenin-1 and -2 in the seeds of Trigonella foenumgraecum. Phytochemistry 1973; 12(10):2548. 11. Rayyan S, Fossen T, Andersen QM. Flavone C-Glycosides from seeds of Fenugreek Trigonella foenum-graecum L. J Agric Food Chem 2010; 58 (12):7211-7. 12. Shan J, Ren J, Wu C i wsp. Effect of flavonoid-C-glycosides from Trigonella foenum-graecum on hypoglycemic activities in alloxan-induced mice. Chinese Pharm J 2008; 43(19):1457-60. 13. Han Y, Nishibe S, Noguchi Y i wsp. Flavonol glycosides from the stems of Trigonella foenum-graecum. Phytochem 2001; 58:577-80. 14. Dawidar AM, Saleh AA, Elmotei SL. Steroid sapogenin constituents of fenugreek seeds. Planta Med 1973; 24(4):367-70. 15. Jefferies TM, Hardman R. An improved column-chromatographic quantitative isolation of diosgenin and yamogenin from plant crude extracts prior to their determination by infrared spectrophotometry. Analyst 1976; 101:122-4. 16. Brenac P, Sauvaire Y. Accumulation of sterols and steroidal sapogenins in developing fenugreek pods: Possible biosynthesis in situ. Phytochem 1996; 41(2):415-22. 17. Petit PR, Sauvaire YD, Hillaire-Buys DM i wsp. Steroid saponins from fenugreek seeds: Extraction, purification, and pharmacological investigation on feeding behavior and plasma cholesterol. Steroids 1995; 60(10):674-80. 18. Gupta RK, Jain DC, Thakur RS. Furostanol glycosides from Trigonella foenum-graecum seeds. Phytochem 1984; 23(11):2605-7. 19. Gupta RK, Jain DC, Thakur RS. Droplet counter current chromatography of furostanol glycosides of Trigonella foenum-graecum. Indian J Pharm Sci 1985; 47(1):25-6. 20. Gupta RK, Jain DC, Thakur RS. Minor steroidal sapogenins from fenugreek seeds, Trigonella foenum-graecum. J Nat Prod 1986; 49(6):1153. 21. Gupta RK, Jain DC, Thakur RS. Two furostanol saponins from Trigonella foenum-graecum. Phytochem 1986; 25(9):2205-7 22. Yoshikawa M, Murakami T, Komatsu H i wsp. Medicinal foodstuffs. IV. Fenugreek seed. (1): Structures of trigoneosides Ia, Ib, IIa, IIb, IIIa, and IIIb, new furostanol saponins from the seeds of indian Trigonella foenum-graecum L. Chem Pharm Bull 1997; 45(1):81-7. 23. Yoshikawa M, Murakami T, Komatsu H i wsp. Medicinal foodstuffs. VIII.1 fenugreek seed. (2): Structures of six new furostanol saponins, trigoneosides IVa, Va, Vb, VI, VIIb, and VIIIb, from the seeds of indian Trigonella foenum-graecum L. Heterocycles 1998; 47(1):397-405. 24. Bogacheva NG, Kiselev VP, Kogan LM. Isolation of 3,26-bisglycoside of yamogenin from Trigonella foenum-graecum. Chem Nat Compd 1976; 12(2):242-3. 25. Bogacheva NG, Sheichenko VI, Kogan LM. Structure of the tetraoside yamogenin from seeds of Trigonella foenum-graecum. Pharm Chem J 1978; 11(7):938-42. 26. Hardman R, Kosugi J, Parfitt RT. Isolation and characterization of a furostanol glycoside from fenugreek. Phytochem 1980; 19(4):698-700. 27. Murakami T, Kishi A, Matsuda H i wsp. Medicinal foodstuffs. XVII. Fenugreek seed. (3): Structures of new furostanol-type steroid saponins, trigoneosides Xa, Xb, XIb, XIIa, XIIb, and XIIIa, from the seeds of Egyptian Trigonella foenum-graecum L. Chem Pharm Bull 2000; 48(7):994-1000. 28. Varshney IP, Beg MFA. Study of saponins from the seeds of Trigonella foenum-graecum Linn. Indian J Chem, Sect. B 1978; 16(12):1134-6. CA 91: 87294z. 29. Varshney IP, Jain DC, Srivastava HC. Saponins from Trigonella foenum-graecum leaves. J Nat Prod 1984; 47(1):44-6. 30. Shani J, Goldschmied A, Joseph B. Hypoglycaemic effect of Trigonella foenum graecum and Lupinus termis (Leguminosae) seeds and their major alkaloids in alloxan diabetic and normal rats. Arch Int Phermacod T 1974; 210(1):27-37. 31. Satheesh Kumar N, Mukherjee PK, Bhadra S i wsp. Acetylcholinesterase enzyme inhibitory potential of standardized extract of Trigonella foenum graecum L. and its constituents. Phytomed 2009; 17(3-4):292-5 32. Stadler RH, Varga N, Hau J i wsp. Alkylpyridinimus.1. Formation in model systems via thermal degradation of trigonelline. J Agric Food Chem 2002; 50:1192-9 33. Jiang JX, Zhu LW, Zhang WM i wsp. Characterization of galactomannan gum from fenugreek (Trigonella foenum-graecum) seeds and its rheological properties. Int J Polym Mater 2007; 56(12):1145-54. 34. Ramesh HP, Yamaki K, Tsushida T. Effect of fenugreek (Trigonella foenum-graecum L.) galactomannan fractions on phagocytosis in rat macrophages and on proliferation and IgM secretion in HB4C5 cells. Carbohydr Polym 2002; 50(1):79-83. 35. Gupta KK, Bhattacharjee S, Kar S i wsp. Mineral compositions of eight common spices. Commun Soil Sci Plant Anal 2003; 34(5-6):681-93. 36. Mebazaa R, Mahmoudi A, Fouchet M i wsp. Characterization of volatile compounds in Tunisian fenugreek seeds. Food Chem 2009; 115(4):1326-36. 37. Grover JK, Yadav S, Vats V. Medicinal plants of India with anti-diabetic potential. J Ethnopharmacol 2002; 81(1):81-100. 38. Raju J, Gupta D, Rao AR i wsp. Trigonella foenum graecum (fenugreek) seed powder improves glucose homeostasis in alloxan diabetic rat tissues by reversing the altered glycolytic, gluconeogenic and lipogenic enzymes. Mol Cell Biochem 2001; 224(1-2): 45-51. 39. Mohammad S, Taha A, Akhtar K i wsp. In vivo effect of Trigonella foenum graecum on the expression of pyruvate kinase, phosphoenolpyruvate carboxykinase, and distribution of glucose transporter (GLUT4) in alloxan-diabetic rats. Can J Physiol Pharm 2006; 84(6):647-54. 40. Vijayakumar MV, Singh S, Chhipa RR i wsp. The hypoglycaemic activity of fenugreek seed extract is mediated through the stimulation o an insulin signaling pathway. British J Pharm 2005; 146:41-8. 41. Al-Habori M, Raman A. Antidiabetic and hypocholesterolaemic effects of fenugreek. Phytother Res 1998; 12(4):233-42. 42. Ali L, Azad Khan AK, Hassan Z i wsp. Characterization of the hypoglycemic effects of Trigonella foenum graecum seed. Planta Med 1995; 61(4):358-60. 43. Suresh Kumar G, Shetty AK, Salimath PV. Modulatory effect of fenugreek seed mucilage and spent turmeric on intestinal and renal disaccharidases in streptozotocin induced diabetic rats. Plant Food Hum Nutr 2005; 60(2):87-91. 44. Sauvaire Y, Petit P, Broca C i wsp. A novel amino acid potentiator of insulin secretion. Diabetes 1998; 47(2):206-10. 45. Haeri MR, Izaddoost M, Ardekani MRS i wsp. The effect of fenugreek 4-hydroxyisoleucine on liver function biomarkers and glucose in diabetic and fructose-fed rats. Phytother Res 2009; 23(1):61-4. 46. Lu F, Shen L, Qin Y i wsp. Clinical observation of Trigonella foenum-graecum saponin combining sulphanylureas on 36 cases of type 2 diabetes mellitus. Zhongguo Zhongyao Zazhi 2008; 33(2):184-7. 47. Kannappan S, Anuradha CV. Insulin sensitizing actions of fenugreek seed polyphenols, quercetin and metformin in a rat model. Indian J Med Res 2009; 129(4):401-8. 48. Vijayakumar MV, Pandey V, Mishra GC i wsp. Hypolipidemic effect of fenugreek seeds is mediated through inhibition of fat accumulation and upregulation of LDL receptor. Obesity 2010; 18(4):667-74 49. Prasanna M. Hypolipidemic effect of fenugreek: A clinical study. Indian J Pharm 2000; 32(1):34-6. 50. Saxena B, Saxena U. Anti-hyperlipidemic activity of fenugreek (Trigonella foenum-graecum) seeds extract in Triton and high fat diet induced hyperlipidemic model: A potent anti-antherosclerotic agent. Pharmacologyonline 2009; 2:616-24. 51. Boban PT, Nambisan B, Sudhakaran PR. Hypolipidaemic effect of chemically different mucilages in rats: A comparative study. Brit J Nutr 2006; 96(6):1021-9. 52. Sauvaire Y, Ribes G, Baccou J i wsp. Implication of steroid saponins and sapogenins in the hypocholesterolemic effect of fenugreek. Lipids 1991; 26(3):191-7. 53. Francis G, Kerem Z, Makkar I i wsp. The biological action of saponins in animal systems: A review. Brit J Nutr 2002; 88(6):587-605. 54. Kamanna VS, Kashyap ML. Mechanism of action of niacin. Am J Cardiol 2008; 101. 55. Vyas S, Agrawal RP, Solanki P i wsp. Analgesic and anti-inflammatory activities of Trigonella foenum-graecum (seed) extract. Acta Pol Pharm – – Drug Res 2008; 65(4):473-6. 56. Malviya Kapil G, Babhulkar Mukesh W, Mali Prashant Y i wsp. Evaluation of anti-inflammatory potential of Trigonella foenum-graecum (fenugreek) seed extracts by using carrageenan induced rat paw edema. Drug Invention Today 2010; 2(2):109-11. 57. Mueller M, Hobiger S, Jungbauer A. Anti-inflammatory activity of extracts from fruits, herbs and spices; Food Chem 2010; 122:987-96 58. Ahmadiani A, Javan M, Semnanian S i wsp. Anti-inflammatory and antipyretic effects of Trigonella foenum-graecum leaves extract in the rat. J Ethnopharmacol 2011; 75(2-3): 283-6. 59. Hossain SJ, Aoshima H, Koda H i wsp. Effects of coffee components of GABAA receptors expressed in Xenopus oocytes. J Agric Food Chem 2003; 51:7568-75 60. Tohda C, Nakamura N, Komatsu K i wsp. Trigonellinae-induced neurite outgrowth in human neuroblastoma SK-N-SH cells. Biol Pharm Bull 1999; 22(7):679-82. 61. Tohda C, Kuboyama T, Komatsu K. Search for natural products related to regeneration of the neuronal network. Neuro Signals 2005; 14:34-45. 62. Omoloso AD, Vagi JK. Broad spectrum antibacterial activity of Allium cepa, Allium roseum, Trigonella foenum graecum and Curcuma domestica. Nat Prod Sci 2001; 7(1):13-6. 63. Aqil F, Ahmad I. Broad-spectrum antibacterial and antifungal properties of certain traditionally used Indian medicinal plants. World J Microb Biot 2003; 19(6):653-7. 64. Wagh P, Rai M, Deshmukh SK i wsp. Bio-activity of oils of Trigonella foenum-graecum and Pongamia pinnata. African J Biotech 2007; 6(13):1592-6. 65. Haouala R, Hawala S, El-Ayeb A i wsp. Aqueous and organic extracts of Trigonella foenum-graecum L. inhibit the mycelia growth of fungi. J Environ Sci 2008; 20(12):1453-7. 66. Suja Pandian R, Anuradha CV, Viswanathan P. Gastroprotective effect of fenugreek seeds (Trigonella foenum graecum) on experimental gastric ulcer in rats. J Ethnopharmacol 2002; 81(3):393-7. 67. Langmead L, Dawson C, Hawkins C i wsp. Antioxidant effects of herbal therapies used by patients with inflammatory bowel disease: an in vitro study. Aliment Pharmacol Ther 2002; 16:197-205 68. Mahmood AA, Sidik K, Salmah I. Anti-ulcer and gastro protective effects of honey in combination with Trigonella foenum-graecum seed extract on experimental gastric ulcer in rats. Inter J Mol Med Adv Sci 2005; 1(3):225-9 69. Raju J, Patlolla JMR, Swamy MV i wsp. Diosgenin, a steroid saponin of Trigonella foenum graecum (fenugreek), inhibits azoxymethane-induced aberrant crypt foci formation in F344 rats and induces apoptosis in HT-29 human colon cancer cells. Cancer Epidem Biomar 2004; 13(8):1392-8. 70. Li F, Fernandez PP, Rajendran P i wsp. Diosgenin, a steroidal saponin, inhibits STAT3 signaling pathway leading to suppression of proliferation and chemosensitization of human hepatocellular carcinoma cells. Cancer Lett 2010; 292:197-207. 71. Pribac G, Ardelean A, Czapar M i wsp. Trigonella foenum-graecum and Trigonella policreata seeds extract exert a protective action of alcohol toxicity in BRL3A rat liver cells. Studia Univ, Ser ŞV 2009; 19:87-93 72. Kaviarasan S, Anuradha CV. Fenugreek (Trigonella foenum graecum) seed polyphenols protect liver from alcohol toxicity: A role on hepatic detoxification system and apoptosis. Pharmazie 2007; 62(4):299-304. 73. Kaviarasan S, Sundarapandiyan R, Anuradha CV. Protective action of fenugreek (Trigonella foenum graecum) seed polyphenols against alcohol-induced protein and lipid damage in rat liver. Cell Biol Toxicol 2008; 24(5):391-400. 74. Kaviarasan S, Ramamurty N, Gunasekaran P i wsp. Fenugreek (Trigonella foenum graecum) seed extract prevents ethanol-induced toxicity and apoptosis in chang liver cells. Alcohol Alcoholism 2006; 41(3):267-73. 75. Khader M, Eckl PM, Bresgen N. Effects of aqueous extracts of medicinal plants on MNNG-treated rat hepatocytes in primary cultures. J Ethnopharmacol 2007; 112(1):199-202. 76. Wu WH, Liu LY, Chung CJ i wsp. Estrogenic effect of yam ingestion in healthy postmenopausal women. J Am Coll Nutr 2005; 24 (4):235-43.



