© Borgis - Postępy Nauk Medycznych 5/2012, s. 446-450
*Magdalena Jarząbek1, Tomasz Jargiełło1, Marzena Janczarek1, Krzysztof Pyra1, Andrzej Wolski2, Anna Budzyńska1, Małgorzata Szczerbo-Trojanowska1
Leczenie guzów przerzutowych w wątrobie za pomocą wewnątrznaczyniowej chemoembolizacji z użyciem mikrocząstek nasączonych cytostatykiem (DEM-TACE)
Transarterial chemoembolisation using drug-eluting microspheres (DEM-TACE) in patients suffering liver metastatic disease
1Zakład Radiologii Zabiegowej i Neuroradiologii Uniwersytetu Medycznego w Lublinie
Kierownik Zakładu: prof. dr hab. med. Małgorzata Szczerbo-Trojanowska
2Oddział Chirurgii Naczyń Samodzielnego Publicznego Szpitala Klinicznego nr 4 w Lublinie
Ordynator Oddziału: dr hab. med. Andrzej Wolski
Streszczenie
Wstęp. Wątroba jest jednym z najczęstszych narządów, w których dochodzi do rozwinięcia procesów nowotworowych zarówno pierwotnych, jak i przerzutowych.
Jedną z obecnie stosowanych metod leczenia nieoperacyjnych guzów przerzutowych w wątrobie jest wybiórcze podanie chemioterapeutyku do naczyń guza z jednoczesnym, celowanym ich zamknięciem – chemoembolizacja (transarterial chemoembolisation – TACE).
Cel. Celem pracy jest ocena skuteczności i efektów ubocznych wybiórczego, bezpośredniego podania mikrocząstek nasączonych cytostatykiem do naczyń w nieoperacyjnych guzach przerzutowych wątroby i wykonania wewnątrznaczyniowego zabiegu chemoembolizacji (drug-eluting microspheres transarterial chemoembolisation – DEM-TACE).
Materiał i metody. Wewnątrznaczyniową chemoembolizację przerzutów do wątroby przeprowadzono u 19 chorych (w wieku 47-85 lat) z użyciem mikrocząstek Hepasphere nasączonych doksorubicyną. Wyniki leczenia oceniano w oparciu o badanie MR po podaniu paramagnetyku i sekwencjach dyfuzji (DWI). W celu oceny jakości życia chorych po zabiegu przeprowadzono ankietę Systemu Oceny Objawów Edmontona (ESAS).
Wyniki. Zabieg chemoembolizacji z powodzeniem przeprowadzono w 89,5% przypadków. Według kryteriów skali RECIST 1.1 z 16 chorych, u których wykonano kontrolne badanie MR, kontrolę nad procesem nowotworowym uzyskano w 62,5%. Podczas i po zabiegu nie zaobserwowano poważnych powikłań. W 84% przypadków wystąpił u chorych zespół poembolizacyjny. Według ankiety ESAS jakość życia poprawiła się u 95% leczonych.
Wnioski. Wstępne wyniki wskazują, iż chemoembolizacja jest małoinwazyjną i bezpieczną metodą leczenia paliatywnego u chorych z przerzutami do wątroby. U ponad połowy chorych chemoembolizacja pozwala uzyskać kontrolę nad procesem nowotworowym i w ponad 90% poprawia jakość życia.
Summary
Introduction. Liver is one of the major organs suffering from primary and metastatic tumour spread. One of the methods used in nowadays treatment for unresectable metastases in the liver is selective chemotheraputic drug injection with simultaneous closure of the tumour vessels – transarterial chemoembolisation (TACE).
The purpose of this study was to evaluate safety and efficacy of selective, local injection of microparticles soaked with chemiotherapeutic drug into tumour arteries to perform drug-eluting microspheres transarterial chemoembolization (DEM-TACE).
Material and methods. Transarterial chemoembolisation of metastatic lesions localised in the liver was performed in 19 patients (47-85 y.o.) The procedure was done using Hepasphere soaked with doxorubicine. Results of the treatment were assessed during control MRI with paramagnetic contrast and diffusion sequences (DWI). To determine the quality of life after the treatment Edmonton Symptom Assessment System (ESAS) was used.
Results. Successful embolisation was performed in 89.5% of cases. According to RECIST 1.1 criteria among 16 patients who reported to the hospital for MRI, control of the neoplastic spread in the liver was achived in 62.5% of patients. During and after the procedure there were no major complications. In 84% of patients postembolic syndrom was present. According to ESAS the quality of life was improved in 95% of treated patients.
Conclusions. Primary results showed, that chemoembolisation is minimally invasive and safe method of palliative treatment in patients with spread metastatic disaese in the liver. Chemoembolisation results in positive response in more than half of patients after the procedure and more than 90% of patients’ quality of life improves.

Wstęp
Nieustanny wzrost zachorowalności na nowotwory na świecie powoduje, iż stały się one chorobą cywilizacyjną i według Światowej Organizacji Zdrowia zajmują obecnie drugie miejsce wśród przyczyn śmierci, po chorobie niedokrwiennej serca.
Wątroba, ze względu na swoją anatomię i pełnione funkcje, jest narządem, w którym bardzo często dochodzi do rozwoju ognisk przerzutowych, głównie z gruczolakoraków przewodu pokarmowego (jelit, żołądka, pęcherzyka żółciowego, dróg żółciowych), raka płuc, raków płaskonabłonkowych (np. przełyku), raka tarczycy, trzustki, piersi, nerki i innych.
Mimo wzrastającej świadomości społeczeństwa oraz lepszych możliwości diagnostycznych, chorzy z zaawansowaną chorobą nowotworową należą do dużej grupy osób zgłaszających się do szpitala. Jeżeli nowotwór pierwotny nie został chirurgicznie usunięty przed wystąpieniem przerzutów lub przerzuty występują już w trakcie rozpoznania, szansa na radykalne leczenie znacznie maleje. Do powodów dyskwalifikacji leczenia chirurgicznego należy zdekompensowana niewydolność wątroby, zbyt rozległy obszar guza, sąsiedztwo lub naciekanie dużych naczyń oraz choroby towarzyszące. Dla tych chorych jedyną opcją jest leczenie paliatywne.
Problem stanowi jednak skuteczność chemioterapii ogólnej, której efekt terapeutyczny jest zwykle niesatysfakcjonujący, a jakość życia obniża się (1, 2). Wśród metod ablacji, jak dotąd, najszersze zastosowanie posiada termoablacja (Radiofrequency Ablation – RFA), jednak jej ograniczeniem jest skuteczność leczenia nowotworów do 3 cm średnicy (3, 4).
Obecnie prowadzone są badania nad skutecznością różnych technik przezskórnej chemoembolizacji (transarterial chemoembolisation – TACE) oraz radioembolizacji. Podstawą tych metod jest wykorzystanie zjawiska angiogenezy w obrębie nowotworu i tętniczego unaczynienia guza przy drożnym układzie wrotnym, zaopatrującym zdrową tkankę wątroby.
Przeprowadziliśmy badanie, wykonując wewnątrznaczyniowy zabieg chemoembolizacji z użyciem mikrocząstek nasączonych cytostatykiem (drug-eluting microspheres transarterial chemoembolisation – DEM-TACE) w celu oceny skutków leczenia chorych z nieoperacyjnymi przerzutami do wątroby.
Materiał i metody
Dziewiętnastu chorych z przerzutami do wątroby (12 kobiet i 7 mężczyzn) zostało poddanych zabiegowi chemoembolizacji z użyciem mikrocząstek Hepasphere, nasączonych doksorubicyną. Średnia wielkość zmian przerzutowych w najdłuższej osi wynosiła 61 mm (15-113 mm). Chorzy byli zdyskwalifikowani od leczenia chirurgicznego oraz od termoablacji. Średnia wieku w grupie badanej wynosiła 68,5 lat (47-85 r.ż.). DEM-TACE poddani byli chorzy z wydolnością wątroby w skali Child-Pough A i B.
Do nowotworów pierwotnych, z których pochodziły przerzuty należały: gruczolakorak jelita grubego, dróg żółciowych, żołądka, pęcherzyka żółciowego, płuc i trzustki, GIST, rak nerki, sutka i krtani. U wszystkich chorych, z wyjątkiem czterech, zastosowano uprzednio chemioterapię ogólną. 52,6% chorych było po radykalnej resekcji guza pierwotnego, a ośmiu miało przerzuty także poza wątrobą.
Kwalifikacja chorych oraz kontrola po zabiegu odbywały się na podstawie oceny obrazów rezonansu magnetycznego (MR) z podaniem paramagnetyku oraz z sekwencjami dyfuzji (DWI). W celu oceny jakości życia po zabiegu przeprowadzono ankietę Systemu Oceny Objawów Edmontona (Edmonton Symptom Assessment System – ESAS).
Do kryteriów dyskwalifikacji od zabiegu należała przynależność do grupy C w skali Child-Pough, zakrzepica żyły wrotnej, obszar guza przekraczający 70% miąższu wątroby oraz nieprawidłowe wartości kreatyniny i GFR, wskazujące na zagrożenie niewydolnością nerek.
Według ustalonego protokołu zabiegu, przed interwencją, choremu była podawana jedna dawka cefalosporyny II lub III generacji, 2 litry płynów w infuzji (1000 ml NaCl oraz 1000 ml 5% glukozy) przed zabiegiem i po zabiegu oraz 8 mg deksametazonu po zabiegu. W razie potrzeby stosowane były środki przeciwbólowe i przeciwwymiotne, w celu leczenia zespołu poembolizacyjnego.
Zabieg chemoembolizacji przeprowadzany był za pomocą mikrocząstek Hepasphere (Biosphere Medical, Inc.) 50-100 μm w formie suchej, które po nasączeniu doksorubicyną i zetknięciu ze środowiskiem jonowym pęcznieją do średnicy 200-400 μm. Przed każdym zabiegiem przygotowywane były dwie fiolki Hepasphere i inkubowane z doksorubicyną w dawce 100 mg (50 mg/1 fiolka) przez godzinę.
Zabieg poprzedzało badanie angiograficzne aorty, pnia trzewnego oraz tętnicy krezkowej, w celu uwidocznienia zaopatrzenia tętniczego zmiany rozrostowej. Celem selektywnej chemoembolizacji stosowany był mikrocewnik Progreat (Terumo) (ryc. 1A, B). Aby zmniejszyć dolegliwości bólowe podczas zabiegu podawana była morfina w dawkach podzielonych.
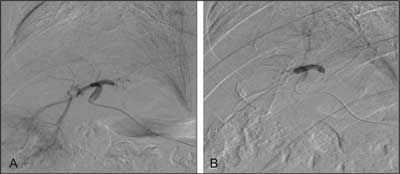
Ryc. 1. Selektywna angiografia gałęzi prawej tętnicy wątrobowej z widocznymi patologicznymi naczyniami zaopatrującymi zmianę przerzutową z raka drobnokomórkowego płuc (A). Kontrolna angiografia tej samej gałęzi bezpośrednio po zabiegu chemoembolizacji. Brak przepływu w tętnicach (B).
Ponowny zabieg przeprowadzany był w przypadku progresji, stabilnej choroby lub pojawienia się wzmocnienia w miejscu zmiany, widocznego w czasie kontroli. Kontrolne badanie MR było wykonywane średnio około 7 tygodni po zabiegu (ryc. 2A, B). Oceniano również długość pobytu chorego w szpitalu, efekty uboczne i powikłania po zabiegu oraz remisję lub progresję choroby według skali RECIST 1.1.
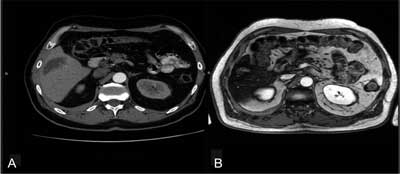
Ryc. 2. Badanie tomografii komputerowej chorego z przerzutami w wątrobie z raka drobnokomórkowego płuc przed zabiegiem TACE. (A) badanie rezonansu magnetycznego w czasie kontroli, 7 tygodni po zabiegu chemoembolizacji. Regresja zmiany (B).
Wyniki
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Gish RG, Porta C, Lazar L et al.: Phase III randomized controlled trial comparing the survival of patients with unresectable hepatocellular carcinoma treated with nolatrexed or doxorubicin. J Clin Oncol 2007; 25: 3069-3075. doi: 10.1200/JCO.2006.08.4046.
2. Aliberti C, Benea G, Tilli M et al.: Chemoembolization (TACE) of unresectable intrahepatic cholangiocarcinoma with slow-release doxorubicin-eluting beads: preliminary results. Cardiovasc Intervent Radiol 2008 Sep-Oct; 31 (5): 883-8.
3. Salhab M, Canelo R: An overview of evidence-based management of hepatocellular carcinoma: a meta-analysis. J Cancer Res Ther 2011 Oct-Dec; 7 (4): 463-75.
4. Yun BL, Lee JM, Baek JH et al.: Radiofrequency ablation for treating liver metastases from a non-colorectal origin. Korean J Radiol 2011 Sep-Oct; 12 (5): 579-87. Epub 2011 Aug 24.
5. Bilbao JI, de Luis E, García de Jalón JA et al.: Comparative study of four different spherical embolic particles in an animal model: a morphologic and histologic evaluation. Vasc Interv Radiol 2008 Nov; 19 (11): 1625-38.
6. Vogl TJ, Lammer J, Lencioni R et al.: Liver, gastrointestinal, and cardiac toxicity in intermediate hepatocellular carcinoma treated with PRECISION TACE with drug-eluting beads: results from the PRECISION V randomized trial. AJR Am J Roentgenol 2011 Oct; 197 (4): W562-70.
7. Jordan O, Denys A, De Baere T et al.: Comparative study of chemoembolization loadable beads: in vitro drug release and physical properties of DC bead and hepasphere loaded with doxorubicin and irinotecan. J Vasc Interv Radiol 2010 Jul; 21 (7): 1084-90.
8. Lammer J, Malagari K, Vogl T et al.: Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma: results of the PRECISION V study. Cardiovasc Intervent Radiol 2010 Feb; 33 (1): 41-52.
9. Llovet JM, Fuster J, Bruix J: Barcelona-Clínic Liver Cancer Group.: The Barcelona approach: diagnosis, staging, and treatment of hepatocellular carcinoma. Liver Transpl 2004 Feb; 10 (2 Suppl 1): S115-20.
10. Martin RC, Joshi J, Robbins K et al.: Hepatic Intra-Arterial Injection of Drug-Eluting Bead, Irinotecan (DEBIRI) in Unresectable Colorectal Liver Metastases Refractory to Systemic Chemotherapy: Results of Multi-Institutional Study. Ann Surg Oncol 2011 Jan; 18 (1): 192-8.
11. Aliberti C, Benea G, Tilli M et al.: Chemoembolization (TACE) of unresectable intrahepatic cholangiocarcinoma with slow-release doxorubicin-eluting beads: preliminary results. Cardiovasc Intervent Radiol 2008 Sep-Oct; 31 (5): 883-8.
12. Fiorentini G, Aliberti C, Del Conte A et al.: Intra-arterial hepatic chemoembolization (TACE) of liver metastases from ocular melanoma with slow-release irinotecan-eluting beads. Early results of a phase II clinical study. In Vivo. 2009 Jan-Feb; 23 (1): 131-7.
13. Poggi G, Quaretti P, Minoia C et al.: Transhepatic arterial chemoembolization with oxaliplatin-eluting microspheres (OEM-TACE) for unresectable hepatic tumors. Anticancer Res 2008 Nov-Dec; 28 (6B): 3835-42.
14. Bruix J, Sherman M: Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma. Hepatology 2005; 42: 1208-1236. doi: 10.1002/hep.20933.
15. Lencioni R: Loco-regional treatment of hepatocellular carcinoma. Hepatology 2010 Aug; 52 (2): 762-73.


