© Borgis - Postępy Fitoterapii 3/2012, s. 162-172
*Agnieszka Galanty, Paulina Koczurkiewicz, Dorota Burakowska, Zbigniew Janeczko
Aktywność biologiczna i farmakologiczna kwasu usninowego
Biological and pharmacological activity of usnic acid
Katedra Farmakognozji Collegium Medicum, Uniwersytet Jagielloński w Krakowie
Kierownik Katedry: prof. dr hab. Zbigniew Janeczko
Summary
Usnic acid is one of the most known and extensively studied lichen secondary metabolites. It was found only in lichen species, especially from the genus Cladonia, Usnea, Lecanora, Ramalina, Evernia or Parmelia. The compound is a yellow, crystal dibenzofurane derivative (2,6-diacetyl-7,9-dihydroxy-8,9b-dimethyl-1,3(2H,9bH)-dibenzo-furandione), easily dissolved in organic solvents but not in water. As a pure compound it can be found in toothpaste and deodorants, where it reveals antimicrobial properties. Usnic acid has been shown also antiviral, antiprotozoal, cytotoxic and antiproliferative, anti-inflammatory and analgesic activity. Some differences in biological and pharmacological activity can be sometimes observed between the two enantiomers of the compound. Usnic acid is also used for weight reduction, but with dangerous side effects. In this review the emphasis is on the biological and pharmacological activity of usnic acid and also on its pharmacokinetics and some toxic effects.

Wprowadzenie
Kwas usninowy jest najbardziej znanym i opisywanym metabolitem porostowym. Pierwsze doniesienia o tym związku sięgają roku 1844, kiedy to Knop opisał izolację tego związku i jego podstawowe własności fizykochemiczne (1). Związek ten badany jest pod kątem potencjalnego wykorzystania w farmacji, biotechnologii, kosmetologii, a nawet rolnictwie.
Kwas usninowy jest związkiem izolowanym jak dotąd wyłącznie z porostów. Występuje w wielu rodzinach i rodzajach porostów, najczęściej rozpowszechniony jest w rodzajach Cladonia, Usnea, Lecanora, Ramalina, Evernia, Parmelia i Alectoria (1). Zawartość tego związku w różnych gatunkach waha się od 0,006% w Parmelia soredians (2) do 5,30% w Flavocetraria nivalis (3).
Własności fizykochemiczne
Kwas usninowy jest pochodną dibezofuranu (2,6-diacetylo-7,9-dihydroksy-8,9b-dimetylo-1,3(2H,9bH)-dibenzo-furandion), o wzorze sumarycznym C18H16O7. Jest to krystaliczna, żółta substancja, optycznie czynna, o temperaturze topnienia 203-204°C (4). Występuje w formie dwóch enancjomerów, różniących się położeniem grupy metylowej w pozycji 9b (5). Poza enancjomerami kwasu usninowego, w porostach występują również inne izomery: kwas (+)- i (–)-izousinowy (ryc. 1).
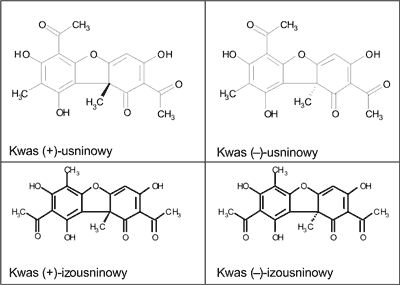
Ryc. 1. Enancjomery kwasu usninowego i izousninowego.
Kwas usninowy rozpuszcza się dobrze w benzenie, chloroformie, alkoholu amylowym i lodowatym kwasie octowym, jest słabo rozpuszczalny w etanolu, eterze naftowym i eterze dietylowym, natomiast nierozpuszczalny w wodzie (6). Do celów badania aktywności biologicznej i farmakologicznej in vitro niektórzy autorzy wskazują na 2-hydroksypropylo-β-cyklodekstrynę jako optymalny rozpuszczalnik (7). Biogenetycznie kwas usninowy wywodzi się ze szlaku acetylo-polimalynolowego.
Syntezy kwasu usninowego dokonali w 1956 roku Barton i wsp. (8) poprzez oksydatywne sprzężenie metylofluoroacetofenonu z żelazocyjankiem potasu. Uzyskany w ten sposób dimer acetylowano do postaci dioctanu kwasu usninowego, który po hydrolizie dał kwas usninowy. Proces ten opisano dla obu enancjomerów (8). Udowodniono również, że kwas usninowy może być wytwarzany w warunkach in vitro przez hodowle tkankowe Cladonia substellata (9).
Aktywność biologiczna i farmakologiczna
Aktywność przeciwbakteryjna
Aktywność przeciwbakteryjną in vitro kwasu usninowego zbadano wobec szeregu szczepów bakterii zarówno Gram-dodatnich, jak i Gram-ujemnych. W większości przypadków przedmiotem badań był enancjomer (+) (10-16), w jednej pracy opisano aktywność kwasu (–)-usninowego (17), a w innej porównano aktywność obu enancjomerów (18). Zestawienie aktywności przeciwbakteryjnej kwasu usninowego przedstawia tabela 1.
Tabela 1. Aktywność przeciwbakteryjna in vitro kwasu usninowego.
| Szczep | Aktywność
kwasu (+)-usninowego | Aktywność
kwasu (–)-usninowego | Pozycja
piśmiennictwa |
| Aeromonas hydrophila | –
na | MIC 1,2 μg
– | 17
16 |
| Bacillus cereus | MIC 6,9 μg/ml
–
na | –
MIC 0,15 μg
– | 23
17
16 |
| Bacillus megaterium | MIC 7,7 μg/ml
IZ 10 mm (50 μg) | –
– | 23
12 |
| Bacillus subtilis | –
MIC 6,3 μg/ml
IZ 23 mm (250 μg)
IZ 10 mm (60 μg)
na
MIC 0,036 mmol | MIC 0,61 μg
–
–
–
–
– | 17
23
14
11
15
16 |
| Bacteroides thetaiotamicron | MIC 4 μg/ml | MIC 8 μg/ml | 18 |
| Bacteroides vulgatus | MIC 4 μg/ml | MIC 8 μg/ml | 18 |
| Bacteroides fragilis | MIC 2 μg/ml | MIC 1 μg/ml | 18 |
| Bacteroides ruminicola ssp. brevis | MIC 8 μg/ml | MIC 16 μg/ml | 18 |
| Bacteroides loeschii | MIC 2 μg/ml | MIC 2 μg/ml | 18 |
| Clostridium perfringens | MIC 4 μg/ml | MIC 4 μg/ml | 18 |
| Enterococcus faecalis | MIC 4-8 μg/ml | MIC 4-16 μg/ml | 18 |
| Enterococcus faecium | MIC 4-16 μg/ml | MIC 4-16 μg/ml | 18 |
| Escherichia coli | MIC 4,9 μg/ml
na
na
IZ 5 mm (250 μg)
na | –
–
–
–
– | 23
11
12
14
16 |
| Klebsiella pneumoniae | na | – | 16 |
| Listeria monocytogenes | –
MIC 0,018 mmol | MIC 0,31 μg
– | 17
16 |
| Mycobacterium aurum | MIC 32 μg/ml | – | 13 |
| Propionibacterium acnes | MIC 2 μg/ml | MIC 2 μg/ml | 18 |
| Proteus vulgaris | –
MIC 0,036 mmol | MIC 0,15 μg
– | 17
16 |
| Pseudomonas aeruginosa | MIC 5,2 μg/ml
na
IZ 5 mm (250 μg)
na | –
–
–
– | 23
11
14
16 |
| Pseudomonas syringae | na | – | 16 |
| Salmonella choleraesius | MIC 6,3 μg/ml | – | 23 |
| Salmonella enterica typhi | MIC 8,2 μg/ml | – | 23 |
| Salmonella enterica typhimurium | MIC 5,4 μg/ml | – | 23 |
| Salmonella typhimurium | na | – | 16 |
| Sarcina lutea | MIC 19,1 μg/ml | – | 23 |
| Staphylococcus aureus | MIC 8,3 μg/ml
–
MIC 6,06 μg/ml
MIC 0,15 mmol
MIC 2-16 μg/ml | –
MIC 2,4 μg
–
–
MIC 2-16 μg/ml | 23
17
15
16
18 |
| Streptococcus faecalis | –
MIC 0,073 mmol | MIC 0,15 μg
– | 17
16 |
| Yersinia enterocolitica | MIC 0,018 mmol | – | 16 |
| MIC – minimalne stężenie hamujące, IZ – strefa zahamowania, na – nieaktywny |
Kwas usninowy wykazał zróżnicowaną, od słabej po umiarkowaną, aktywność przeciwbakteryjną zarówno wobec szczepów Gram-dodatnich, jak i Gram-ujemnych. Aktywność obydwu enancjomerów była identyczna w przypadku szczepów Clostridium, Propionibacterium i Staphylococcus; wobec szczepów Bacillus i Aeromonas kwas (–)-usninowy wykazał wyższą aktywność od enancjomeru (+), natomiast w pozostałych przypadkach kwas (+)-usninowy był bardziej aktywny.
Interesujący przykład praktycznego wykorzystania aktywności przeciwbakteryjnej kwasu usninowego opisali Francolini i wsp. (19). Badali on wpływ kwasu usninowego na adhezję bakterii na powierzchni polimerów, z których tworzone są urządzenia i drobny sprzęt medyczny. W tym celu dodawano kwas usninowy do poliuretanu, a następnie określano jego zdolność do hamowania powstawania biofilmu bakteryjnego (Staphylococcus aureus, Pseudomonas aeruginosa) na jego powierzchni. Jako kontrolę stosowano poliuretan bez dodatku kwasu usninowego. Zabieg dodania kwasu usninowego nie spowodował istotnego zmniejszenia adhezji komórek bakterii do poliuretanu, natomiast wykazywał aktywność przeciwbakteryjną wobec bakterii już przylegających. W przypadku biofilmu wytworzonego przez Pseudomonas aeruginosa, kwas usninowy powodował wyraźne zmiany w strukturze warstwy bakteryjnej (19).
Aktywność przeciwwirusowa
Kwas usninowy w nielicznych badaniach wykazał słabą aktywność przeciwwirusową wobec wirusów HSV (Herpes simplex typu 1) i PSV1 (wirus polio typu 1), powodując ponad 4-milimetrową strefę zahamowania wzrostu w stężeniu 30 μg/krążek, a w przypadku wirusa HSV również w stężeniu 7,5 μg/krążek (11). W kilku przypadkach opisano wpływ kwasu usninowego na enzymy wirusowe, takie jak integraza czy odwrotna transkryptaza, jak również badano wpływ tego związku na kwasy nukleinowe mysiego wirusa poliomy. Stwierdzono, że kwas usninowy wykazywał słabą aktywność hamującą aktywność integrazy wirusa HIV-1; wartość IC50 wynosiła 126,4 μM (20), natomiast w stężeniu 50 μg/ml nie wykazał aktywności hamującej wobec odwrotnej transkryptazy wirusa HIV-1 (12).
Jedno doniesienie opisuje badanie wpływu kwasu usninowego, podawanego łącznie z siarczanem cynku, u 100 pacjentek cierpiących na zakażenie układu płciowego wirusem brodawczaka HPV, będących po zabiegach chirurgicznych. Pacjentki podzielono na trzy grupy: kontrolną, nieotrzymującą żadnych środków po leczeniu chirurgicznym, grupę otrzymującą dopochwowo kwas usninowy i siarczan cynku przed zabiegiem i po zabiegu chirurgicznym oraz trzecią grupę, otrzymującą te związki tylko po zabiegu. Oceniano stan uszkodzeń wywołanych wirusem po 1, 2, 3 i 6 miesiącach od zabiegu. W obu grupach otrzymujących kwas usninowy i siarczan cynku zaobserwowano lepsze gojenie się nabłonka dróg rodnych w odniesieniu do grupy kontrolnej; zjawisko to było proporcjonalne do upływającego czasu. W grupie drugiej, której podawano oba związki przed zabiegiem i po zabiegu, reepitelizacja była bardziej efektywna i obejmowała krótszy czas w porównaniu do grupy trzeciej (21).
Aktywność przeciwgrzybicza
Aktywność przeciwgrzybiczą kwasu usninowego zbadano wobec szeregu szczepów, będących zarówno patogenami ludzkimi, jak i roślinnymi, a także wobec gatunków niepatogennych. W większości przypadków badano kwas (+)-usninowy (11, 12, 14-16, 22), jedna praca dotyczyła aktywności kwasu (–)-usninowego (17). Obydwa enancjomery charakteryzowały się zróżnicowaną aktywnością przeciwgrzybiczą wobec większości badanych szczepów, od słabej (11, 12, 14) poprzez umiarkowaną (22), po wysoką (16, 17). Zestawienie aktywności przeciwgrzybiczej kwasu usninowego przedstawiono w tabeli 2.
Tabela 2. Aktywność przeciwgrzybicza in vitro kwasu usninowego.
| Szczep | Aktywność kwasu
(+)-usninowego | Aktywność kwasu
(–)-usninowego | Pozycja
piśmiennictwa |
| Alternaria brassicicola | MIC 32,1 μg/ml | – | 23 |
| Aspergillus flavus | MIC 20,1 μg/ml | – | 23 |
| Aspergillus nidulans | MIC 14,3 μg/ml | – | 23 |
| Aspergillus niger | MIC 5,8 μg/ml
IZ 5 mm (250 μg) | –
– | 23
14 |
| Aspergillus ochraceus | MIC 11,3 μg/ml | – | 23 |
| Aspergillus sojae | MIC 6,4 μg/ml | – | 23 |
| Candida albicans | MIC 21,4 μg/ml
IZ 1 mm (60 μg)
MIC 0,002 mmol
– | –
–
–
MIC 0,15 μg | 23
11
16
17 |
| Candida glabrata | MIC 29,2 μg/ml
MIC 0,002 mmol
– | –
–
MIC 0,15 μg | 23
16
17 |
| Candida krusei | MIC 30,1 μg/ml | – | 23 |
| Candida tropicalis | MIC 20,9 μg/ml | – | 23 |
| Eurotium repens | IZ 1 mm (50 μg) | – | 12 |
| Fusarium moniliforme | MIC 18,6 μg/ml | – | 23 |
| Fusarium oxysporum | na | – | 12 |
| Mycotypha microspora | IZ 3 mm (50 μg) | – | 12 |
| Saccharomyces cerevisiae | na | – | 15 |
| Trichoderma viridae | MIC 14,2 μg/ml | – | 23 |
| Trichophyton mentagrophytes | MIC 18,0 μg/ml
IZ 5 mm (60 μg) | –
– | 23
11 |
| Ustilago violacea | IZ 1mm (50 μg) | – | 12 |
| MIC – minimalne stężenie hamujące, IZ – strefa zahamowania, na – nieaktywny |
Aktywność przeciwpierwotniakowa
Aktywność przeciwpierwotniakową kwasu usninowego zbadano w warunkach in vitro wobec Trypanosoma cruzi, Plasmodium falciparum oraz Leishmania amazonensis. Wobec ostatniego gatunku aktywność kwasu usninowego zbadano również in vivo, na modelu mysim.
W badaniach in vitro kwas usninowy wykazał aktywność hamującą wzrost pierwotniaka Trypanosoma cruzi w zakresie stężeń od 10 do 50 μg/ml (23). Zarówno kwas (+)-usinowy, jak i (–)-usninowy wykazały słabą aktywność przeciwpierwotniakową wobec Plasmodium falciparum; wartości IC50 wynosiły odpowiednio 15,3 i 16,1 μmol, podczas gdy dla substancji referencyjnej (chlorochina) aktywność ta wynosiła 0,089 μmol (24). W badaniu innych autorów kwas usninowy w stężeniu 50 μg/ml nie wykazał aktywności przeciwmalarycznej (12). Kwas (+)-usninowy, izolowany z Protousnea malacea, odznaczał się aktywnością przeciwpierwotniakową wobec Leishmania amazonensis w stężeniu 25 μg/ml (25).
W badaniach in vivo kwas (+)-usninowy w stężeniu 25 mg/kg masy ciała podawano myszom zakażonym Leishmania amazonensis, dwa razy dziennie przez 15 dni (doustnie), raz dziennie przez 15 dni (podskórnie) lub w pięciu iniekcjach z 4-dniowymi przerwami, bezpośrednio w zakażone miejsce. Kwas usninowy podawany miejscowo, bezpośrednio w miejsce zakażenia, wykazał znaczący efekt zmniejszający obszar zakażenia o 43,34% oraz liczbę pasożytów o 72,28%, w porównaniu do grupy nieotrzymującej żadnego środka. Podawanie badanego związku pozostałymi drogami nie dało efektów (25).
Działanie fotoochronne
Kwas usninowy został również zbadany pod kątem potencjalnych własności fotoochronnych zarówno na modelach zwierzęcych (26), jak i na zdrowych ochotnikach, u których porównywano aktywność tego związku, chroniącą przed wpływem promieniowania UV, z działaniem kosmetyku stosowanego jako filtr przeciwsłoneczny (27).
W badaniach przeprowadzonych na świnkach morskich wykazano wysoką aktywność fotoochronną kwasu usninowego podawanego w ilości 2 mg/cm2 skóry pozbawionej włosów – wyliczona wartość czynnika SPF wynosiła 8,0 ± 0,15, podczas gdy standardowy związek wykazał SPF = 4,3 ± 0,20 (26).
Badania aktywności fotoochronnej kwasu usninowego w warunkach in vivo przeprowadzono na 5 zdrowych ochotnikach. Kwas usninowy w stężeniu 2,5 x 10-2 mol rozpuszczono w mieszaninie glikolu propylenowego i chloroformu (1:1), a następnie nanoszono na niewielki (12 cm2) fragment skóry pleców ochotników. Po odparowaniu chloroformu naniesiony roztwór tworzył cienką warstwę na skórze, którą naświetlano promieniami UV 295-340 nm. Kwas usninowy wykazał aktywność porównywalną z działaniem Nivea Sun Spray LSF 5; wyliczone średnie wartości czynnika UVP (ochrona przed promieniowaniem UV) wynosiły odpowiednio 4,1 i 4,2 (27).
Aktywność przeciwzapalna, przeciwbólowa i przeciwgorączkowa
Aktywność przeciwzapalna kwasu usninowego została przebadana zarówno w warunkach in vitro (29), jak i na modelu zwierzęcym (29). Prace o podobnym charakterze opisują wpływ przeciwbólowy i przeciwgorączkowy (30) kwasu usninowego w badaniach na zwierzętach. Kwas usninowy wykazywał aktywność porównywalną ze stosowanymi w eksperymentach substancjami referencyjnymi.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Ingolfsdottir K. Molecules of interest: usnic acid. Phytochem 2002; 61:729-36. 2. Caviglia AM, Nicora P, Giordani P i wsp. Oxidative stress and usnic acid content in Parmelia caperata and Parmelia soredians. Farmaco 2001; 56:379-82. 3. Bjerke JW, Elvebakk A, Dominguez E i wsp. Seasonal trends in usnic acid concentrations of Arctic, alpine and Patagonian populations of the lichen Flavocetraria nivalis. Phytochem 2005; 66:337-44. 4. Culberson CF. Chemical and botanical guide to lichen products. The University of North Carolina Press 1969; Reprint by Otto Koeltz Science Publishers, Koenigstein, 1979. 5. Cocchietto M, Skert N, Nimis PL i wsp. A review on usnic acid, an interesting natural compound. Naturwissen 2002; 89:137-46. 6. Podterob AP. Chemical composition of lichens and their medicinal applications. Pharm Chem J 2008; 42:582-8. 7. Kristmundsdottir T, Jonsdottir E, Ogmundsdottir HM i wsp. Solubilization of poorly soluble lichen metabolites for biological testing on cell lines. Eur J Pharm Sci 2005; 24:539-43. 8. Barton DHR, Deflorin AM, Edwards OE. The synthesis of usnic acid. J Chem Soc 1956; 530-4. 9. Pereira EC, Pereyra T, Matos SC i wsp. Bioproduction of usnic acid from acetate by kaolinite immobilized cells of Cladonia substellata Vain. Acta Soc Bot Pol 1995; 64:171-4. 10. Honda NK, Pavan FR, Coelho RG i wsp. Antimycobacterial activity of lichen substances. Phytomed 2010; 17:328-32. 11. Perry NB, Benn MH, Brennan NJ i wsp. Antimicrobial, antiviral and cytotoxic activity of New Zeland lichens. Lichenol 1999; 31:627-36. 12. König GM, Wright AD. 1H and 13C-NMR and biological activity investigations of four lichen-derived compounds. Phytochem Anal 1999; 10:279-84. 13. Ingolfsdottir K, Chung GAC, Skulason VG i wsp. Antimycobacterial activity of lichen substances in vitro. Eur J Pharm Sci 1998; 6:141-4. 14. Natić M, Tešić Z, Andelković K i wsp. Synthesis and biological activity of Pd(II) and Cu(II) complexes with acylhydrazones of usnic acid. Syn React Inorg Met 2004; 34:101-13. 15. Correche ER, Carrasco M, Escudero ME i wsp. Study of the cytotoxic and antimicrobial activities of usnic acid and derivatives. Fitoter 1998; 69:493-501. 16. Tay T, Türk AÖ, Yilmaz M i wsp. Evaluation of the antimicrobial activity of the acetone extract of the lichen Ramalina farinacea and its (+)-usnic acid, norstictic acid and protocetraric acid constituents. Z Naturforsch 2004; 59c:384-8. 17. Yilmaz M, Türk AÖ, Tay T i wsp. The antimicrobial activity of extracts of the lichen Cladonia foliacea and its (–)-usnic acid, atranorin and fumarprotocetraric acid constituents. Z Naturforsch 2004; 59c:249-54. 18. Lauterwein M, Oethinger M, Belsner K i wsp. In vitro activities of the lichen secondary metabolites vulpinic acid, (+)- and (–)-usnic acid against aerobic and anaerobic microorganisms. Antimicrob Agents Chem 1995; 2541-3. 19. Francolini I, Norris P, Piozzi A i wsp. Usnic acid, a natural antimicrobial agent able to inhibit bacterial biofilm formation on polymer surfaces. Antimicrob Agents Chem 2004; 11: 4360-5. 20. Neamati N, Hong H, Mazumder A i wsp. Depsides and depsidones as inhibitors of HIV-1 integrase: discovery of novel inhibitors through 3D database searching. J Med Chem 1997; 40:942-51. 21. Scirpa P, Scambia G, Masciullo V i wsp. A zinc sulfate and usnic acid preparation used as post-surgical adjuvant therapy in genital lesions by human papillomavirus. Minerva Ginecol 1999; 51:255-60. 22. Hanuš LO, Temina M, Dembitsky VM. Antibacterial and antifungal activities of some phenolic metabolites isolated from lichenized Ascomycetes Ramalina lacera. Nat Prod Comm 2008; 3:233-6. 23. De Carvalho EAB, Andrade PP, Silva NH i wsp. Effect of usnic acid from the lichen Cladonia substellata on Trypanosoma cruzi in vitro: an ultrastructural study. Micron 2005; 36:155-61. 24. Verotta L, Appendino G, Bombardelli E i wsp. In vitro antimalarial activity of hyperforin, a prenylated acylphloroglucinol. A structure-activity study. Bioorg Med Chem Lett 2007; 17:1544-8. 25. Fournet A, Ferreira ME, Rojas de Arias A i wsp. Activity of compounds isolated from Chilean lichens against experimental cutaneous leishmaniasis. Comp Biochem Physiol 1997; 116C:51-4. 26. Fernandez E, Quilhot W, Gonzalez I i wsp. Lichen metabolites as UVB filters. Cosmet Toiletries 1996; 111:69-74. 27. Rancan F, Rosana S, Boehmb K i wsp. Protection against UVB irradiation by natural filters extracted from lichens. J Photochem Photobio B 2002; 68:133-9. 28. Jin J, Li C, He L. Down-regulatory effect of usnic acid on nuclear factor-kB-dependent tumor necrosis fator-alpha and inducible nitric oxide synthase expression in lipopolysaccharide-stimulated macrophages RAW 264.7. Phytother Res 2008; 22:1605-9. 29. Vijayakumar CS, Viswanathan S, Kannappa-Reddy M i wsp. Anti-inflammatory activity of (+)-usnic acid. Fitoter 2000; 71:564-6. 30. Okuyama E, Umeyama K, Yamazaki M. Usnic acid and diffractic acid as analgesic and antipyretic components of Usnea diffracta. Planta Med 1995; 61:113-5. 31. Kupchan SM, Kopperman HL. Usnic acid: tumour inhibition isolated from lichens. Experientia 1975; 31:625. 32. Takai M, Uehara Y, Beisler JA. Usnic acid derivatives as potential antineoplastic agents. J Med Chem 1979; 22:1380-4. 33. Bézivin C, Tomasi S, Rouaud I i wsp. Cytotoxic activity of compounds from the lichen: Cladonia convoluta. Planta Med 2004; 70:874-7. 34. Koparal AT, Ayaz-Tüylü B, Türk H. In vitro cytotoxic activities of (+)usnic and (–)usnic acid on V79, A549 and human lymphocyte cells and their non-genotoxicity on human lymphocytes. Nat Prod Res 2006; 20:1300-7. 35. Bazin MA, Le Lamer AC, Delcros JG i wsp. Synthesis and cytotoxic activities of usnic acid derivatives. Bioorgan Med Chem 2008; 16:6860-6. 36. Einarsdottir E, Groeneweg J, Björnsdottir GG i wsp. Cellular mechanisms of the anticancer effects of the lichen compound usnic acid. Planta Med 2010; 76:1-6. 37. Correche ER, Enriz RD, Piovano M i wsp. Cytotoxic and apoptotic effects on hepatocytes of secondary metabolites obtained from lichens. ATLA 2004; 32:605-15. 38. Kumar SKC, Müller K. Lichen metabolites 2: Antiproliferative and cytotoxic activity of gyrophoric, usnic and diffractic acid on human keratinocytes growth. J Nat Prod 1999; 62:821-3. 39. Burlando B, Ranzato E, Volante A i wsp. Antiproliferative effects on tumor cells and promotion of keratinocytes wound healing by different lichen compounds. Planta Med 2009; 75:607-13. 40. Mayer M, O’Neill MA, Murray KE i wsp. Usnic acid: a non-genotoxic compound with anti-cancer properties. Anti-Cancer Drugs 2005; 16: 805-9. 41. O’Neill MA, Mayer M, Murray KE i wsp. Does usnic acid affects microtubules in human cancer cells? Braz J Biol 2010; 70; doi: 10.1590/S1519-69842010005000013. 42. Bačkorová M, Bačkor M, Mikeš J i wsp. Variable responses of different human cancer cells to the lichen compounds parietin, atranorin, usnic acid and gyrophoric acid. Toxicol In Vitro 2011; 25:37-44. 43. Oświecimska M, Sendra J, Janeczko Z. Antimitotic activity of some Cladonia species native in Poland. Part I. Preliminary screening investigations. Herba Pol 1979; 25:317-22. 44. Oświecimska M, Janeczko Z, Sendra J. Antimitotic activity of some Cladonia species native in Poland. Part IV. The biological activity of usnic acid isolated from Cladonia sylvatica L. Hoffm. Herba Pol 1987; 33:212-6. 45. Grzycka K. Badanie aktywności biologicznej niektórych składników plechy Ramalina fraxinea. Acta Pol Pharm 1979; 36:481-5. 46. Ribeiro-Costa RM, Alves AJ, Santos NP. i wsp. In vitro and in vivo properties of usnic acid encapsulated into PLGA-microspheres. J Microencapsul 2004; 21:371-84. 47. Santos LC, Honda NK, Carlos IZ i wsp. Intermediate reactive oxygen and nitrogen from macrophages induced by Brazilian lichens. Fitoter 2004; 75:473-9. 48. Foti RS, Dickmann LJ, Davis LJ i wsp. Metabolism and related human risk factors from hepatic damage by usnic acid containing nutritional supplements. Xenobiot 2008; 38:264-80. 49. Krishna DR, Venkataramana D. Pharmacokinetics of D(+)-usnic acid in rabbits after intravenous and oral administration. Drug Metab Dispos 1992; 20:909-11. 50. Sundset MA, Barboza PS, Green TK i wsp. Microbial degradation of usnic acid in the reindeer rumen. Naturwissen 2010; 97:273-8. 51. Odabasoglu F, Cakir A, Suleymanc H i wsp. Gastroprotective and antioxidant effects of usnic acid on indomethacin-induced gastric ulcer in rats. J Ethnopharmacol 2006; 103:59-65. 52. Abo-Khatwa AN, Al-Robai AA, Al-Jawhari DA. The uncoupling of oxidative phosphorylation of mouse-liver mitochondria in vivo by usnic acid. JKAU 2005; 17:35-45. 53. Pramyothin P, Janthasoot W, Pongnimitprasert N i wsp. Hepatotoxic effect of (+)-usnic acid from Usnea siamensis in rats, isolated rat hepatocytes and isolated rat liver mitochondria. J Ethnopharmacol 2004; 90:381-7. 54. Durazo FA, Lassman C, Han SHB i wsp. Fulminant liver failure due to usnic acid for weight loss. Am J Gastroenterol 2004; doi:10 1111/j.1572-0241.2004.04165.x. 55. Sanchez W, Maple JT, Burgart LJ i wsp. Severe hepatotoxicity associated with use of a dietary supplement containing usnic acid. Mayo Clin Proc 2006; 81:541-4. 56. Hsu LM, Huang YS, Chang FY i wsp. Fat burner herb, usnic acid, induced acute hepatitis in a family. J Gastroenterol Hepatol 2005; 20:1138-9. 57. Favreau JT, Ryu ML, Braunstein G i wsp. Severe hepatotoxicity associated with the dietary supplement LipoKinetix. Ann Intern Med 2002; 136:590-5. 58. Stinchi C, Guerrini V, Ghetti E i wsp. Contact dermatitis from lichens. Conttact Dermat 1997;36:310. 59. Mitchell JC, Armitage JS. Dermatitis venenata from lichens; biology of lichens related to criteria for diagnosis of occupational dermatitis and to industrial exposure risk. Arch Evniron Health 1965; 11:701-9.

