© Borgis - Postępy Fitoterapii 1/2014, s. 32-39
*Mirosława Krauze-Baranowska, Magdalena Majdan, Marta Kula
Owoce maliny właściwej i maliny zachodniej źródłem substancji biologicznie aktywnych**
Fructus red raspberry and black raspberry as a source of biological active substances
Katedra i Zakład Farmakognozji z Ogrodem Roślin Leczniczych, Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej, Gdański Uniwersytet Medyczny
Kierownik Katedry i Zakładu: dr hab. Mirosława Krauze-Baranowska, prof. nadzw.
Summary
Rubus idaeus L. (red raspberry) and Rubus occidentalis L. (black raspberry) are a source of edible fruits containing anthocyanins and ellagitannins. There are over 100 cultivars of red raspberries known across Europe. As opposed to red raspberries, black raspberries are cultivated in North America, mainly on the east coast of USA. The fruits of both species are rich in cyanidin derivatives in the form of mono-, di-, and triglucosides and ellagitannins – mainly ellagic acid derivatives: sanguiin H6 and lambertianin C. These compounds contribute to the biological activity of the fruits of red and black raspberries. In several in vitro and in vivo models antioxidant, antimicrobial and chemopreventive properties of the fruits of both species were confirmed. Research conducted in the recent years indicates the possibility of use of raspberry fruits in treatment of rheumatoid arthritis as well as gastric ulcers.

Rodzaj Rubus L. (jeżyna) (Rosaceae) obejmuje około 17 podrodzajów i 740 gatunków, spośród których około 100 występuje na terenie Europy Zachodniej i Środkowej (1). Do najbardziej znanych i cenionych w Europie przedstawicieli podrodzaju Idaeobatus Focke należy Rubus idaeus L. (malina właściwa) oraz Rubus chamamerosus L. (malina morożka). Natomiast gatunek Rubus occidentalis L. (malina czarna, malina zachodnia), występuje w stanie naturalnym w Ameryce Północnej, głównie we wschodnich stanach USA, gdzie są również prowadzone jego uprawy. Walory smakowe i właściwości odżywcze owoców decydują o dużej popularności maliny właściwej oraz maliny zachodniej. Polska zajmuje pierwsze miejsce w produkcji owoców maliny właściwej w Europie oraz trzecie na świecie (2).
Nazwa gatunku Rubus idaeus, nadana przez Linneusza, wywodzi się od góry Ida (obecnie Turcja), którą intensywnie porastały krzewy malin (3, 4). Owoce maliny właściwej znane były już starożytnym Grekom, około 370 lat p.n.e. Natomiast rosnące w Pompejach krzewy maliny były introdukowane przez Rzymian z terenów południowej Troi około 65 lat p.n.e. Grecki lekarz Hipokrates (460-377 p.n.e.), jak również lekarze rzymscy, wykorzystywali właściwości napotne owoców maliny (3). W dziele Dioskoridesa zatytułowanym „De Materia Medica”, malina właściwa, obok jeżyny, jest źródłem surowców (owoce, liście, pędy), głównie o działaniu ściągającym, przeciwzapalnym oraz przeciwbiegunkowym.
Uprawę maliny właściwej zapoczątkowano w ogródkach przyklasztornych późnego Średniowiecza. Jednak dopiero z końcem XVIII w. są wymieniane pierwsze odmiany hodowlane (3). Obecnie znanych jest kilkaset odmian uprawowych maliny właściwej, głównie o czerwonej barwie owoców, a ich liczba stale wzrasta (2). Maliny w zależności od barwy owoców klasyfikowane są w 3 grupach: odmiany R. idaeus o owocach czerwonych i żółtych – pozbawionych antocyjanów, np. Poranna Rosa oraz o owocach czarnych – odmiany R. occidentalis.
Związkami chemicznymi charakterystycznymi dla owoców Rubus idaeus L. i Rubus occidentalis L. są związki polifenolowe, spośród których dominującymi są elagotaniny i antocyjany. Zespół antocyjanów tworzą formy glikozydowe (mono-, di- i tri-) przede wszystkim pochodne aglikonu cyjanidyny, obok obecnych, w zależności od odmiany, w bardzo niskich i zmiennych stężeniach, pochodnych pelargonidyny, malwinidyny, peonidyny lub delfinidyny (ryc. 1).
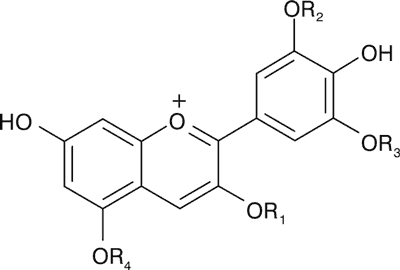 |
| Związek | R1 | R2 | R3 | R4 |
| Cyjanidyna | H | OH | H | H |
| 3-O-Glukozyd cyjanidyny | glukoza | OH | H | H |
| 3-O-Rutynozyd cyjanidyny | glukoza + ramnoza | OH | H | H |
| 3-O-(2G-Glukozylorutynozyd) cyjanidyny | glukoza + ramnoza + glukoza | OH | H | H |
| 3-O-(2G-Ksylozylorutynozyd) cyjanidyny | ksyloza + ramnoza + glukoza | OH | H | H |
| 3-O-Soforozyd cyjanidyny | glukoza + glukoza | OH | H | H |
| 3-O-Sambubiozyd cyjanidyny | glukoza + ksyloza | OH | H | H |
| 3-O-Arabinozyd cyjanidyny | arabinoza | OH | H | H |
| 3,5-O-Diglukozyd cyjanidyny | glukoza | OH | H | glukoza |
| 3-O-Glukozyd pelargonidyny | glukoza | H | H | H |
| 3-O-Rutynozyd pelargonidyny | glukoza + ramnoza | H | H | H |
| 3-O-Soforozyd pelargonidyny | glukoza + glukoza | H | H | H |
| 3-O-(2G-Glukozylorutynozyd) pelargonidyny | glukoza + ramnoza + glukoza | H | H | H |
| 3,5-O-Diglukozyd pelargonidyny | glukoza | H | H | glukoza |
| 3-O-Glukozyd malwidyny | glukoza | OCH3 | OCH3 | H |
| 3-O-Glukozyd delfinidyny | glukoza | OH | OH | H |
| 3-O-Rutynozyd peonidyny | glukoza + ramnoza | OCH3 | H | H |
Ryc. 1. Wzory strukturalne antocyjanów występujących w owocach R. idaeus i R. occidentalis.
Owoce gatunków z rodziny Rosaceae (maliny, truskawki, jeżyny) są bogatym i jedynym źródłem elagotanin w codziennej diecie (5, 6). W obrębie rodzaju Rubus, przede wszystkim w owocach maliny morożki oraz owocach maliny właściwej, elagotaniny stanowią dominującą grupę związków, w przeciwieństwie do rodzaju Fragaria (truskawka), w którym są wymieniane jako główne, ale po antocyjanach (7). Według Landete i wsp. (7) elagotaniny stanowią 85% zespołu związków czynnych owoców maliny właściwej, przy udziale antocyjanów na poziomie około 23% i około 2% innych związków polifenolowych, takich jak flawonoidy, fenolokwasy, czy pochodne flawan-3-olu. W owocach maliny morożki zawartość elagotanin wynosi około 90%, natomiast w owocach truskawki około 30% (7).
Elagotaniny są estrami kwasu heksahydroksydifenylowego (HHDP), węglowodanów (glukoza) i fenolokwasów (kwas chinowy) (5, 8). Jedną z właściwości elagotanin jest ich hydroliza w środowisku kwaśnym i zasadowym, z uwolnieniem HHDP, który przekształca się (laktonizacja) w kwas elagowy (5). Do grupy elagotanin zaliczane są związki o charakterze monomerów, oligomerów oraz złożonych polimerów. W zespole owoców maliny właściwej i maliny zachodniej jest to przede wszystkim sangwina H-6 oraz towarzysząca jej, prawie w trzykrotnie niższych stężeniach, lambertianina C (8). Według Rao i wsp. (9) sangwina H-6 jest tetramerem, utworzonym w wyniku eterowego wiązania między jedną z grup hydroksylowych reszty galoilowej jednego fragmentu, a ugrupowaniem 4,6-HHDP związanym w pozycji C-4 szkieletu glukozy drugiego fragmentu cząsteczki. Ugrupowanie to, znane jako sangwisorboilowe, jest spotykane jedynie w elagotaninach z rodzaju Sanguisorba i Rubus. Dotychczas w zespole elagotanin w owocach wykryto w niewielkich ilościach również lambertianinę D (10), nobotaninę A/malabatrynę B oraz sangwinę H-10 (6), sangwinę H-2 (11) oraz potentylinę/kazuaryktynę (10). W owocach maliny elagotaniny występują przede wszystkim w pestkach (12).
Ponadto w owocach maliny są obecne kwasy organiczne, w tym fenolowe (galusowy, protokatechowy, kawowy, salicylowy, ferulowy, synapinowy, syryngowy, cynamonowy, wanilinowy oraz kwas elagowy wolny i w formie koniugatów z pentozami i acetylopentozami), flawonole (3-O-glukuronidy kemferolu i kwercetyny, 3-O-rutynozyd, 3-O-galaktozyloramnozyd, 3,4’-O-diglukozyd i 3-O-glukozyd kwercetyny, tilirozyd, kwercetyna, kemferol, mirycetyna) oraz flawan-3-ole (katechina, epikatechina, procyjanidyna B2, propelargonidyny, procyjanidyny jako dimery i trimery o typie wiązania B).
Owoce maliny właściwej i maliny czarnej są bogatym źródłem makroelementów, w tym potasu (K) (177-145 mg/100 g świeżej masy) oraz wapnia (Ca) (25-35 mg/100 g ś.m.), magnezu (Mg) (10-22 mg/100 g ś.m.) i cynku (Zn) (0,13-0,14 mg/100 g ś.m.). Jednocześnie w wyższych stężeniach w owocach maliny czarnej występują mikroelementy: miedź (Cu) (0,022 mg/100 g ś.m.) i żelazo (Fe) (0,19 mg/100 g ś.m.), co może mieć znaczenie w profilaktyce niedokrwistości. Natomiast w owocach maliny właściwej oznaczono wyższe zawartości manganu Mn (0,49 mg/100 g ś.m.). W badaniach porównawczych zawartość Mn w soku z owoców maliny czerwonej była 10-krotnie wyższa od zawartości tego mikroelementu w sokach z owoców porzeczki czarnej i czerwonej, pokrywając 50% dziennego zapotrzebowania (13).
Z obecnością związków polifenolowych, przede wszystkim wysokich stężeń antocyjanów i elagotanin, wiąże się aktywność biologiczną i farmakologiczną owoców Rubus idaeus i Rubus occidentalis, która obejmuje, m.in. działanie antyoksydacyjne, przeciwzapalne, przeciwdrobnoustrojowe oraz przeciwnowotworowe.
Aktywność antyoksydacyjna
Potencjał antyoksydacyjny produktów żywnościowych jest uważany za wskaźnik ich działania prozdrowotnego (14). Owoce odmian maliny właściwej (15-21) oraz maliny czarnej (7, 12, 22-25) są najczęściej cenione ze względu na ich wysoki potencjał antyoksydacyjny. Właściwości antyoksydacyjne wspomagają naturalne systemy chroniące komórki przed działaniem wolnych rodników.
W badaniach przesiewowych działania antyoksydacyjnego szeregu surowców żywnościowych pochodzenia roślinnego, owoce maliny charakteryzowały się najwyższym potencjałem antyoksydacyjnym (26). W teście DPPH wykazano, że spośród badanych soków z owoców jagodowych, sok pozyskiwany z owoców maliny czarnej wyróżniał się, po soku z owoców porzeczki czarnej, wysoką zawartością związków polifenolowych oraz silnymi właściwościami antyoksydacyjnymi. Aktywność zmiatania wolnych rodników malała w kolejności: sok z owoców porzeczki czarnej > sok z owoców maliny czarnej > sok z owoców jagody czarnej > sok z owoców maliny właściwej > sok z owoców porzeczki czerwonej (27).
Właściwości antyoksydacyjne owoców maliny są skorelowane z frakcją elagotanin oraz frakcją antocyjanów (28, 29). Udział poszczególnych składników zespołu polifenolowego w aktywności antyoksydacyjnej owoców maliny właściwej wynosi: 50% elagotanin (w tym ok. 35% sangwina H-6 i 15% lambertianina C), 25% antocyjanów oraz 20% witaminy C (30).
Właściwości antyoksydacyjne frakcji antocyjanów są zmienne i warunkowane ich poziomem zawartości, stopniem hydroksylacji oraz glikozydacji. Aktywność antyoksydacyjna antocyjanów wzrasta wraz ze zmniejszaniem się liczby reszt cukrowych w cząsteczce i jest najsilniejsza dla wolnych aglikonów (7, 27, 31, 32). Wśród antocyjanów, pochodne cyjanidyny charakteryzują się najsilniejszymi właściwościami przeciwutleniającymi (17).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Patel AV, Rojas-Vera J, Dacke CG. Therapeutic constituents and actions of Rubus species. Curr Med Chem 2004; 11(11):1501-12. 2. Danek J. Uprawa maliny i jeżyny. Hortpress, Warszawa 2009. 3. Karabela M. Malina. Panacea 2007; 3:30-1. 4. Strzelecka H, Kamińska J, Kowalski J i wsp. Chemiczne metody badań roślinnych surowców leczniczych. Podręcznik dla studentów farmacji. PZWL, Warszawa 1982. 5. Landete JM. Ellagitannins, ellagic acid and their derived metabolites: A review about source, metabolism, functions and health. Food Res Int 2011; 44(5):1150-60. 6. Lee J, Dossett M, Finn CE. Rubus fruit phenolic research: The good, the bad, and the confusing. Food Chem 2012; 130(4):785-96. 7. Wada L, Ou B. Antioxidant activity and phenolic content of Oregon caneberries. J Agric Food Chem 2002; 50(12):3495-500. 8. Quideau S. Chemistry and biology of ellagitannins: An underestimated class of bioactive plant polyphenols. World Scientific Publishing Company, Singapore 2009. 9. Rao AV, Snyder DM. Raspberries and human health: A review. J Agric Food Chem 2010; 58(7):3871-83. 10. Kähkönen M, Kylli P, Ollilainen V i wsp. Antioxidant activity of isolated ellagitannins from red raspberries and cloudberries. J Agric Food Chem 2012; 60(5):1167-74. 11. Gasperotti M, Masuero D, Vrhovsek U i wsp. Profiling and accurate quantification of Rubus ellagitannins and ellagic acid conjugates using direct UPLC-Q-tof HDMS and HPLC-DAD analysis. J Agric Food Chem 2010; 58(8):4602-16. 12. Bushman BS, Phillips B, Isbell T i wsp. Chemical composition of cranberry (Rubus spp.) seeds and oils and their antioxidant potential. J Agric Food Chem 2004; 52(26):7982-7. 13. Horuz A, Korkmaz A, Rüştü-Karaman M i wsp. The evaluation of leaf nutrient contents and element ratios of different raspberry varieties. J Food Agric Environ 2013; 11(1):588-93. 14. McCarty MF. Proposal for a dietary “phytochemical index”. Med Hypothes 2004; 63(5):813-7. 15. Godevac D, Tešević V, Vajs V i wsp. Antioxidant properties of raspberry seed extracts on micronucleus distribution in peripheral blood lymphocytes. Food Chem Toxicol 2009; 47(11):2853-9. 16. Jakobek L, Šeruga M, Šeruga B i wsp. Phenolic compound composition and antioxidant activity of fruits of Rubus and Prunus species from Croatia. Int J Food Sci Tech 2009; 44(4):860-8. 17. Kähkönen MP, Heinonen M. Antioxidant activity of anthocyanins and their aglycons. J Agric Food Chem 2003; 51(3):628-33. 18. Kähkönen MP, Heinämäki J, Ollilainen V i wsp. Berry anthocyanins: Isolation, identification and antioxidant activities. J Sci Food Agric 2003; 83(14):1403-11. 19. Liu M, Li XQ, Weber C i wsp. Antioxidant and antiproliferative activities of raspberries. J Agric Food Chem 2002; 50(10):2926-30. 20. Mullen W, Stewart AJ, Lean MEJ i wsp. Effect of freezing and storage on the phenolics, ellagitannins, flavonoids, and antioxidant capacity of red raspberries. J Agric Food Chem 2002; 50(18):5197-201. 21. Vuorela S, Kreander K, Karonen M i wsp. Preclinical evaluation of rapeseed, raspberry, and pine bark phenolics for health related effects. J Agric Food Chem 2005; 53(15):5922-31. 22. Hager TJ, Howard LR, Liyanage R i wsp. Ellagitannin composition of blackberry as determined by HPLC-ESI-MS and MALDI-TOF-MS. J Agric Food Chem 2008; 56(3):661-9. 23. Jeong JH, Jung H, Lee SR i wsp. Anti-oxidant, anti-proliferative and anti-inflammatory activities of the extracts from black raspberry fruits and wine. Food Chem 2010; 123(2):338-44. 24. Jung J, Son MY, Jung S i wsp. Antioxidant properties of Korean black raspberry wines and their apoptotic effects on cancer cells. J Sci Food Agric 2009; 89(6):970-7. 25. Tian Q, Giusti MM, Stoner GD i wsp. Urinary excretion of black raspberry (Rubus occidentalis) anthocyanins and their metabolites. J Agric Food Chem 2006; 54(4):1467-72. 26. Halvorsen BL, Holte K, Myhrstad MCW i wsp. A systematic screening of total antioxidants in dietary plants. J Nutr 2002; 132(3):461-71. 27. Beekwilder J, Hall RD, De Vos CHR. Identification and dietary relevance of antioxidants from raspberry. BioFactors 2005; 23(4):197-205. 28. Kalt W, Forney CF, Martin A i wsp. Antioxidant capacity, vitamin C, phenolics, and anthocyanins after fresh storage of small fruits. J Agric Food Chem 1999; 47(11):4638-44. 29. González EM, De Ancos B, Cano MP. Relation between bioactive compounds and free radical-scavenging capacity in berry fruits during frozen storage. J Sci Food Agric 2003; 83(7):722-6. 30. Beekwilder J, Jonker H, Meesters P i wsp. Antioxidants in raspberry: On-line analysis links antioxidant activity to a diversity of individual metabolites. J Agric Food Chem 2005; 53(9):3313-20. 31. Pantelidis GE, Vasilakakis M, Manganaris GA i wsp. Antioxidant capacity, phenol, anthocyanin and ascorbic acid contents in raspberries, blackberries, red currants, gooseberries and Cornelian cherries. Food Chem 2007; 102(3):777-83. 32. Seeram NP, Adams LS, Zhang Y i wsp. Blackberry, black raspberry, blueberry, cranberry, red raspberry, and strawberry extracts inhibit growth and stimulate apoptosis of human cancer cells in vitro. J Agric Food Chem 2006; 54(25):9329-39. 33. Anttonen MJ, Karjalainen RO. Environmental and genetic variation of phenolic compounds in red raspberry. J Food Comp Anal 2005; 18(8):759-69. 34. Wang J, Mazza G. Inhibitory effects of anthocyanins and other phenolic compounds on nitric oxide production in LPS/IFN-γ-activated RAW 264.7 macrophages. J Agric Food Chem 2002; 50(4):850-7. 35. Wang J, Mazza G. Effects of anthocyanins and other phenolic compounds on the production of tumor necrosis factor α in LPS/IFN-γ-activated RAW 264.7 macrophages. J Agric Food Chem 2002; 50(15):4183-9. 36. Seeram NP, Momin RA, Nair MG i wsp. Cyclooxygenase inhibitory and antioxidant cyanidin glycosides in cherries and berries. Phytomed 2001; 8(5):362-9. 37. Wang H, Nair MG, Strasburg GM i wsp. Antioxidant and antiinflammatory activities of anthocyanins and their aglycon, cyanidin, from tart cherries. J Nat Prod 1999; 62(2):294-6. 38. Jean-Gilles D, Li L, Ma H i wsp. Anti-inflammatory effects of polyphenolic-enriched red raspberry extract in an antigen-induced arthritis rat model. J Agric Food Chem 2012; 60(23):5755-62. 39. Puupponen-Pimiä R, Nohynek L, Meier C i wsp. Antimicrobial properties of phenolic compounds from berries. J Appl Microbiol 2001; 90(4):494-507. 40. Puupponen-Pimiä R, Nohynek L, Hartmann-Schmidlin S i wsp. Berry phenolics selectively inhibit the growth of intestinal pathogens. J Appl Microbiol 2005; 98(4):991-1000. 41. Nohynek LJ, Alakomi HL, Kähkönen MP i wsp. Berry phenolics: Antimicrobial properties and mechanisms of action against severe human pathogens. Nutr Cancer 2006; 54(1):18-32. 42. Rauha JP, Remes S, Heinonen M i wsp. Antimicrobial effects of Finnish plant extracts containing flavonoids and other phenolic compounds. Int J Food Microbiol 2000; 56(1):3-12. 43. Lin YT, Vattem D, Labbe RG i wsp. Enhancement of antioxidant activity and inhibition of Helicobacter pylori by phenolic phytochemical-enriched alcoholic beverages. Proc Biochem 2005; 40(6):2059-65. 44. Ross HA, McDougall GJ, Stewart D. Antiproliferative activity is predominantly associated with ellagitannins in raspberry extracts. Phytochem 2007; 68(2):218-28. 45. Coates EM, Popa G, Gill CIR i wsp. Colon-available raspberry polyphenols exhibit anti-cancer effects on in vitro models of colon cancer. J Carcinogen 2007; 6. 46. Wu QK, Koponen JM, Mykkänen HM i wsp. Berry phenolic extracts modulate the expression of p21WAF1 and Bax but Not Bcl-2 in HT-29 colon cancer cells. J Agric Food Chem 2007; 55(4):1156-63. 47. Huang C, Huang Y, Li J i wsp. Inhibition of benzo(a)pyrene diol-epoxide-induced transactivation of activated protein 1 and nuclear factor κB by black raspberry extracts. Cancer Res 2002; 62(23):6857-63. 48. Hecht SS, Huang C, Stoner GD i wsp. Identification of cyanidin glycosides as constituents of freeze-dried black raspberries which inhibit anti-benzo[a]pyrene-7,8-diol-9,10-epoxide induced NFκB and AP-1 activity. Carcinogen 2006; 27(8):1617-26. 49. Galvano F, La Fauci L, Lazzarino G i wsp. Cyanidins: Metabolism and biological properties. J Nutr Biochem 2004; 15(1):2-11. 50. Zikri NN, Riedl KM, Wang LS i wsp. Black raspberry components inhibit proliferation, induce apoptosis, and modulate gene expression in rat esophageal epithelial cells. Nutr Cancer 2009; 61(6):816-26. 51. Cooke D, Steward WP, Gescher AJ i wsp. Anthocyans from fruits and vegetables – Does bright colour signal cancer chemopreventive activity? Eur J Cancer 2005; 41(13):1931-40. 52. Liu Z, Schwimer J, Liu D i wsp. Black raspberry extract and fractions contain angiogenesis inhibitors. J Agric Food Chem 2005; 53(10):3909-15. 53. Juranic Z, Zizak Z, Tasic S i wsp. Antiproliferative action of water extracts of seeds or pulp of five different raspberry cultivars. Food Chem 2005; 93(1):39-45. 54. Bastow KF, Bori ID, Fukushima Y i wsp. Inhibition of DNA topoisomerases by sanguiin H-6, a cytotoxic dimeric ellagitannin from Sanguisorba officinalis. Planta Med 1993; 59(3):240-5. 55. Han C, Ding H, Casto B i wsp. Inhibition of the growth of premalignant and malignant human oral cell lines by extracts and components of black raspberries. Nutr Cancer 2005; 1(2):207-17. 56. Chen T, Rose ME, Hwang H i wsp. Black raspberries inhibit N-nitrosomethylbenzylamine (NMBA)-induced angiogenesis in rat esophagus parallel to the suppression of COX-2 and iNOS. Carcinogen 2006; 27(11):2301-7. 57. Harris GK, Gupta A, Nines RG i wsp. Effects of lyophilized black raspberries on azoxymethane-induced colon cancer and 8-hydroxy-2?-deoxy-guanosine levels in the fischer 344 rat. Nutr Cancer 2001; 40(2):125-33. 58. Casto BC, Kresty LA, Kraly CL i wsp. Chemoprevention of oral cancer by black raspberries. Anticancer Res 2002; 22(6 C):4005-15. 59. Kresty LA, Morse MA, Morgan C i wsp. Chemoprevention of esophageal tumorigenesis by dietary administration of lyophilized black raspberries. Cancer Res 2001; 61(16):6112-9. 60. Duncan FJ, Martin JR, Wulff BC i wsp. Topical treatment with black raspberry extract reduces cutaneous UVB-induced carcinogenesis and inflammation. Cancer Prev Res 2009; 2(7):665-72. 61. Wang LS, Stoner GD. Anthocyanins and their role in cancer prevention. Cancer Lett 2008; 269(2):281-90. 62. Mullen W, McGinn J, Lean MEJ i wsp. Ellagitannins, flavonoids, and other phenolics in red raspberries and their contribution to antioxidant capacity and vasorelaxation properties. J Agric Food Chem 2002; 50(18):5191-6. 63. Sangiovanni E, Vrhovsek U, Rossoni G i wsp. Ellagitannins from Rubus berries for the control of gastric inflammation: In vitro and In vivo studies. PLoS ONE 2013; 8(8). 64. Morimoto C, Satoh Y, Hara M i wsp. Anti-obese action of raspberry ketone. Life Sci 2005; 77(2):194-204. 65. Park KS. Raspberry ketone increases both lipolysis and fatty acid oxidation in 3T3-L1 adipocytes. Planta Med 2010; 76(15):1654-8.

