© Borgis - Postępy Fitoterapii 3/2014, s. 166-179
*Tadeusz Wolski1,2, Tomasz Baj1
Systematyka gatunku Dictamnus oraz skład fitochemiczny dwu odmian dyptamu jesionolistnego (Dictamnus albus L. cv. Albifloers i cv. Rosa Purple). Cz. I.
The systematic of Dictamnus species and chemical composition of two cultivars of Dictamnus albus L. (cv. Albiflores and cv. Rosa Purple). Part I.
1Katedra i Zakład Farmakognozji z Pracownią Roślin Leczniczych, Uniwersytet Medyczny w Lublinie
Kierownik Katedry i Zakładu: dr hab. Grażyna Zgórka
2Katedra Warzywnictwa i Roślin Leczniczych, Uniwersytet Przyrodniczy w Lublinie
Kierownik Katedry: prof. dr hab. Jan Dyduch
Summary
The systematic of Dictamnus species, belonging to Rutaceae family, was described in that work. The literature data indicate that we can distinguish many cultivars specific for Asia and Europe within the same species. Dittany (Dictamnus albus L.) is relict there is many peculiarities in its texture and biology. In that work, the review of the more important groups of biological active compounds which are found in Dictamnus type was presented.
One of the more important group of compounds which occur in dittany are furoquinoline alkaloids. Their biogenesis, characteristics, occurrence and use were described in that work. The another group of compounds is important considering their therapeutically application are furanocoumarins.One of the characteristically groups of biological active compounds are limonoids in the Rutaceae family. They can be consider as a chemotaxonomic marker. They are group of modified triterpenes. Their biogenesis, characteristics, occurrence and use were described in that work. Depending on the conditions and the place of crop dittany has different oil composition. In that part of work their biogenesis, characteristics, occurrence and use and also innovative technology of receiving and measurement essential oils were described. Flavonoids are very common of plant chemical groups, especially among flowering plants. Their biogenesis, characteristics, occurrence and use were described in that work. The literature data indicate that in the raw material of dittany another group of biological active compounds were found: sesquiterpenes glycosides and steroids.
In the end of that work the pharmacological properties of raw materials of dittany and their preparations were described. The preliminary microbiological evaluation of extract of herb Dictamnus albus L. cv. Albiflores i cv. Rosa Purple was conducted and comprised with homeopathic extracts (Boiron). The conducted microbiological trials indicated activities to Gram-positive and Gram-negative bacteries.

Dyptam jesionolistny – Dictamnus albus L. – syn.: Dictamnus fraxinella Pers., Fraxinella dictamnus Moench; ang.: Dittany, Fraxinella, Burning-bush; franc.: Dictame blanc, Dictamne commun, Fraxinelle commune; niem.: Weisser Diptam, Eschenblattriger Diptamwisse Aschwurz; chin.: Bai Xian Pi; hiszp.: Dictamo blanco (1-6). Systematyka gatunku Dyptam (Dictamnus) została przedstawiona w tabeli 1.
Tabela 1. Systematyka gatunku Dictamnus (7-10).
| Gromada | Spermatophyta | Nasienne |
| Podgromada | Angiospermae | Okrytonasienne |
| Klasa | Dicotyledones | Dwuliścienne |
| Podklasa | Archlamydeae | Praokrywowe |
| Rząd | Rutales | Rutowce |
| Rodzina | Rutaceae | Rutowate |
| Gatunek | Dictamnus albus L. | Dyptam jesionolistny |
Dyptam jesionolistny został opisany po raz pierwszy w chińskich tekstach medycznych ok. 600 r. (11). Nazwa grecka rośliny – dictamnos – wywodzi się od nazwy gór na Krecie – Dicte oraz słowa thamnos = krzak. Krzew ten wymieniają Virgyl i Arystoteles, natomiast pewne informacje dotyczące leczniczego zastosowania dyptamu jesionolistnego pochodzą z XII wieku (12).
Dyptam jesionolistny przywędrował do Polski prawdopodobnie z południowego wschodu przez Podole albo też z południa przez Bramę Morawską we wczesnej fazie okresu polodowcowego, kiedy warunki sprzyjały rozpowszechnianiu się roślinności stepowej. Podobnie jak kłokoczka południowa, reprezentuje on w naszej florze element geograficzny śródziemnomorsko-pontyjski. Jako roślina reliktowa i bardzo rzadka, zawierająca ponadto szereg osobliwości w swej budowie i biologii, podlega ona całkowitej ochronie (13-15).
Dyptam jesionolistny jest rośliną dziko rosnącą, ale może być także uprawiany jako roślina ozdobna w parkach, ogrodach i na rabatach. Jest to bylina, której pędy, najczęściej nierozgałęzione, dochodzą do wysokości 120-130 cm (16-23).
Kwiaty dyptamu jesionolistnego są zebrane w kwiatostany groniaste. Są one grzbieciste, średnicy do 5 cm, o działkach kielicha odpadających po przekwitnięciu i 5 płatkach barwy białoróżowej oraz międzyległych działkach kielicha. Cztery płatki skierowane są w górę, a piąty zwrócony w dół; pełni on rolę dolnej wargi. Na górnej części płatków występują czerwone plamki, a na dolnej, bliższej dna kwiatowego, żyłki ciemniejsze od płatków, prawie fioletowe. Wskazują one owadom drogę do nektaru. Pręcików jest 10, zebranych w 2 okółki, oraz 1 słupek, górny, 5-komorowy, zazwyczaj z 3 zalążkami w każdej komorze. Jest on osadzony na osobnym trzonku, tzw. gynoforze. Na dnie kwiatu, u podstawy słupka, wydziela się nektar (24, 25).
Kwiaty są przedprątne. Zapylają je pszczoły i trzmiele. Do czasu wysypania się pyłku nitki pręcików pozostają wygięte w dolnej części w dół, a w górnej ku górze. Szyjka słupka jest w tym stadium ukryta między pręcikami. Potem górna część pręcików wyprostowuje się, na skutek czego puste już pylniki obniżają się. Dzięki temu odsłania się szyjka słupka wraz ze znamieniem i podnosi się ku górze (25, 26).
Dyptam jesionolistny kwitnie przez 8 dni. Okres ten przypada na czas od połowy maja do połowy lipca (27). W czasie kwitnienia dyptam bardzo obficie wydziela nektar i pyłek, dlatego też jest masowo odwiedzany przez pszczoły, szczególnie w godzinach południowych (20, 26, 28-30).
Wydajność miodowa z 1000 kwiatów dyptamu wynosi 15,3 g. Zakładając, że każdy okaz zajmuje powierzchnię 1 m2, a średnia liczba kwiatów na pojedynczej roślinie wynosi 1250, można określić jego wydajność z powierzchni 1 ha. W warunkach Polski wydajność ta szacunkowo wynosi 190 kg/ha, co wskazuje na cenne właściwości pożytkowe dyptamu dla pszczół (31).
Górna część łodygi pokryta jest włoskami zwykłymi oraz czerwonobrunatnymi włoskami gruczołowymi. Liście dolne są bezogonkowe, pojedyncze, odwrotnie jajowato-lancetowate; obumierają one stopniowo po rozwinięciu się liści wyższych. Liście położone wyżej na łodydze są złożone, nieparzysto-pierzaste, najczęściej 7-9-listkowe, o listkach skórkowatych, błyszczących, odwrotnie jajowatych, drobno piłkowanych, na szczycie zaostrzonych. Po dolnej stronie są one pokryte różnego rodzaju włoskami (gruczołowatymi wielokomórkowymi, główkowatymi i prostymi). Ogólnym kształtem przypominają liście jesionu; stąd nazwa gatunkowa tej rośliny. Cechą charakterystyczną liści dyptamu, wspólną zresztą dla całej rodziny Rutowatych, jest obecność zbiorników olejku eterycznego w miękiszu palisadowym (25, 32).
Owocem jest 5-krotna torebka, która widziana z góry przypomina gwiazdkę pięcioramienną. Po dojrzeniu pęka ona z charakterystycznym trzaskiem, wyrzucając nasiona na odległość do 2 m. Są one błyszczące, czarne, gruszkowate. Owoce dyptamu można więc zaliczyć do tzw. owoców eksplodujących. Gwałtowność pękania jest następstwem nierównomiernego wysychania zewnętrznej i wewnętrznej warstwy owocni, co powoduje jej skręcenie i rozerwanie (21, 24, 25).
Dyptam jesionolistny ma swoisty cytrynowy zapach. Zapach ten pochodzi od olejku eterycznego, wydzielającego się ze zbiorników wydzielniczych zlokalizowanych w liściach oraz w wielokomórkowych włoskach gruczołowych, purpurowobrunatnych, pokrywających niemal całą roślinę (górną część łodygi, dolną stronę liści, brzegi przykwiatków, działki kielicha, dolną stronę płatków, nitki pręcików, szyjkę słupka i owoce). Oprócz włosków gruczołowych ze zbiornikami olejku, łodyga, liście, działki kielicha, pręciki i przykwiatki mają włoski zwyczajne oraz włoski główkowate (33-35).
Próby kiełkowania nasion zebranych w terenie i wysianych jesienią w doniczkach, przeprowadzone przez Łukasiewicza (27), były skuteczne średnio w 52%. Hetman i Wolski (20) zalecają wysiewanie nasion bezpośrednio po zbiorze – na przełomie lipca i sierpnia – do inspektów lub na starannie przygotowanym rozsadniku, niezbyt gęsto, po przykryciu 0,5 cm warstwą ziemi. Jones i wsp. (36) oraz Geneve i wsp. (37) uzyskali dobre wyniki rozmnażając dyptam in vitro z nasion na pożywce zawierającej 1 μmol benzyloadeniny. Autorzy ci uzyskali w obu przypadkach ponad 70% wydajność mikropropagacji.
Dyptam jesionolistny jest gatunkiem stepowym, rośnie też w widnych suchych lasach liściastych i w zaroślach skalnych. Zasięg jego obejmuje Europę Środkową i Południową aż po morze Kaspijskie, dalej Syberię, Chiny Północne, Japonię, Koreę i Mandżurię (3, 37, 38). Na tak wielkim obszarze wykazuje on dość znaczne zróżnicowanie, które skłoniło systematyków rosyjskich do rozbicia go na kilka odmian o mniejszym zasięgu. Zgodnie z danymi Hegiego (39), w obrębie tego gatunku wyróżnić można szereg odmian i form swoistych dla Europy Środkowej. Zostały one przedstawione poniżej.
D. albus var. genuina Rouy – ma trzy górne płatki epileptyczne, w zakończeniu lancetowate, o skróconym paznokciu. W odmianie tej możemy wyróżnić w zależności od wielkości listków następujące odmiany:
– macrophylla Schur. – ma blaszki listków lancetowate o brzegach często gładkich;
– angustifolia (Don) (var. lanceolata Pasq.) – hodowana tylko w ogrodach;
– microphylla Schur. – ma blaszki listków bardzo małe, o długości 1,8 cm, wydłużone, tępo zakończone. Inne zróżnicowanie tej odmiany opiera się na sposobie osadzenia słupka:
• typika Beck. – ma słupek siedzący lub prawie siedzący;
• stipitata Beck. – ma słupek osadzony na wyraźnym gynoforze, płatki korony są różowe z nerwami koloru fiołkowego (l. purpurea Rouy), białe (l. albiflora Koch.), albo czystoczerwone i duże (l. grandiflora Hort.);
• sessilis Wallr. – ma krótki gynofor z osadzonym słupkiem.
D. albus var. obtusiflora Koch – ma płatki korony epileptyczne, trzy górne płatki są tępo zakończone lub jeden z nich jest ostro zakończony, największy płatek ma największą liczbę gruczołów. Szyjka słupka jest znacznie dłuższa od gynoforu. Blaszki listków są krótkie, słabo karbowane. Odmiana ta występuje w południowym Tyrolu.
D. albus var. caucasica Boiss (D. gymnostylis Stev.) – górne płatki są jajowate, na końcu zaokrąglone i płytko karbowane, nasada płatków jest zaokrąglona i przechodzi w paznokieć. Odmiana ta występuje na Krymie i Kaukazie.
D. albus var. macedonica Borb. – odmiana podobna do D. alba var. genuina, występuje w byłej Jugosławii i Chorwacji.
Flora byłego ZSRR (40), będąca opracowaniem wcześniejszym od publikacji Hegiego (39), wyróżnia w rodzaju Dictamnus następujące gatunki:
D. dasycarpus Turcz. (D. albus sp. dasycarpus Wint., D. fraxinella), który występuje we wschodniej części Syberii i na Dalekim Wschodzie; poza tym spotykany jest we Wschodniej Mongolii, Mandżurii oraz w Korei.
D. tadshikorum Vved. nom. nov. (D. turkestanicus var. bucharicus Wint.; D. himalayanus Royle) – jest gatunkiem endemicznym, występuje w górach Środkowej Azji.
D. angustifolius G. Don ex. Sweet (D. albus L. ssp. turkestanicus Wint.) – występuje w Zachodniej Syberii, górach Ałtaju i w Środkowej Azji.
D. caucasicus Fisch. ex. Grossh. (D. albus L. ssp. caucasicus Wint.) – gatunek ten występuje w dolinie środkowego Dniepru, dolnego Donu, w okręgu nadwołżańskim oraz na Kaukazie. Spotykany jest także w Iranie.
D. gymnostylis Stev. (D. albus L. ssp. gymnostylis Wint.) – występuje w europejskiej części byłego ZSRR w dolinie środkowego Dniepru, dolnego Donu i na Krymie oraz w części azjatyckiej byłego ZSRR – na Kaukazie.
Wóycicki (cyt. za 25) wymienia jako uprawiane w krajowych ogrodach następujące odmiany: var. caucasicus Hort. (syn. D. albus var. major Hort.); var. albiflorus Hort.; var. purpureus Hort.
Dyptam jesionolistny w Polsce rzadko występuje w stanie dzikim (3). Najczęściej znajdowano go koło Włocławka w Kulinie oraz rezerwacie leśno stepowym Grabowiec koło Bogucic. D. albus spotkać można także w okolicach Pińczowa i Buska Zdroju, w okolicach Skierniewic na Wyżynie Małopolskiej, w okolicy Świecia na Pomorzu, gór Tuł na Pogórzu Cieszyńskim. Roślina ta była też znajdowana w Górach Kaczawskich na Dolnym Śląsku (16). Na rycinie 1 przedstawiono rozmieszczenie dyptamu jesionolistnego na świecie (13). Natomiast na rycinie 2 przedstawiono organy dyptamu jesionolistnego D. albus cv. Rosa Purple (41).
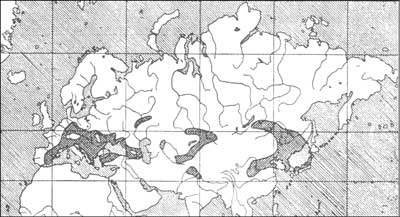
Ryc. 1. Rozmieszczenie dyptamu jesionolistnego w Europie i Azji (13).

Ryc. 2. Różne organy dyptamu jesionolistnego D. albus cv. Rosa Purple (41).
(A – kwiatostan; B – ziele; C – torebka nasienna; D – nasiono; E – korzeń)
Przegląd ważniejszych grup związków biologicznie czynnych występujących w rodzaju Dictamnus
Związki biologicznie czynne, wykazujące aktywność farmakologiczną, należą głównie do substancji będących metabolitami wtórnymi. W rodzaju Dictamnus stwierdzono występowanie: alkaloidów, olejków eterycznych, kumaryn, limonoidów, laktonów i glikozydów seskwiterpenowych, flawonoidów, steroli i triterpenów (1, 2, 42-44).
Schemat powstawania substancji roślinnych, będących metabolitami pierwotnymi, i ich przemian do metabolitów wtórnych, przedstawia rycina 3.
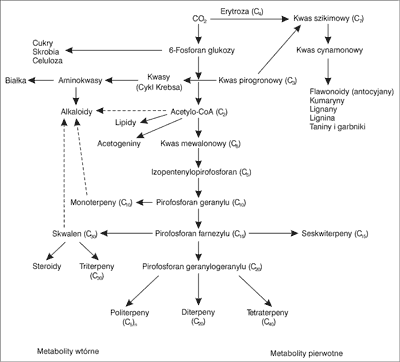
Ryc. 3. Schemat biogenetyczny substancji roślinnych będących metabolitami pierwotnymi i wtórnymi (45, 46).
Alkaloidy furanochinolinowe – biogeneza, właściwości, występowanie i zastosowanie
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Hoppe HA. Drogenkunde. Cram, de Gruyter & Co, Hamburg 1958; 234. 2. Hoppe HA. Drogenkunde. Walter de Gruyter, Berlin-New York 1975; 410. 3. Podbielkowski Z. Słownik roślin użytkowych. PWRiL, Warszawa 1985. 4. Hegnauer R. Chemotaxonomie der Pflanzen. Birkhauser Verlag. Basel-Boston-Berlin 1990; 443. 5. Anioł-Kwiatkowska J, Kwiatkowski S, Berdowski W. Rośliny lecznicze – atlas. Wyd. Arkady, Warszawa 1993; 100. 6. Jędrzejko K. Medicinal plants and herbal materials in use in Poland; a check list. Wykaz roślin i surowców leczniczych stosowanych w Polsce. Śląska Akademia Medyczna, Katowice 2001; 124. 7. Strasburger E, Jost L, Schenck i wsp. Lehrbuch der Botanik. Verlag von Gustav Fischer, Jena 1911; 505. 8. Tutin TG, Heywood VH, Burges NA i wsp. (red.). Flora Europea. University Press, Cambridge 1968; 229. 9. Borkowski B. Zarys farmakognozji, PZWL, Warszawa 1970; 696. 10. Broda B, Zarys botaniki farmaceutycznej. PZWL, Warszawa 1998; 251. 11. Bown D. Wielka encyklopedia ziół. Muza S.A., Warszawa 1999; 273. 12. Kowalczyk B. Dyptam jesionolistny – roślina ozdobna, trująca i lecznicza. Wiad Ziel 1986; (10):14. 13. Kostyniuk M, Marczek E. Nasze rośliny chronione. Wrocł Tow Nauk, Wrocław 1961; 82. 14. Bagiński S, Mowszowicz J. Krajowe rośliny trujące. Łódzkie Tow Nauk, Łódź 1963; 146. 15. Dziennik Ustaw. Rozporządzenie Ministra Ochrony Środowiska Zasobów Naturalnych i Leśnictwa w sprawie ochrony gatunkowej roślin. Dz U 41/1995, poz. 214. 16. Szafer W, Zarzycki K (red.). Szata roślinna Polski. t. II. PWN, Warszawa, 1972; 85. 17. Szafer W, Kulczyński S, Pawłowski B. Rośliny polskie. PWN, Warszawa 1988; 411. 18. Bremeness L. Wielka księga ziół. Wiedza i Życie, Warszawa 1991; 275. 19. Podlech D. Rośliny lecznicze. Muza S.A., Warszawa 1998; 90. 20. Hetman J, Wolski T. Dyptam roślina nie tylko ozdobna. Kwiaty 1999; 3(103):13-4. 21. Wolski T, Baj T, Zwolan W. Dyptam jesionolistny – roślina o wielokierunkowym działaniu farmakologicznym. Wiad Ziel 1997; 12(39):8-9. 22. Wolski T, Baj T, Zwolan W. Dyptam jesionolistny – chroniona roślina lecznicza i ozdobna. Ezop 1997; 9(37):20-1. 23. Wolski T, Baj T, Mardarowicz M i wsp. Zagrożenia ekologiczne związane z uprawą dyptamu jesionolistnego (Dictamnus albus L.). Mat Ogólnopol Konf Nauk nt. Proekologiczne metody produkcji warzyw. Siedlce 1999; 17-18 czerwca: 68. 24. Świejkowski L. Ochrona roślin w Polsce. Poziom, Łódź 1956; 311. 25. Gertig H. Morfologia i anatomia dyptamu jesionolistnego. Dissert Pharm 1956; 8:203-30. 26. Wolski T, Baj T, Gliński J. Właściwości miododajne i farmakologiczne dyptamu jesionolistnego (Dictamnus albus L.). Ann UMCS, sec. DD 1998; 5:43-55. 27. Łukasiewicz A. Ekologia, uprawa oraz reintrodukcja Dictamnus albus L. Prace Ogrodu Bot. PAN 1991; 1:75-85. 28. Weryszko-Chmielewska E, Hetman J, Sulborska A i wsp. Ekologia kwiatów i pożytek pyłkowy dwóch gatunków dyptamu jesionolistnego (Dictamnus albus L.), Bibl Fragm Agron 1999; 6:145-51. 29. Weryszko-Chmielewska E, Hetman J, Sulborska A i wsp. Ekologia kwiatów i pożytek pyłkowy dwóch gatunków dyptamu jesionolistnego (Dictamnus albus L.). Mat II Ogólnopolsk Konf Nauk nt. Biologia kwitnienia, nektarowania i zapylania roślin. Lublin 1999a; 9-10 listopada:18. 30. Weryszko-Chmielewska E, Masierowska M, Sulborska A i wsp. Nektarowanie dwóch odmian dyptamu jesionolistnego (Dictamnus albus L.). Mat 37 Nauk Konf Pszczel Puławy 2000; 8-9 marca 343. 31. Marczewska E. Dyptam jesionolistny – chroniona roślina nektarodajna. Pszczelarstwo 1976; 4:12-3. 32. Baumeister W, Reichart G. Lehrbuch der Angewandten Botanik. Gustav Fischer Verlag. Stuttgart 1969; 287. 33. Weryszko-Chmielewska E. Tkanka sekrecyjna w organach nadziemnych dyptamu jesionolistnego (Dictamnus albus L.). Mat Symp 51 Zjazd Pol Tow Bot nt. Botanika polska u progu XXI wieku. Lublin 1998; 518. 34. Weryszko-Chmielewska E, Baj T, Wolski T. Structure of secretory tissues and content of some biologically active compounds in flowers and herb of dittany (Dictamnus albus L.). Mat Konf Nauk pt. 7th conference on the application of chromatographic methods in phytochemical and biomedical analysis. Lublin, 1998; 25-27 czerwca: 52. 35. Weryszko-Chmielewska E, Baj T, Wolski T. Struktura tkanek wydzielniczych oraz zawartość niektórych substancji biologicznie czynnych w zielu i kwiatach dyptamu jesionolistnego. Herba Pol 1998; 44(4):45-55. 36. Jones RO, Geneve RL, Kester ST. Micropropagation of gas plant (Dictamnus albus L.). J Environ Hort 1994; 12(4):216-8. 37. Geneve RL, Jones RO, Kester ST. Micropropagation of gas plant (Dictamnus albus L.). W: Bajaj Y.P.S. (ed.). Biotechnology in Agriculture and Forestry 40: High-Tech and Micropropagation VI. Springer-Verlag, New York 1997; 360-9. 38. Oszkinis K. Kwiaty od A do Z. PWRiL, Warszawa 1979; 137. 39. Hegi G. Illustrierte Flora von Mittel Europa. J.I. Lehmanns Verlag, Monachium 1937; 74. 40. Szyszkin BK, Bobrow EG. Flora USSR. Izd Akad Nauk, Moskwa-Leningrad 1949; 227. 41. Volak J, Stodola I. Rośliny lecznicze. PWRiL, Warszawa 1987; 142. 42. Renner W. Betrage zur Kenntnis der Biogenese sekundarer Pflanzenstoffe von Dictamnus albus L. Pharmazie 1962; 17(12):763-76. 43. Roth L, Daunderer M, Kormann K. Giftpflanzen Pflanzengifte. Nikol Verlagsgesellschaft mbH & Co KG, Hamburg 1994; 301. 44. Fleming T (red.). PDR for Herbal Medicines. Med Econom Comp, Montvale 2000; 806. 45. Kączkowski J. Biochemia roślin. T I – Przemiany typowe. PWN, Warszawa 1992. 46. Kohlmunzer S. Farmakognozja. PZWL, Warszawa 1998; 669. 47. Southon IW, Buckingham J (red.). Dictionary of Alkaloids. Chapman and Hall, London-New York 1989. 48. Gertig H, Grabarczyk H, Oznaczanie zawartości dyktamniny w dyptamie jesionolistnym. Dissert Pharm 1959; 11(4):333-41. 49. Gertig H, Grabarczyk H. Zawartość alkaloidów i olejku w dyptamie jesionolistnym (Dictamnus albus L.) w okresie rocznej wegetacji. Dissert Pharm 1960; 12(3):229-36. 50. Anderson TH. The Plant Alkaloids. J & A Churchill Ltd, London 1949; 413. 51. Bentley KW (red.). The Alkaloids. Interscience Publishers Ltd, New York-London. 1957; 128. 52. Boulanger D, Bailey BK, Steck W. Formation of edulinine and furanoquinoline alkaloids from quinoline derivatives by cell suspension cultures of Ruta graveolens. Phytochem 1973; 12:2399-405. 53. Najjar S, Cordell GA, Farnsworth NR. Alkaloids and coumarins from Zanthoxylum belizense. Phytochem 1975; 14:2309-10. 54. Wolters B, Eilert U. Antimicrobial substances in callus cultures of Ruta graveolens. Planta Med 1981; 43:166-74. 55. Mizuta M, Kanamori H. Mutagenic activities of dictamnine and γ-fagarine from Dictamni Radicis Cortex (Rutaceae). Mutation Res 1985; 144:221-5. 56. Ulubelen A, Terem B, Tuzlaci E i wsp. Alkaloids and coumarins from Ruta chalepensis. Phytochem 1986; 25(11):2692-3. 57. Wu TS, Li ChY, Leu YL i wsp. Limonoids and alkaloids of the root bark of Dictamnus angustifolius. Phytochem 1999; 50:509-12. 58. Zhao W, Wolfender JL, Hostettmann K i wsp. Antifungal alkaloids and limonoid derivatives from Dictamnus dasycarpus. Phytochem 1998; 47(1):7-11. 59. Gertig H, Grabarczyk H. Izolacja alkaloidów z korzeni i ziela dyptamu jesionolistnego (Dictamnus albus L.). Acta Pol Pharm 1961; 18(2):97-102. 60. Klier B, Schimmer O. Microsomal metabolism of dictamnine: identification of metabolites and evaluation of their mutagenicity in Salmonella typhimurium. Mutagenesis 1999; 14(2):181-5. 61. Cui B., Chai H, Dong Y i wsp. Quinoline alkaloids from Acronychia laurifolia. Phytochem 1999; 52:95-8. 62. Sayed KE, Al-Said MS, El-Feraly FS i wsp. New quinoline alkaloids from Ruta chalepensis. J Nat Prod 2000; 63:995-7. 63. Bivatti MW, Vieira PC, Fatima M i wsp. Biological activity if quinolone alkaloids from Raulinoa echinata and x-ray structure of flindersiamine. J Braz Chem Soc 2002; 13(1):66-70. 64. Towers GH, Graham EA, Spenser ID i wsp. Phototoxic furanoquinolines of Rutaceae. Planta Med. 1981; 41:136-42. 65. Głowniak K, Kozyra M. Kumaryny – ich rozpowszechnienie w świecie roślinnym i aktywność biologiczna. W: Biochemiczne oddziaływania środowiskowe (Oleszek W, red). AM, Lublin 2001; 251-267. 66. Murray RDH, Mendez J, Brown SA. The Natural Coumarins. Occurrence, Chemistry and Biochemistry. Willey and Sons Ltd, Chichester 1982; 702. 67. Ojala T. Biological screening of plant coumarins. Acad Dissert, University of Helsinki, Helsinki 2001; 62. 68. Zobel AM, Brown SA. Dermatitis-inducting furanocoumarins on leaf surfaces of eight species of Rutaceous and Umbelliferous plants. J Chem Ecol 1990; 16(3):693-700. 69. Reisch J, Szendrei K, Minker E i wsp. Notiz Uber Das Vorkommen Von Aurapten in Dictamnus albus. Planta Med 1967; 15:320-2. 70. Komissarenko HF, Lewashowa IG, Akhmedov UA. Coumarins and flawonoids of Dictamnus angustifolius. Khim Prir Soedin 1984; 8(2):247-8. 71. Engel S, Horn K. Phytodermatosen durch Dictamnus alba, Sanicula europea und Phyllodendron consanguineum. Derm Mschr 1972; 158(1):22-7. 72. Suhonen R. Phytophotodermatitis. An experimental study using the chamber method. Cont Dermat 1977; 3:127-32. 73. Moller H. Phototoxicity of Dictamnus alba. Cont Dermat 1978; 4(5):264-9. 74. Henderson JA, DesGroseilliers JP. Gas plant (Dictamnus albus) phytophotodermatitis simulating poison ivy. Can Med Ass J 1984; 130(7):889-91. 75. Knuchel M, Luderschmidt C. Bullose phototoxische Kontaktdermatitis durch Dictamnus albus. „Brennender Busch“ der Bibel? Dtsch Med Wschr 1986; 111(38):1445-7. 76. Schempp ChM, Sonntag M, Schopf E i wsp. Dermatitis bullosa striata pratensis durch Dictamnus albus L. (Brennender Busch). Hautarzt 1996; 47(9):708-10. 77. Bruneton J. Toxic Plants. Dangerous to Humans and Animals. Lavoisier Publishing, London 1999; 270. 78. Koh D, Ong CN. Phytophotodermatitis due to the application of Citrus hystrix as a folk remedy. Brit J Derm 1999; 140:737-8. 79. Chen IS, Lin YC, Tsai IL i wsp. Coumarins and anti-plateled aggregation constituents from Zanthoxylium schinifolium. Phytochem 1995; 39(5):1091-7. 80. Borodin F. Photochemical and photobiological properties of furocoumarins and homologues drugs. Int J Photoenerg 1999; 1(1):1-6. 81. Ojala T, Kiviranta J, Vuorela H i wsp. A bioassay using Artemia salina for detecting phototoxicity of plant coumarins. Planta Med 1999; 65:715-8. 82. Towers GH, Whitehead FW, Abramowski ZA i wsp. Psoralen – like photoactivity of the alkaloid dictamnine. Cont Dermat 1980; 6(7):508. 83. Głowniak K. Badania i izolacja związków kumarynowych z krajowych surowców roślinnych. Rozprawa habilitacyjna. AM, Lublin 1988. 84. Kraft N. A case of psoriasis due to menstrual irregularity. http://home.iSTAR.ca/~nkraft/PS.article.html. 1996; 5 pp. 85. Murphy GM, Greaves MW. Nowe leki w leczeniu trądziku i łuszczycy. W: Nowe leki (Feely J, red). PWN, Warszawa. 1985; 469-82. 86. Liu Z, Lu Y, Lebwohl M i wsp. PUVA (8-methoxy-psoralen plus ultraviolet A) induces the formation of 8-hydroxy-2’-deoxyguanosine and DANN fragmentation in calf thymus DANN and human epidermoid carcinoma cells. Free Rad Biol Med 1999; 27(1/2):127-33. 87. Zarebska Z, Waszkowska E, Caffieri S i wsp. PUVA (psoralen+UVA) photochemiotherapy: processes triggered in the cells. Farmaco 2000; 55:515-20. 88. Czukowska L (red). Indeks leków. Medycyna Praktyczna, Kraków 1999; 644. 89. Wawrzkiewicz K, Wolski T, Ziółkowska G i wsp. Przeciwgrzybowe właściwości wyciągu z owoców arcydzięgla lekarskiego (Archangelica officinalis). Med Wet 1990; 46(8):289-92. 90. Pięta D, Machowicz-Stefaniak Z, Wolski T i wsp. Preparat furanokumarynowy i próba jego zastosowania jako środka ochrony przed fitopatogenami. Pestycydy 1995; 3:29-36. 91. Wolski T, Gliński Z, Buczek K i wsp. Otrzymywanie i charakterystyka roślinnych ekstraktów furanokumarynowych o działaniu przeciwgrzybiczym. Herba Pol 1996; 42(3):168-73. 92. Gliński Z, Wolski T. Ekstrakty roślinne zawierające furanokumaryny w terapii grzybic człowieka i zwierząt. Ann UMCS, sec. DD 1997; 52(16):143-54. 93. Kędzia B, Wolski T, Kawka S i wsp. Działanie na dermatofity zaspołów i frakcji furanokumarynowych otrzymywanych z owoców Archangelica officinalis Hoffm. i Heracleum sosnowskyi Manden. Herba Pol 1996; 42(1):47-54. 94. Gliński Z, Wolski T, Chmielewski M. Badania “in vitro” nad aktywnością przeciwgrzybiczą wyciągów z owoców arcydzięgla lekarskiego (Archangelica officinalis Hoffm.) w stosunku do Ascosphaera apis. Med Wet 1988; 44(9):552-6. 95. Gliński Z, Rzedzicki J, Wolski T i wsp. Perspektywy zwalczania grzybic pszczoły miodnej z uwzględnieniem immunomodulujących efektów leków przeciwgrzybiczych. Ann UMCS, sec. DD 1998; 53(20):201-16. 96. Głowniak K, Wolski T, Dragan T. Sposób wyodrębniania kumaryn z surowców roślinnych zwłaszcza z owoców arcydzięgla i oleśnika. Pat Pol 152163. 97. Kuczyńska L, Lecewic-Toruń B, Wolski T i wsp. Experimental external treatment of some forms of mycosis with furano-coumarin extracts. Post Derm 1992; 9:149-56. 98. Wolski T, Gliński Z, Chmielewski M. Sposób otrzymywania preparatów zapobiegających powstawaniu grzybic oraz niszczących Varroa jacobsoni Qud. Pat Pol 157485 oraz 157486. 99. Wolski T, Gliński Z, Buczek K i wsp. Możliwości leczenia grzybic ekstraktami roślinnymi. Herba Pol 1997; 43(1):47-52. 100. Wolski T, Kawka S, Wolski J. Sposób otrzymywania nowego preparatu przeciwgrzybiczego i nowy preparat przeciwgrzybiczny. Pat Pol 169921. 101. Wolski T, Kawka S. Sposób otrzymywania nowego preparatu grzybobójczego i nowy preparat grzybobójczy. Pat Pol 171060. 102. Wolski T, Kawka S. Sposób otrzymywania nowego preparatu grzybobójczego i nowy preparat grzybobójczy. Pat Pol 171521. 103. Wolski T, Gliński J. Naturalne ekstrakty i preparaty roślinne. Ann UMCS, sec. EEE 2001; 9(Suppl): 19-36. 104. Sobolewska D, Zgud-Walaszek M, Janeczko Z. Limonoidy – czy tylko gorycze? Farm Pol 1999; 55(18):842-6. 105. Sawabe A, Morita M, Kiso T i wsp. Isolation and characterization of new limonoid glycosides from Citrus unshiu peels. Carbohydr Res 1999; 315:142-7. 106. Mulholland DA, Randrianarivelojosia M., Lavaud C i wsp. Limonoid derivatives from Astrotrichilia voamata. Phytochem 2000; 53:115-8. 107. Bennett RD, Hasegawa S. 7α-Oxygenated limonoids from the Rutaceae. Phytochem 1982; 21(9):2349-54. 108. Blaise AJ, Winternitz F. Isofraxinellone, a limonoid lactone from the bark of Fagaropsis glabra. Phytochem 1985; 24(10):2379-81. 109. Boustie J, Moulis C, Gleye J i wsp. A degraded limonoid from Fagaropsis glabra. Phytochem 1990; 29(5):1699-701. 110. Kumar ChSSR., Srinivas M, Yakkundi S. Limonoids from the seeds of Azadirachta indica. Phytochem 1996; 43(2):451-5. 111. Torto B, Hassanali A, Nyandat E i wsp. A limonoid from Turraea floribunda. Phytochem 1996; 42(2):1235-7. 112. Hasegawa S, Suhayda ChG, Hsu WJ i wsp. Purification of limonoid glucosyltransferase from navel orange albedo tissues. Phytochem 1997; 46(1):33-7. 113. Jayaprakasha GK, Singh RP, Pereira J i wsp. Limonoids from Citrus reticulata and their moult inhibiting activity in mosquito Culex quinquefasciatus larvae. Phytochem 1997; 44(5):843-6. 114. Canovas M, Garci-Cases L, Iborra JL. Limonin consumption at acidic pH values and absence of aeration by Rhodococcus fascians cells in batch and immobilized continuous systems. Enzyme Microb Technol 1998; 22:111-6. 115. Zhao W, Wolfender JL, Hostettmann K i wsp. Sesquiterpene glycosydes from Dictamnus dasycarpus. Phytochem 1998; 47(1):63-8. 116. Jung H, Sok DE, Kim YH i wsp. Potentiating effect of obacunone from Dictamnus dasycarpus on cytotoxicity of microtubule inhibitors, vincristine, vinblastine and taxol. Planta Med 2000; 66:74-6. 117. Woo WS, Lee EB, Kang SS i wsp. Antifertility principle of Dictamnus albus root bark. Planta Med 1987; 53(5):399-401. 118. Yu SM, Ko FN, Su MJ i wsp. Vasorelaxing effect in rat thoracic aorta caused by fraxinellone and dictamine isolated from the Chinese herb Dictamnus dasycarpus Turcz: comparison with cromakalim and Ca2+ channel blockers. Naunyn-Schmiedeb Arch Pharmacol 1992; 345:349-55.



