© Borgis - Postępy Fitoterapii 4/2014, s. 216-226
*Tadeusz Wolski1,2, Tomasz Baj1
Systematyka gatunku Dictamnus oraz skład fitochemiczny dwu odmian dyptamu jesionolistnego (Dictamnus albus L. cv. Albiflores i cv. Rosa Purple). Cz. II.
The systematic of Dictamnus species and chemical composition of two cultivars of Dictamnus albus L. (cv. Albiflores and cv. Rosa Purple). Part II.
1Katedra i Zakład Farmakognozji z Pracownią Roślin Leczniczych, Uniwersytet Medyczny w Lublinie
Kierownik Katedry i Zakładu: dr hab. Grażyna Zgórka
2Katedra Warzywnictwa i Roślin Leczniczych, Uniwersytet Przyrodniczy w Lublinie
Kierownik Katedry: prof. dr hab. Jan Dyduch
Summary
The systematic of Dictamnus species, belonging to Rutaceae family, was described in that work. The literature data indicate that we can distinguish many cultivars specific for Asia and Europe within the same species. Dittany (Dictamnus albus L.) is relict there is many peculiarities in its texture and biology. In that work, the review of the more important groups of biological active compounds which are found in Dictamnus type was presented.
One of the important group of compounds which occur in dittany are furoquinoline alkaloids. Their biogenesis, characteristics, occurrence and use were described in that work. The another group of compounds is important considering their therapeutically application are furanocoumarins. One of the characteristically groups of biological active compounds are limonoids in the Rutaceae family. They can be consider as a chemotaxonomic marker. They are group of modified triterpenes. Their biogenesis, characteristics, occurrence and use and also innovative technology of receiving and measurement essential oils were described. Flavonoids are very common of plant chemical groups, especially among flowering plants. Their biogenesis, characteristics, occurrence and use were described in that work. The literature data indicate that in the raw material of dittany another group of biological active compounds were found: sesquiterpenes glycosides and steroids.
In the end of that work the pharmacological properties of raw materials of dittany and their preparations were described. The preliminary microbiological evaluation of extract of herb Dictamnus albus L. cv. Albiflores i cv. Rosa Purple was conducted and comparised with homeopathic extracts (Boiron). The conducted microbiological trials indicated activities to Gram-positive and Gram-negative bacteries.

Olejki eteryczne – biogeneza, właściwości, występowanie, zastosowanie
oraz nowe techniki oznaczania
Olejki eteryczne występujące w świecie roślinnym stanowią mieszaniny substancji lotnych o różnym składzie chemicznym, charakteryzujące się silnym, przyjemnym zapachem. W ich skład wchodzą najczęściej mono-, seskwi- i rzadziej diterpeny (olejki terpenowe) lub związki pochodne fenylopropanu (olejki nieterpenowe). Występujące w nich związki mają charakter węglowodorów, alkoholi, aldehydów, ketonów, estrów, eterów. Oprócz wymienionych związków terpenowych i pochodnych fenylopropanu, spotyka się również w olejkach substancje siarkowe (olejki gorczyczne), azotowe, pochodne acetylenu, tropolony, kumaryny, kwasy organiczne i inne. Ogółem poznano dotychczas ponad 2000 związków wchodzących w skład różnych olejków eterycznych (1-3).
Podstawową grupą związków występujących w olejkach są izoprenoidy, których prekursorem jest „aktywny izopren” (IPP), powstający z acetylo-CoA w wyniku reakcji przedstawionych na rycinie 1.
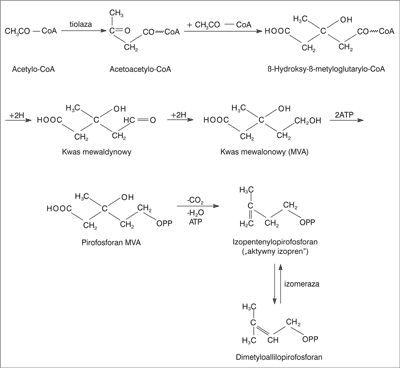
Ryc. 1. Schemat biosyntezy izoprenoidów (1).
Do grupy biogenetycznej izoprenoidów zalicza się ważne, występujące w roślinach związki: monoterpeny, seskwiterpeny, di-, tri-, tetra- i politerpeny, steroidy, irydoidy i inne terpenoidy, m.in. alkaloidy terpenoidowe.
Główną reakcją biochemicznych przemian aktywnego izoprenu jest polimeryzacja jego 5-węglowych jednostek, głównie do związków C10, C15, C20, C30, C40, i cyklizacja (np. triterpenów ze skwalenu) (1).
Do charakterystyki olejków eterycznych służą dane fizykochemiczne, takie jak gęstość, współczynnik załamania światła nD, skręcalność właściwa (α)D, rozpuszczalność oraz oznaczenia chemiczne ich głównych składników.
Gęstość olejków jest mniejsza od wody. W temperaturze pokojowej olejki mają zwykle konsystencję płynną, rzadziej mazistą, a wyjątkowo zestalają się (olejek anyżowy). Najczęściej są one bezbarwne, ale mogą być lekko żółte lub brunatne, błękitne bądź zielone. W większości olejki odznaczają się dużą lotnością. Temperatura wrzenia tych związków wynosi od 50-320oC, są łatwopalne, przy przechowywaniu na słońcu gęstnieją i ciemnieją. Są słabo rozpuszczalne w wodzie, natomiast łatwo rozpuszczają się w tłuszczach i rozpuszczalnikach organicznych. Olejki są optycznie czynne – prawo- i lewoskrętne. Histochemicznie olejki są wykrywane w tworach tkanki wydzielniczej roślin reakcją z Sudanem III (zabarwienie pomarańczowe) lub alkaniną (zabarwienie czerwone) (1, 2, 4).
Badania jakościowe i ilościowe oraz rozdział poszczególnych składników olejków eterycznych przeprowadza się głównie metodą chromatografii gazowej (GC). Ze względu na tworzenie barwnych kompleksów olejków z różnymi odczynnikami, do ich oznaczeń można także używać metod TLC (5, 6).
Olejki eteryczne należą do bardzo rozpowszechnionych produktów metabolizmu roślin. Minimalne ich ilości można spotkać w bardzo wielu gatunkach. Za gatunki olejkowe uważa się zwykle takie, które zawierają powyżej 0,01% olejku. Zawartość olejku eterycznego może czasami sięgać 20%. Szczególnie obfitującymi w olejek eteryczny są rodziny: Pinaceae, Cupresaceae, Piperaceae, Lauraceae, Apiaceae, Myrtaceae, Lamiaceae, Rutaceae, Asteraceae, Zingiberaceae, Araceae, Poaceae (1).
Każdy olejkodajny gatunek rośliny syntetyzuje i gromadzi olejek eteryczny o uwarunkowanym genetycznie, charakterystycznym i niepowtarzalnym składzie chemicznym. Jednakże w obrębie gatunku zauważa się czasem duże zróżnicowanie zawartości olejku i jego składu. Zmienność tą w żywej roślinie mogą powodować czynniki endogenne i egzogenne, np. stadium ontogenezy, warunki glebowe i klimatyczne, rodzaj chemotypu oraz rodzaj organu roślinnego (7).
Rośliny z rodzaju Dictamnus cechuje różny skład olejkowy w zależności od warunków oraz miejsca uprawy. Baser i wsp. (8) jako główne składniki olejku występującego w dyptamie rosnącym w Turcji podają: dyktagymninę (A) (46,48%), fenikulinę (B) (9,87%), anetol (C) (28,02%) oraz metylochawikol (estragol) (D) (11,01%) (ryc. 2). Dane te potwierdziły wcześniejsze doniesienia Treibs i Bournot (9) dotyczące występowania anetolu i metylochawikolu.
Wzór ogólny
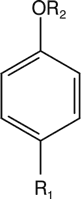 |
| Oznakowanie | Nazwa związku | Podstawniki |
| R1 | R2 |
| A | Dyktagymnina | –CH2–CH=CH2 | –CH2–CH=C(CH3)2 |
| B | Fenikulina | –CH=CH–CH3 | –CH2–CH=C(CH3)2 |
| C | trans-Anetol | –CH=CH–CH3 | –CH3 |
| D | Metylchawikol (Estragol) | –CH2–CH=CH2 | –CH3 |
 |
 |
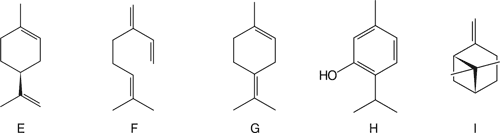
Ryc. 2. Wzory głównych składników olejku eterycznego D. albus.
E – limonen; F – mircen; G – terpinolen; H – tymol; I – β-pinen; J – geijeren; K – pregeijeren; L – 1,8-cyneol; M – p-cymen
W pracach Kubeczki i wsp. (10) badano różnice pomiędzy zawartością składników olejków eterycznych (OE) w kwiatach, owocach i torebkach nasiennych dyptamu rosnącego w Niemczech. Stwierdzono, że głównymi składnikami są: limonen (E) (kwiaty 46,25%; owoce 53,50%; torebki nasienne 44,86%); mircen (F) (19,13%; 21%; 21,85%); terpinolen (G) (12,72%; 6,16%; 13,97%) (ryc. 2). Fleming (11) podaje jako główne składniki OE w korzeniach: pochodne fraxinelonu, tymol (H), β-pinen (I), geijeren (J), pregeijeren (K); w zielu: trans-anetol (C)+estragol (D), trans-anetol (C)+mircen (F), limonen (E), 1,8-cyneol (L), p-cymen (M)+estragol (D) (ryc. 2)
Intensywny zapach (OE) dyptamu odczuwany jest szczególnie silnie przy ciepłej, słonecznej pogodzie. W przypadku dyptamu duże stężenie OE nad kwitnącą rośliną może wywołać efekt „płonącego krzewu”. Zjawisko samozapalenia się dyptamu opisywane było w wielu pracach (12-15).
Jak podają Gertig i Grabarczyk (16) najwięcej OE w dyptamie gromadzi się w fazie rozwijania liści i kwiatostanów. W fazie rozwijania pędów zawartość olejku jest bardzo niska. Od momentu kwitnienia do końca okresu wegetacyjnego obserwuje się stały, mniej więcej równomierny spadek zawartości olejku. Zawartość olejku w przeliczeniu na suchą masę w zielu wynosiła 0,06-0,4%, w korzeniach 0,11-0,89%, zaś w kwiatach 0,15% w okresie rocznej wegetacji.
Właściwości farmakologiczne i lecznicze olejków eterycznych zależą od charakteru głównych składników. Olejki eteryczne mogą działać jako środki drażniące skórę (rubefacientia), moczopedne (diuretica), wykrztuśne (expectorantia), przeciwzapalne (antiphlogistica), żółciopędne i żółciotwórcze (cholagoga et cholaretica), spazmolityczne (spasmolytica), przeciwrobacze (anthelmintica), antyseptyczne (antiseptica). Wydzielone z surowców olejki eteryczne (przez destylację z parą wodną) są również artykułami farmakopealnymi i lekospisowymi stosowanymi w lecznictwie, poza tym często stosuje się je w przemyśle spożywczym i kosmetycznym (1, 3, 17).
Pozyskiwanie lotnych składników roślin w warunkach laboratoryjnych wykonywane jest różnymi metodami. Otrzymywanie olejków eterycznych przez destylację z parą wodną przeprowadza się w szklanych aparatach, których prototypem jest aparat Clevengera, a polską odmianą aparat Derynga. Równoczesną destylację i ekstrakcję umożliwia aparat Liekensa-Nickersona. Jak podaje piśmiennictwo (18), zastosowanie tego aparatu podnosi wydajność i skraca czas ekstrakcji.
Dobrymi metodami otrzymywania i oznaczania olejków eterycznych mogą być metody: ekstrakcji nadkrytycznej SFE (19, 20), ekstrakcji podkrytycznej z wykorzystaniem wysokosprawnej chromatografii gazowej (HRGC) (21) oraz LC/MS (22).
Jedną z nowych technik oznaczania lotnych składników jest metoda SPME (Solid Phase Microextraction). Polega ona na sorbcji lotnych składników na specjalnym włóknie strzykawki oraz ich desorbcji w dozowniku aparatu. Obecnie technikę SPME możemy łączyć z chromatografią gazową (GC) oraz wysokosprawną chromatografią cieczową (HPLC) (23-30).
Stosując metodę SPME można osiągnąć wykrywalność związków lotnych rzędu 5-50 ppt. W metodzie tej nie używa się wielu rozpuszczalników, a czas przygotowania próbki do analizy wynosi 2-15 min (31).
Flawonoidy – biogeneza, właściwości, występowanie i zastosowanie
Biosynteza flawonoidów jest procesem złożonym. Pierścień aromatyczny A powstaje przy udziale fragmentów malonowych C3 – w formie aktywowanej koenzymem A, natomiast powstały fragment C6-C3 tworzy się z jednostki fenylopropanowej, której prekursorem jest aktywny kwas cynamonowy. Przyjmuje się, że produktem pośrednim biosyntezy flawonoidów jest odpowiedni chalkon. Kwas cynamonowy jest z kolei związany biogenetycznie z fenyloalaniną, a pośrednio z kwasem szikimowym, podobnie jak kwas p-kumarowy z tyrozyną. Cyklizacja kwasu cynamonowego lub p-kumarowego do chalkonu zachodzi przy współudziale 2 cząsteczek malonylo-koenzymu A. Z nietrwałego produktu pośredniego, tj. chalkonu, powstaje układ flawonu i jego wszystkie możliwe modyfikacje. Izoflawony powstają z tych samych prekursorów,
jedynie podczas biosyntezy następuje migracja arylu. Schemat biosyntezy flawonoidów przedstawiono na rycinie 3 (1, 32).

Ryc. 3. Schemat biogenezy flawonoidów (1, 32).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Kohlmunzer S. Farmakognozja. PZWL, Warszawa 1998; 669. 2. Klimek R. Olejki eteryczne. WPLS, Warszawa 1957; 482. 3. Melchior H, Kastner H. Przyprawy – badania botaniczne i chemiczne. WNT, Warszawa 1978; 354 4. Rumińska A, Suchorska K, Węglarz Z. Rośliny lecznicze i specjalne. Wiadomości ogólne. Wyd. SGGW-AR, Warszawa 1990; 111. 5. Waksmundzka-Hajnos M. Badanie selektywności układów chromatograficznych typu polarny adsorbent-dwuskładnikowy eluent pod kątem ich wykorzystania do analizy i izolacji związków farmakologicznie czynnych. Dysertacje chromatograficzne. Wyd AM, Lublin 1998; 140. 6. Ludwiczuk A, Najda A, Wolski T i wsp. Chromatographic determination of the content and the composition of extracts and essential oils from the fruits of three varieties of stalk celery (Apium graveolens L. var. dulce Mill Pers.). J Plan Chromatogr 2001; 14:400-4. 7. Lis A, Góra J. Zmienność składu chemicznego olejków eterycznych. Aromaterapia 2000; 1(19):28-34. 8. Baser KH, Kosar M, Malyer H i wsp. The essential oil composition of Dictamnus albus from Turkey. Planta Med 1994; 60:481-2. 9. Treibs W, Bournot K, Die Atherischen Ole. Akademie Verlag, Berlin 1959; 422-3. 10. Kubeczka KH, Koch V, Ney EM. Das Geheimnis des brennenden Busches. Deutsch Apth Ztg 1990; 130(40):2181-5. 11. Fleming T (red). PDR for Herbal Medicines. Med Econom Comp, Montvale 2000; 806. 12. Kostyniuk M, Marczek E. Nasze rośliny chronione. Wrocł Tow Nauk, Wrocław 1961; 82. 13. Hegi G. Illustrierte Flora von Mittel Europa. J.I. Lehmanns Verlag, Monachium 1937; 74. 14. Nowiński M. Rośliny lecznicze flory polskiej. Tow Przyjaciół Nauk, Poznań 1959; 143. 15. Weryszko-Chmie-lewska E. Budowa gruczołów wydzielniczych występujących na powierzchni słupków i owoców dyptamu jesionolistnego (Dictamnus albus L.). Annales UMCS, Sec EEE, 2001; 9(Suppl): 339-45. 16. Gertig H, Grabarczyk H. Zawartość alkaloidów i olejku w dyptamie jesionolistnym (Dictamnus albus L.) w okresie rocznej wegetacji. Dissert Pharm 1960; 12(3):229-36. 17. Brud WS, Konopacka I. Pachnąca apteka – tajemnice aromaterapii. Comes, Warszawa 1993; 152. 18. Kalemba D. Składniki i właściwości biologiczne olejków eterycznych z roślin z rodzajów Solidago i Artemisia. Zesz Nauk (Łódź) 2000; (857):118. 19. Lang Q, Wai CM. Supercritical fluid extraction in herbal and natural product studies – a practical review. Talanta 2001; 53:771-82. 20. Wolski T, Ludwiczuk A, Kędzia B i wsp. Preparatywna ekstrakcja gazami w stanie nadkrytycznym (SFE) zespołów furanokumarynowych oraz ocena ich aktywności przeciwgrzybiczej. Herba Pol 2000; 46(4):332-9. 21. Stashenko EE, Acosta R, Martinez JR. High-resolution gas chromatographic analysis of the secondary metabolites obtained by subcritical-fluid extraction from Colombian rue (Ruta graveolens L.). J Biochem Biophys Methods 2000; 43:379-90. 22. Dugo P, Mondello L, Dugo L i wsp. LC-MS for the identification of oxygen heterocyclic compounds in citrus essential oils. J Pharm
Biochem Anal 2000; 24:147-54. 23. Namieśnik J, Gorlo D, Wolska L i wsp. On calibration of solid phase microextraction-Gas
Chromatography-Mass Spectrometry system for analysis of organic air contaminants using gaseous standard mixtures. Chem Anal 1999; 44:201-13. 24. Prosen H, Zupancic-Kralj L. Solid-phase microextraction. Trends Anal Chem 1999; 18(4):272-82. 25. Wardecki W, Namieśnik J. Studies on the application of solid-phase microextraction for analysis of volatile organic sulphur compounds in gaseous and liquid samples. Chem Anal 1999; 44:485-93. 26. Alpendurada MF. Solid-phase microextraction: a promising technique for sample preparation in environmental analysis. J Chromatogr A 2000; 889:3-14. 27. Fuchs S, Beck T, Mosandl A. Biogenetic research into essential oils using SPME enantio-MDGC/MS. GIT Lab J 2000; 2:199-201. 28. Lord H, Pawliszyn J. Evolution of solid-phase microextraction technology. J Chromatogr A 2000; 885:153-93. 29. Vereen DA, McCall JP, Butcher DJ. Solid phase microextraction for the determination of volatile organics in the foliage of Fraser fir (Abies fraseri). Microchem J 2000; 65:269-76. 30. Buszewski B, Ligor M. Qualitative and quantitative analyses of volatile organic compounds in wines using SPME-GC. Chem Anal 2001; 46:215-24. 31. Witkiewicz Z. Podstawy chromatografii. WN-T, Warszawa 1995; 367. 32. Kączkowski J. Biochemia roślin. T I . Przemiany typowe. PWN, Warszawa 1992. 33. Jerzmanowska Z. Substancje roślinne. Metody wyodrębniania. PWN, Warszawa 1967. 34. Borkowski B (red). Chromatografia cienkowarstwowa w analizie farmaceutycznej. PZWL, Warszawa 1973; 234. 35. Małolepsza U, Urbanek H. Flawonoidy roślinne jako związki biochemicznie czynne. Wiad Bot 2000; 44:27-37. 36. Robak J, Gryglewski R. Bioactivity of flavonoids. Pol J Pharmacol 1996; 48:555-64. 37. Grabarczyk H. Związki flawonoidowe w liściach i kwiatostanach dyptamu jesionolistnego – Dictamnus albus L. Dissert Pharm 1964; 16(2):177-82. 38. Souleles C. A new flawonoid glycoside from Dictamnus albus. J Nat Prod 1989; 52(6):1311-2. 39. Souleles C, 1989. Flawonoids from Dictamnus albus. Planta Med 1989; 55:402. 40. Komissarenko HF, Lewashowa IG, Akhmedov UA. Coumarins and flawonoids of Dictamnus angustifolius. Khim Prir Soedin 1984; 8(2):247-8. 41. Komissarenko HF, Lewashowa IG, Nadjozhina TP. Flawonoids and coumarins of Dictamnus dasycarpus. Khim Prir Soedin 1983; 7:529-30. 42. Zhao W, Wolfender JL, Hostettmann K i wsp. Antifungal alkaloids and limonoid derivatives from Dictamnus dasycarpus. Phytochem 1998; 47(1):7-11. 43. Chang J, Xuan LJ, Xu YM i wsp. Seven new sesquiterpene glycosides from the root bark of Dictamnus dasycarpus. J Nat Prod 2001; 64:935-8. 44. Szyszkin BK, Bobrow EG. Flora USSR. Izd Akad Nauk, Moskwa-Leningrad 1949; 227. 45. Volak J, Stodola I. Rośliny lecznicze. PWRiL, Warszawa 1987; 142. 46. Renner W. Betrage zur Kenntnis der Biogenese sekundarer Pflanzenstoffe von Dictamnus albus L. Pharmazie 1962; 17(12):763-76. 47. Roth L, Daunderer M, Kormann K. Giftpflanzen Pflanzengigte. Nikol Verlagsgesellschaft GmbH & Co KG, Hamburg 1994; 301. 48. Zhao W, Wolfender JL, Hostettmann K i wsp. Antifungal alkaloids and limonoid derivatives from Dictamnus dasycarpus. Phytochem 1998; 47(1):7-11. 49. Takeuchi N, Fujita T, Goto K i wsp. Dictamnol, a new trinor-guaiane type sesquiterpene, from the roots of Dictamnus dasycarpus Turcz. Chem Pharm Bull 1993; 41(5):923-5. 50. Koike T, Yamazaki K, Fukumoto N i wsp. Total synthesis of dictamnol, a trinor-guaiane type sesquiterpene from the roots of Dictamnus dasycarpus Turcz. Chem Pharm Bull 1996; 44(4):646-52. 51. Bentley Kw (Ed.). The alkaloids. interscience publishers ltd. New York-London. 1957; 128. 52. Mowszowicz J. Rośliny trujące lub szkodliwe dla człowieka. PZWL, Warszawa 1952; 159-60. 53. Najjar S, Cordell GA, Farnsworth NR. Alkaloids and coumarins from Zanthoxylum belizense. Phytochem 1975; 14:2309-10. 54. Świejkowski L. Ochrona roślin w Polsce. Poziom Łódź 1956; 311-4. 55. Procyk A. Krzak gorejący – dyptam jesionolistny. Wiad Ziel 1987; (7):14. 56. Anioł-Kwiatkowska J, Kwiatkowski S, Berdowski W. Rośliny lecznicze – atlas. Wyd Arkady, Warszawa 1993; 100. 57. Strzelecka H, Kowalski J. (red). Encyklopedia zielarstwa i ziołolecznictwa. PWN, Warszawa 2000; 120-1. 58. Tanaka S, Saito M, Tabata M. Bioassay of crude drugs for hair growth promoting activity in mice by a new simple method. Planta Med Suppl 1980; 84-90. 59. Harper J. Traditional Chinense medicine for eczema. BMJ 1994; 308(6927):489-90. 60. Blackwell R. Adverse events involving certain Chinense herbal medicines and the response of the profession. J Chin Med 1996; 50:20-31. 61. Brahams D. Standard of care alternative medicine. Lancet 2000; 356(9239):1422. 62. Wolters B, Eilert U. Antimicrobial substances in callus cultures of Ruta graveolens. Planta Med 1981; 43:166-74. 63. Towers GH, Graham EA, Spenser ID i wsp. Phototoxic furanoquinolines of Rutaceae. Planta Med. 1981; 41:136-42. 64. Borkowski B. Fenolokwasy i ich estry. Cz I. Herba Pol 1993; 39(1-2):71-83. 65. Borkowski B. Fenolokwasy i ich estry. Cz II. Herba Pol 1993; 39(3):139-45.





