*Inga Kwiecień, Beata Kawka, Halina Ekiert
Tarczyca bocznokwiatowa (Scutellaria lateriflora) – znaczenie w medycynie tradycyjnej i pozycja we współczesnej fitoterapii
American skullcap (Scutellaria lateriflora) – significance in traditional medicine and position in modern phytotherapy
Katedra i Zakład Botaniki Farmaceutycznej, Wydział Farmaceutyczny, Uniwersytet Jagielloński – Collegium Medicum, Kraków
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. Halina Ekiert
Streszczenie
Tarczyca bocznokwiatowa (Scutellaria lateriflora L.) jest gatunkiem wykorzystywanym od dawna w celach leczniczych przez plemiona Indian północnoamerykańskich. Monografia Scutellariae lateriflorae herba figuruje od 2009 roku w American Herbal Pharmacopoeia. Surowiec cieszy się w Ameryce Północnej ogromną popularnością ze względu na jego działanie uspokajające. Ceniony jest także w Australii. Na terenie Europy, jak dotąd popularny jest w Wielkiej Brytanii. Głównymi składnikami ziela tego gatunku są swoiste dla rodzaju Scutellaria flawonoidy (głównie bajkaleina, bajkalina, wogonina, skutelaryna). Towarzyszą im inne grupy związków: diterpenoidy – pochodne neoklerodanu, kwas γ-aminomasłowy, melatonina, serotonina, katalpol, kwasy fenolowe, glikozydy fenylopropanoidowe (głównie werbaskozyd) oraz olejek eteryczny. Badania dotyczące składu chemicznego i leczniczego działania surowca potwierdzają znane z północnoamerykańskiej tradycyjnej medycyny możliwe zastosowania. Wyniki prac udowadniają głównie znaczenie związków flawonoidowych obecnych w surowcu, w udokumentowanych kierunkach aktywności biologicznej. Celem artykułu jest przedstawienie aktualnej wiedzy na temat składu chemicznego i znaczenia leczniczego tej cennej rośliny. Zespół pracowników Zakładu Botaniki Farmaceutycznej UJ CM rozpoczął badania biotechnologiczne tego gatunku. Rosnące z powodzeniem w warunkach in vitro mikropędy wytwarzają znaczne ilości swoistych flawonoidów (głównie bajkaliny i wogonozydu) oraz werbaskozydu i mogą w przyszłości stanowić bogate alternatywne źródło tych związków dla celów farmaceutycznych i kosmetycznych.
Summary
American skullcap (Scutellaria lateriflora L.) has long been used as a medicine by North American Indian tribes. A monograph of Scutellariae lateriflorae herba was included in the American Herbal Pharmacopoeia in 2009. This raw material is very popular in North America because of its sedative action. It is also highly valued in Australia, while in Europe, it has been widely used until now in the United Kingdom. The main components of the herb of this plant species include flavonoids specific for the Scutellaria genus, mostly baicalein, baicalin, wogonin, scutellarin. They are accompanied by other groups of compounds: diterpenoids – neoclerodan derivatives, γ-aminobutyric acid, melatonin, serotonin, catalpol, phenolic acids, phenylpropanoid glycosides (mostly verbascoside) and essential oil. Studies of chemical composition and investigation of medicinal activity of this raw material confirmed its uses known from North American folk medicine. Study results proved most of all a significance of flavonoid compounds present in the raw material for its documented biological activity. The aim of the paper is to review the present knowledge on chemical composition and medicinal significance of this very valuable plant. The research team from the Department of Pharmaceutical Botany JU MC initiated biotechnological studies of this species. Its microshoots successfully grown in vitro produce considerable amounts of specific flavonoids (mostly baicalin and wogonoside) and verbascoside, and in future they can be an alternative rich source of these compounds for pharmaceutical and cosmetic applications.

Wprowadzenie
Najbardziej znanym w Europie, w tym także w Polsce, leczniczym gatunkiem z rodzaju Scutellaria jest wschodnioazjatycki gatunek Scutellaria baicalensis Georgi – tarczyca bajkalska. Surowiec leczniczy pozyskiwany z tego gatunku – Scutellariae baicalensis radix, bogate źródło swoistych dla rodzaju Scutellaria flawonoidów, takich jak: bajkalina, bajkaleina, wogonina, wogonozyd, figuruje wśród stosunkowo nowych surowców leczniczych wprowadzonych do oficjalnego lecznictwa europejskiego, w tym polskiego. Innym w niewielkim stopniu znanym w Europie gatunkiem z rodzaju Scutellaria jest północnoamerykański gatunek Scutellaria lateriflora L. – tarczyca bocznokwiatowa. Ziele tego gatunku wykorzystywane jest powszechnie w USA i Kanadzie w celach leczniczych jako surowiec o właściwościach uspokajających. W Europie popularność tego surowca ograniczona jest dotychczas do terenu Wielkiej Brytanii (1, 2).
Tarczyca bocznokwiatowa jest jednym z najczęściej stosowanych surowców uspokajających w północnoamerykańskim ziołolecznictwie. Była używana przez Indian północnoamerykańskich jako środek diuretyczny, tonizujący oraz uspokajający. Do tradycyjnej medycyny amerykańskiej została wprowadzona prawdopodobnie pod koniec XVIII wieku. Z tego okresu pochodzi nazwa „mad-dog skullcap” oznaczająca jej zastosowanie w leczeniu wścieklizny. Później była stosowana jako środek wzmacniający, a w połączeniu z innymi roślinami leczniczymi jako środek uspokajający. Obecnie w lecznictwie nadal wykorzystywane są właściwości uspokajające tarczycy bocznokwiatowej w takich chorobach, jak pobudliwość, nerwowość czy neuralgia. Choć gatunek ten cieszy się długą tradycją stosowania, głównie na kontynencie północnoamerykańskim, brakuje rzetelnych badań farmakologicznych i klinicznych. Ogranicza to naszą wiedzę na temat jego działań oraz możliwości leczniczych. Ziele S. lateriflora ma od 2009 roku monografię w American Herbal Pharmacopoeia (3). W lecznictwie środkowoeuropejskim jest znane w ograniczonym stopniu.
Rodzaj Scutellaria
Rodzaj Scutellaria należy do podrodziny Scutellarioideae. Podrodzina ta stanowi jedną z 7 podrodzin rodziny Lamiaceae. Należą do niej głównie rośliny zielne i byliny, rzadziej krzewy. Dane piśmiennictwa wskazują, że w porównaniu do pozostałych podrodzin, w podrodzinie Scutellarioideae rzadko spotykane są lotne terpenoidy i olejki eteryczne oraz brak jest kwasu rozmarynowego, występują natomiast irydoidy oraz czasami werbaskozyd. Na podrodzinę składa się tylko jeden rodzaj Scutellaria, który obejmuje około 360 gatunków. W Polsce występują trzy gatunki: Scutellaria galericulata L. (tarczyca pospolita), Scutellaria altissima L. (t. wyniosła) oraz Scutellaria hastifolia L. (t. oszczepolistna) (4). Gatunkiem najbardziej znanym w Polsce i na świecie jest pochodząca z Azji Scutellaria baicalensis (tarczyca bajkalska) (5).
Charakterystyka botaniczna Scutellaria lateriflora
Scutellaria lateriflora ma swoje naturalne stanowiska w Ameryce Północnej. Preferowanymi przez ten gatunek siedliskami są podmokłe zarośla, łąki oraz lasy. Jest to bylina o wzniesionych, silnie rozgałęzionych, w przekroju tetragonalnych pędach, osiągająca do 0,5 m wysokości. Gatunek ten ma owalne lub owalno-lancetowate, krótkoogonkowe, zaokrąglone u podstawy, słabo owłosione liście, ułożone naprzeciwlegle na pędach. Mają one od 3 do 11 cm długości oraz od 1,5 do 5,5 cm szerokości. Kwiaty tarczycy bocznokwiatowej są niebiesko-fioletowe i tworzą liczne grona. Są one najmniejsze (do 1 cm) wśród kwiatów wszystkich gatunków z rodzaju Scutellaria. Nazwa gatunku związana jest z faktem, że większość kwiatów nie występuje w górnej części pędu głównego, ale wzdłuż bocznych odgałęzień wyrastających z kątów liści. Owocami są drobne orzeszki, spłaszczone z dwóch stron, o brodawkowanej, czerwonawo-brązowej powierzchni (ryc. 1) (6, 7).

Ryc. 1. Scutellaria lateriflora L. (1)
Flawonoidy występujące w rodzaju Scutellaria
W rodzaju Scutellaria występują swoiste związki flawonoidowe z grupy flawonów (ryc. 2). W aglikonach tych związków występuje od 2 do 6 grup hydroksylowych lub metoksylowych, a także cząsteczki kwasu glukuronowego przyłączone do szkieletu flawonu poprzez atom tlenu grupy hydroksylowej przy węglu w pozycji 7. Do głównych flawonoidowych aglikonów obecnych w rodzaju Scutellaria należą: bajkaleina, wogonina, skutelareina, oroksylina A i chryzyna. Ponadto występują glikozydowe połączenia o następujących nazwach: bajkalina, wogonozyd, skutelaryna oraz glukuronid oroksyliny A i chryzyny (8, 9).
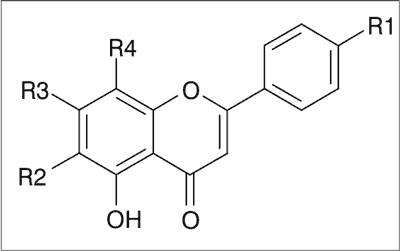 |
| Flawonoid | R1 | R2 | R3 | R4 |
| Bajkaleina | -H | -OH | -OH | -H |
| Bajkalina | -H | -OH | -O-kwas glukuronowy | -H |
| Wogonina | -H | -H | -OH | -OCH3 |
| Wogonozyd | -H | -H | -O-kwas glukuronowy | -OCH3 |
| Skutelareina | -OH | -OH | -OH | -H |
| Skutelaryna | -OH | -OH | -O-kwas glukuronowy | -H |
| Oroksylina A | -H | -OCH3 | -OH | -H |
| Chryzyna | -H | -H | -OH | -H |
Ryc. 2. Struktura chemiczna głównych flawonoidów charakterystycznych dla rodzaju Scutellaria
Charakterystyka chemiczna Scutellaria lateriflora
Istnieje niewiele danych na temat składu chemicznego tarczycy bocznokwiatowej. Dostępne badania ziela oraz korzenia tej rośliny sugerują, że ich skład chemiczny jest podobny do składu chemicznego tarczycy bajkalskiej (Scutellaria baicalensis).
Podstawowymi składnikami ziela S. lateriflora są swoiste dla rodzaju Scutellaria flawonoidy z grupy flawonów. Surowiec zawiera głównie glikozydy flawonoidowe z bajkaliną, jako dominującym ilościowo składnikiem (~5%), dihydrobajkalinę, lateriflorynę, ikonikozyd I, skutelarynę, jak również aglikony: bajkaleinę, oroksylinę A, wogoninę i laterifloreinę (ryc. 2) (3, 8-10). Poza tym w ekstraktach z tarczycy stwierdzono obecność kwasu cynamonowego, a także kwasów fenolowych – kawowego, p-kumarowego i ferulowego (3, 5), glikozydu fenylopropanoidowego – werbaskozydu (9) oraz 3 kumarynowych połączeń z grupy piranokumaryn (11). W zielu tarczycy wykryto również 5 diterpenoidów, pochodnych neoklerodanu. Zostały one zidentyfikowane jako skutelateryna A, skutelateryna B, skutelateryna C, ajugapityna oraz skutecyprol A (ryc. 3) (12). Istotnymi składnikami ziela są także: katalpol (ryc. 3) z grupy irydoidów i inne substancje gorzkie, ligniny, żywice oraz garbniki (3).
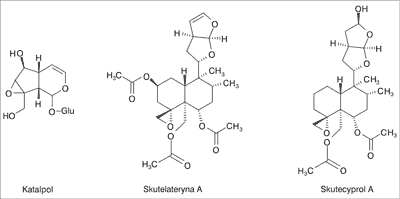
Ryc. 3. Struktura chemiczna wybranych charakterystycznych metabolitów wtórnych Scutellaria lateriflora
Tarczyca bocznokwiatowa zawiera również olejek eteryczny o bogatym, lecz nie do końca ustalonym składzie. Dane dotyczące składu olejku są ograniczone i często sprzeczne. Dominującą frakcję stanowią związki seskwi- i monoterpenoidowe. W olejku wykryto również aldehyd cynamonowy, safrol oraz kilka składników mających strukturę alifatyczną (3, 5). W różnych ekstraktach z ziela S. lateriflora stwierdzono obecność aminokwasów, głównie glutaminy i kwasu γ-aminomasłowego (3). Potwierdzono również obecność niewielkich ilości neurotransmiterów indolowych – melatoniny oraz serotoniny (13). Nadziemne części Scutellaria lateriflora zawierają poza tym wosk złożony z alkanów prostych i rozgałęzionych (14).
Pomimo dużych podobieństw w składzie jakościowym metabolitów wtórnych S. lateriflora i S. baicalensis istnieją różnice między tymi gatunkami w składzie ilościowym, potwierdzone badaniami fitochemicznymi (metodami HPLC), szczególnie dotyczące profilu flawonoidów. W liściach S. lateriflora bajkalina jest flawonoidem dominującym (~5%), natomiast bajkaleina i wogonozyd występują w znacznie niższych stężeniach (~0,06 i ~0,01%). Korzenie tego gatunku są uboższe w metabolity, ale również bajkalina jest głównym związkiem (~1%). Natomiast w korzeniach S. baicalensis bajkalina występuje w przybliżeniu w takim samym stężeniu, jak w liściach S. lateriflora (~5%), podczas gdy bajkaleina i wogonozyd występują w znacznie większych stężeniach (~5,9 i ~0,9%). Liście S. baicalensis charakteryzują się bardzo niskimi stężeniami zarówno bajkaliny, jak i wogoniny (9, 13, 15).
Różne gatunki ożanki (Teucrium), którym przypisuje się hepatotoksyczność (głównie ożanka właściwa – Teucrium chamaedrys oraz ożanka kanadyjska – T. canadense), są często wymieniane jako potencjalne surowce stosowane do fałszowania ziela S. lateriflora. Gatunki Teucrium charakteryzują się obecnością glikozydów fenylopropanoidowych, w szczególności teukriozydu (T. chamaedrys) oraz werbaskozydu i teukriozydu (T. canadense), a także brakiem głównych flawonoidów obecnych w tarczycy. Teucrium canadense zawiera także diterpenoidy – teuflinę i teucrynę; związki te nie zostały wykryte w S. lateriflora (6, 16).
Główne grupy związków chemicznych występujących w S. lateriflora przedstawiono w tabeli 1.
Tab. 1. Główne grupy związków chemicznych, których obecność stwierdzono w Scutellaria lateriflora L.
Flawonoidy
| aglikony o swoistej budowie:
bajkaleina, oroksylina A, wogonina, 5,6,7-trihydroksy-2’-metoksyflawon (laterifloreina), skutelareina, chryzyna
ich glikozydy: bajkalina, dihydrobajkalina, laterifloryna, ikonikozyd I, skutelaryna, 7-O-glukoronid oroksyliny A, 7-O-glukoronid 2’-metoksychryzyny, wogonozyd,
7-O-glukoronid norwogoniny, 7-O-glukoronidgalaginy,
7-O-glukoronid dihydrooroksyliny A,
7-O-glukoronid dihydrowogoniny, 7-O-glukoronid 5,7-dihydroksy-6,8-dimetoksyflawonu, 7-O-glukoronid dihydroksyskutelareiny,
7-O-glukoronid tetrahydroksyflawonu, 7-O-ramnozyd bajkaleiny
popularne związki flawonoidowe:
apigenina, hispidulina, luteolina, witeksyna (3, 8-10) |
| Kwasy fenolowe | kwas kawowy, kwas p-kumarowy, kwas ferulowy (3, 5) |
| Inne kwasy | kwas cynamonowy (3, 5) |
| Olejek eteryczny | seskwiterpenoidy: δ-kadinen, kalamenen, β-elemen, α-kubenen, α-humulen, α-bergamoten, guaiol, tlenek kariofylenu, kariofylen, trans-β-farnezen, β-humulen
monoterpenoidy: β-pinen, kamfen, limonen, terpineol
aldehyd cynamonowy, safrol (3, 5) |
| Diterpenoidy | skutelateryna A, skutelateryna B, skutelateryna C, ajugaptyna, skutecyprol A (12) |
| Kumaryny | skutefloryna A, skutefloryna B, dekursyna (11) |
| Inne istotne składniki | melatonina, serotonina (13), werbaskozyd (9), irydoidy (katalpol), lignina, żywice, garbniki (3) |
Aminokwasy
| glutamina, kwas γ-aminomasłowy (3)
tryptofan, fenyloalanina, prolina, kwas glutaminowy, arginina, asparagina, kwas asparaginowy, tyrozyna, izoleucyna, leucyna, walina (6) |
| Wosk | n-nonakosan, n-hentriakontan, n-tritrikontan, n-pentatriakontan, 3,9-dimetyloalkany, 2-metyloalkany, 3-metyloalkany (14) |
Surowiec leczniczy
Surowcem leczniczym jest wysuszone ziele lub liście 3-4-letnich roślin zbieranych najczęściej w czerwcu. Części nadziemne tarczycy są ścinane po kwitnieniu i sprzedaje się je w formie świeżej lub wysuszonej. Suszony surowiec dostępny jest w całości, pocięty lub sproszkowany. Materiał handlowy zazwyczaj składa się z łodygi, liści i kielicha kwiatowego, z dość małą i zmienną liczbą fragmentów płatków korony kwiatowej, w zależności od czasu zbioru, oraz niewielkiej ilości nasion (3).
Tarczycę można zafałszować innymi gatunkami Scutellaria, a także, ze względu na bliskie podobieństwo morfologiczne, różnymi gatunkami ożanki. W związku z tym istotne jest zwrócenie szczególnej uwagi na pochodzenie surowca oraz jego identyfikację (6, 17). Istnieją też doniesienia, że niektóre zapasy nasion sprzedawane jako S. lateriflora mogą być nieprawidłowo oznaczone (prawdopodobnie S. incana). Sugeruje to konieczność weryfikacji tożsamości gatunkowej populacji upraw podczas kwitnienia lub przeprowadzenia analiz genetycznych. Ziele Scutellaria lateriflora ma swoją monografię w American Herbal Pharmacopoeia, w której podano szczegółowe wskazówki potwierdzające tożsamość surowca różnymi metodami (3).
Tarczyca bocznokwiatowa jest szeroko wykorzystywana na rynku zielarskim Ameryki Północnej. Gatunek ten można pozyskać ze stanowisk naturalnych lub z upraw. W USA, z siedlisk naturalnych rośliny są zbierane sporadycznie. Większość dostaw na rynku amerykańskim pochodzi z upraw prowadzonych na terenie USA (stany: Minnesota, Missouri, Karolina Północna, Oregon, Waszyngton) lub z importu – uprawy w Chile, Kostaryce i Meksyku (7). Wiele firm, które produkują preparaty ziołowe zawierające tarczycę bocznokwiatową, ma własne uprawy. Tarczyca naturalnie rośnie w cienistych, wilgotnych ekosystemach, ale może być z powodzeniem rozmnażana zarówno z nasion, jak i przez podział. Gatunek ten preferuje częściowe lub całkowite zacienienie oraz wilgotne gleby gliniaste, ale dobrze radzi sobie też na glebach piaszczystych, o ile ziemia nie wysycha latem. Może rosnąć w pełnym słońcu, jednak biomasa w tych warunkach nie rozwinie się w pełni, natomiast w klimacie suchym i gorącym wymagane jest stosowanie zacieniania. Nasiona tarczycy przechowuje się w chłodnym, suchym miejscu. Tarczyca nie jest na ogół uszkadzana przez owady, ale jest podatna na choroby wirusowe (6, 7).
Zarówno piśmiennictwo historyczne, jak i współczesne analizy sugerują, że ziele tarczycy powinno być zbierane w stadium kwitnienia, między czerwcem a wrześniem. Podczas zbioru należy przyciąć część nadziemną, pozostawiając około 10 cm łodygi i co najmniej 2 węzły liściowe na każdej łodydze. Pozwala to na powstanie odrostów i odtworzenie uprawy. Po zebraniu materiał jest wrażliwy na nagrzewanie i nie powinien być poddawany ściskaniu (17).
W roślinach uprawianych w Australii stwierdzono, że zawartość flawonoidów jest najwyższa podczas kwitnienia i przed rozwojem owoców. W zależności od części rośliny wynosiła ona 5,29% s.m. – liść, 3,24% s.m. – korzeń oraz 2,29% s.m. – łodyga. Głównym związkiem we wszystkich organach była bajkalina (w ilości 40-50% flawonoidów). Młode liście wykazywały wyższe stężenia flawonoidów niż liście starsze, ale zwiększona biomasa dojrzałych roślin rekompensowała tę różnicę (18). Nie zaobserwowano spadku zawartości flawonoidów w wysuszonym materiale, jednakże obciążenie mechaniczne rośliny (np. ściskanie czy miażdżenie świeżo ściętej rośliny) powoduje znaczną utratę flawonoidów.
Brakuje szczegółowych badań dotyczących optymalnych warunków suszenia ziela tarczycy. Wykazano jednak, że wysoka temperatura suszenia (40-70oC) nie wpływa na zawartość flawonoidów w surowcu (18). Zaleca się przechowywanie ziela w suchych pomieszczeniach (wilgotność do 10%), gdyż zawartość flawonoidów tarczycy zależy zarówno od wilgotności, jak i czasu przechowywania (6).
Ekstrakty wodno-etanolowe (40-60%) wykazują prawie o 50% większy spadek zawartości flawonoidów w trakcie przechowywania niż spadek stwierdzony w wysuszonym zielu tarczycy. Może to wskazywać na konieczność przygotowywania świeżych nalewek lub stosowanie stabilizatorów w celu przedłużenia okresu trwałości produktów (18). Szczegółowe dane dotyczące mechanizmu rozkładu składników w ekstraktach etanolowych nie zostały jeszcze ustalone.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Millspaugh F. American Medicinal Plants. Boericke & Tafel, New York 1887. https://upload.wikimedia.org/wikipedia/commons/thumb/b/bf/Scutellaria_lateriflora00.jpg/170px-Scutellaria_lateriflora00.jpg.
2. Farmakopea Polska, Wyd. IX. Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Warszawa 2011.
3. Upton R. Scutellaria lateriflora. W: Am Herbal Pharmacopoeia. Brinckmann, Scotts Valley, USA 2009.
4. Mirek Z, Piękoś-Mirkowa H, Zając A i wsp. Krytyczna lista roślin naczyniowych Polski. PAN, Kraków 2002.
5. Barnes J, Anderson LA, Phillipson JD. Scullcap. Herbal Medicines. The Pharmaceutical Press, London 2007; 530.
6. Upton R, d’Ayu RH. Skullcap Scutellaria lateriflora L.: An American nervine. J Herb Med 2012; 2:76-96.
7. Joshee N, Patrick TS, Mentreddy RS i wsp. Skullcap: potential medicinal crop. ASHS Press Alexandria 2002; 580-6.
8. Awad R, Arnason JT, Trudeau V i wsp. Phytochemical and biological analysis of skullcap (Scutellaria lateriflora L.): a medicinal plant with anxiolytic properties. Phytomed 2003; 10:640-9.
9. Islam MN, Downey F, Ng CKY. Comparative analysis of bioactive phytochemicals from Scutellaria baicalensis, Scutellaria lateriflora, Scutellaria racemosa, Scutellaria tomentosa and Scutellaria wrightii by LC-DAD-MS. Metabolomics 2011; 7(3):446-53.
10. Li J, Wang Y-H, Smillie TJ i wsp. Identification of phenolic compounds from Scutellaria lateriflora by liquid chromatography with ultraviolet photodiode array and electrospray ionization tandem mass spectrometry. J Pharm Biomed 2012; 63:120-7.
11. Li J, Ding Y, Li X-C i wsp. Scuteflorins A and B, Dihydropyranocoumarins from Scutellaria lateriflora. J Nat Prod 2009; 72:983-7.
12. Bruno M, Cruciata M, Bondi ML i wsp. Neo-clerodane diterpenoids from Scutellaria lateriflora. Phytochem 1998; 48:687-91.
13. Cole IB, Cao J, Alan AR i wsp. Comparisons of Scutellaria baicalensis, Scutellaria lateriflora and Scutellaria racemosa: genome size, antioxidant potential and phytochemistry. Planta Med 2008; 74:474-81.
14. Yaghmai S, Khayat MH. Epicuticular wax alkanes in Scutellaria lateriflora L. leaves. Iran J Chem Eng 1987; 6:26-30.
15. Makino T, Hishida A, Goda Y i wsp. Comparison of the major flavonoid content of S. baicalensis, S. lateriflora, and their commercial products. J Nat Med 2008; 62:294-9.
16. Lin LZ, Harnly JM, Upton R. Comparison of the phenolic component profiles of skullcap (Scutellaria lateriflora) and germander (Teucrium canadense and T. chamaedrys), a potentially hepatotoxic adulterant. Phytochem Anal 2009; 20:298-306.
17. Cole IB, Farooq FT, Murch SJ. Protocols of establishment of an in vitro collection of medicinal plants in the genus Scutellaria. Methods in molecular biology. Human Press 2009; 547:155-65.
18. Wills RBH, Stuart DL. Generation of high quality Australian skullcap products. RIRDC. Barton, Australia 2004; 1-18.
19. Priest AW, Priest LR. Herbal medication: a clinical and dispensary handbook. LN Fowler, London 1982; 174.
20. Kuhn MA, Winston D. Winston and Kuhn’s herbal therapy and supplements, a scientific and traditional approach. Lippincott Williams & Wilkins Philadelphia 2001; 560.
21. McGuffin M, Hobbs C, Upton R i wsp. Botanical safety handbook. CRC Press, Boca Raton 1997.
22. Wolfson P, Hoffmann DL. An investigation into the efficacy of Scutellaria lateriflora in healthy volunteers. Altern Ther Health Med 2003; 9:74-8.
23. Kouzi SA, McMurtry RJ, Nelson SD. Hepatotoxicity of germander (Teucrium chamaedrys L.) and one of its constituent neoclerodane diterpenes teucrin A in the mouse. Chem Res Toxicol 1994; 7:850-6.
24. Xu Z, Wang F, Tsang SY i wsp. Anxiolytic-like effect of baicalin and its additivity with other anxiolytics. Planta Med 2006; 72:187-9.
25. Ueng YF, Shyu CC, Lin YL i wsp. Effects of baicalein and wogonin on drug-metabolizing enzymes in C57BL/6J mice. Life Sci 2000; 67:2189-220.
26. Jang SI, Kim HJ, Hwang KM i wsp. Hepatoprotective effect of baicalin, a major flavone from Scutellariae radix on acetaminophen-induced liver injury in mice. Immunopharm Immunot 2003; 25:585-94.
27. Kim JY, Lee S, Kim DH i wsp. Effects of flavonoides isolated from Scutellariae radix on cytochrome P-450 activities in human liver microsomes. J Toxicol Env Health 2002; 65:373-81.
28. Kubo M, Matsuda H, Tani T i wsp. Studies on Scutellariae radix. XII. Anti-thrombic actions of various flavonoids from Scutellariae radix. Chem Pharml Bull 1985; 33:2411-5.
29. Chen S, Hwang J, Deng PSK. Inhibition of NAD(P)H: quinine acceptor oxidoreductase by flavones: a structure-activity study. Arch Biochem Biophys 1993; 302:72-7.
30. Liu XF, Liu ML, Iyanagi T i wsp. Inhibition of rat liver NAD(P)H: quinone acceptor oxidoreductase (DT-diaphorase) by flavonoids isolated from the Chinese herb Scutellariae radix (huang qin). Mol Pharmacol 1990; 37:911-5.
31. Hoffmann DL. The holistic herbal. Element Books, Dorset, UK 1983; 271.
32. Tsai PL, Tsai TH. Pharmacokinetics of baicalin in rats and its interactions with cyclosporin A, quinidine and SKF-525A: a microdialysis study. Planta Med 2004; 70:1069-74.
33. Zhang L, Xing D, Wang W i wsp. Kinetic difference of baicalin in rat blood and cerebral nuclei after intravenous administration of Scutellariae radix extract. J Ethnopharmacol 2006; 103:120-5.
34. Peredery O, Persinger MA. Herbal treatment following post-seizure induction in rat by lithium pilocarpine: Scutellaria lateriflora (skullcap), Gelsemium sempervirens (gelsemium) and Datura stramonium (jimson weed) may prevent development of spontaneous seizures. Phytother Res 2004; 18:700-5.
35. Huen MSY, Leung JWC, Ng W i wsp. 5,7-Dihydroxy-6-methoxyflavone, a benzodiazepine site ligand isolated from Scutellaria baicalensis Georgi, with selective antagonistic properties. Biochem Pharmacol 2003; 66:125-32.
36. Wang H, Hui KM, Chen Y i wsp. Structure-activity relationships of flavonoids, isolated from Scutellaria baicalensis, binding to benzodiazepine site GABA A receptor complex. Planta Med 2002; 68:1059-62.
37. Hui KM, Huen MSY, Wang HY i wsp. Anxiolytic effect of wogonin, a benzodiazepine receptor ligand isolated from Scutellaria baicalensis Georgi. Biochem Pharmacol 2002; 64:1415-24.
38. Chen YC, Shen SC, Chen LG i wsp. Wogonin, baicalin, and baicalein inhibition of inductible nitric oxide synthase and cyclooxygenase-2 gene expressions induced by nitric oxide synthase inhibitors and lipopolysaccharide. Biochem Pharmacol 2001; 61:1417-27.
39. Calixto JB, Otuki MF, Santos AR. Anti-inflammatory compounds of plant origin. Part 1. Action on arachidonic acid pathway, nitric oxide and nuclear factor κB (NF-κB). Planta Med 2003; 69:973-83.
40. Calixto JB, Campos MM, Otuki MF i wsp. Anti-inflammatory compounds of plant origin. Part 2. Modulation of pro-inflammatory cytokines, chemokines and adhesion molecules. Planta Med 2004; 70:93-103.
41. Kubo M, Matsuda H, Tanaka M i wsp. Studies on Scutellariae radix. VII. Anti-arthritic and anti-inflammatory actions of methanolic extract and flavonoid components from Scutellariae radix. Chem Pharm Bull 1984; 32:2724-9.
42. Kubo M, Matsuda H, Kimura Y i wsp. Scutellariae radix. X. Inhibitory effects of various flavonoids on histamine release from rat peritoneal mast cells in vitro. Chem Pharm Bull 1984; 32:5051-4.
43. Nikaido T, Ohmoto T, Sankawa U i wsp. Inhibition of adenosine 3?.5?-cyclic monophosphate phosphodiesterase by flavonoids. II. Chem Pharm Bull 1988; 36:654-61.
44. Woźniak D, Lamer-Zarawska E, Matkowski A. Antimutagenic and antiradical properties of flavones from the roots of Scutellaria baicalensis Georgi. Nahrung 2004; 48:9-12.
45. Shieh DE, Liu LT, Lin CC. Antioxidant and free radical scavenging effects of baicalein, baicalin and wogonin. Anticancer Res 2000; 20:2861-5.
46. Hong H, Liu GQ. Scutellarin attenuates oxidative glutamate toxicity in PC12 cells. Planta Med 2004; 70:427-31.
47. Kimura Y, Kubo M, Tani T i wsp. Studies on Scutellariae radix. IV. Effects on lipid peroxidation in rat liver. Chem Pharm Bull 1981;29:2610-7.
48. Kimura Y, Kubo M, Kusaka K i wsp. Studies on Scutellariae radix. V. Effects on ethanol-induced hyperlipemia and lipolysis in isolated fat cells. Chem Pharm Bull 1982; 30:219-22.
49. Miocinovic R, Mc Cabe NP, Keck RW i wsp. In vivo and in vitro effect of baicalein on human prostate cancer cells. Int J Oncol 2005; 26:241-6.
50. Bonham M, Porskony J, Coleman I i wsp. Characterization of chemical constituents in Scutellaria baicalensis with antiandrogenic and growth-inhibitory activities toward prostate carcinoma. Clin Cancer Res 2005; 11:3905-14.
51. Guo QL, Ding QL, Wu ZQ. Effect of baicalein on experimental prostatic hyperplasia in rats and mice. Biol Pharm Bull 2004; 27:333-7.
52. Chan FL, Choi HL, Chen ZY i wsp. Induction of apoptosis in prostate cancer cell lines by a flavonoid, baicalin. Cancer Lett 2000;160:219-28.
53. Matsuzaki Y, Kurokawa N, Terai S i wsp. Cell death induced by baicalein in human hepatocellular carcinoma cell lines. Jap J Cancer Res 1996; 87:170-7.
54. Ikemoto S, Sugimura K, Yoshida N i wsp. Antitumor effects of Scutellariae radix and its components baicalein, baicalin, and wogonin on bladder cancer cell lines. Urology 2000; 55:951-5.
55. Bergeron C, Marston A, Gauthier R i wsp. Screening of plants used by North American Indians for antibacterial, bactericidal, larvicidal and molluscidal activities. Intern J Pharmacogn 1996; 34:233-42.
56. Liu IX, Durham DG, Richards RM. Baicalin synergy with beta-lactam antibiotics against methicillin-resistant Staphylococcus aureus and other beta-lactam-resistant strains of S. aureus. J Pharm Pharmacol 2000; 52:361-6.
57. Ueng YF, Shyu CC, Liu TY i wsp. Protective effects of baicalein and wogonin against benzo[a]pyrene and aflatoxin B1-induced genotoxicities. Biochem Pharmacol 2001; 62:1653-60.
58. Hwang JM, Tseng TH, Tsai YY i wsp. Protective effects of baicalein on tert-butyl hydroperoxide-induced hepatic toxicity in rat hepatocytes. J Biomed Sci 2005; 12:389-97.
59. Hwang JM, Wang CJ, Chou FP i wsp. Protective effect of baicalin on tert-butyl hydroperoxide-induced rat hepatotoxicity. Archiv Toxicol 2005; 79:102-9.
60. Kawka B, Kwiecień I, Ekiert H. Influence of culture medium composition and light conditions on the accumulation of bioactive compounds in shoot cultures of Scutellaria lateriflora L. (American skullcap) grown in vitro. Appl Biochem Biotechnol 2017; 183:1414-25.


