© Borgis - Postępy Fitoterapii 4/2010, s. 205-210
Marta Mielczarek, Joanna Kołodziejczyk, *Beata Olas
Właściwości lecznicze chmielu zwyczajnego (Humulus lupulus L.)
The medicinal properties of Humulus lupulus L.
Katedra Biochemii Ogólnej, Uniwersytet Łódzki
Kierownik Katedry: prof. dr hab. Barbara Wachowicz
Summary
Humulus lupulus L. (Cannabaceae) is well known throughout the world as the raw material in the brewing industry. Recently, some different prenylated chalcones present in hops of Humulus lupulus have received much attention for their biological effects, and had been widely investigated because of its beneficial health properties; in particular, xanthohumol has been shown to exert cancer chemopreventive activity in experiments in vitro and 8-prenylnaringenin has been characterized as one of the most potent phytoestrogens isolated until now. The present review describes the morphological, phytochemical and pharmacological aspects of Humulus lupulus. In the article, the various biological activities of xanthohumol and 8-prenylnaringenin, and their role in various diseases are also described.

Wstęp
Chmiel zwyczajny (Humulus lupulus L.) jest byliną dwupienną, należącą do rodziny konopiowatych (Cannabinaceae). To roślina wieloletnia, wytwarzająca podziemne kłącza z rozłogami. Sugeruje się, że kolebką chmielu są Chiny, ponieważ na ich terytorium znaleziono wszystkie gatunki Humulus (1). Obecnie chmiel występuje w północnych regionach świata o klimacie umiarkowanym, jak również w niektórych rejonach Australii, Afryki Południowej i Ameryki Południowej. Dla celów przemysłowych uprawia się wyłącznie rośliny żeńskie, w celu utrzymania genetycznie konsekwentnego produktu. Szyszki chmielowe, czyli owocostany chmielu (Strobili Lupuli) stanowią cenny surowiec zarówno w przemyśle browarniczym, jak i w lecznictwie. Żeńskie kwiatostany są baziami podobnymi do szyszek, które określa się mianem strobili. Na powierzchni szyszek przy podstawie przylistków występują włoski gruczołowe, wypełnione żywiczną substancją – lupuliną, która też ma zastosowanie w lecznictwie (2). Związki chemiczne występujące w szyszkach chmielu przedstawiono w tabeli 1.
Tabela 1. Średnia zawartość składników w suszonych szyszkach chmielu (4).
| Związki |
Zawartość procentowa (w/w) |
| a-Kwasy | 2-17 |
| b-Kwasy | 2-10 |
| Polifenole | 3-6 |
| Olejki eteryczne | 0,5-3 (v/w) |
| Monosacharydy | 2 |
| Aminokwasy | 0,1 |
| Białka | 15 |
| Lipidy i kwasy tłuszczowe | 1-5 |
| Pektyny | 2 |
| Sole | 10 |
| Celuloza – ligniny | 40-50 |
| Woda | 8-12 |
Szyszki chmielowe są bogate w drugorzędowe metabolity roślin. Głównymi związkami występującymi w dojrzałych żeńskich kwiatostanach Humulus lupulus są kwasy goryczowe chmielowe, terpeny i chalkony. Zawierają one również glikozydy flawonolowe (rutynę, kemferol, kwercetynę, kwercytrynę) i katechiny (galusan katechiny, galusan epikatechiny) (2). W skład olejku eterycznego chmielu wchodzi wiele lotnych składników, w tym monoterpeny (myrcen) oraz seskwiterpeny (β-kariofilen, farnezen, humulon), które razem stanowią 57-82% całej zawartości. Różnice w ilości tych związków chemicznych są zależne od odmiany uprawnej oraz metod detekcji (3).
Kwasy goryczowe chmielu obejmują α-kwasy (humulony) i β-kwasy (lupulony) (ryc. 1). Związki te są prenylowymi pochodnymi floroglucyny. Występują w postaci bladożółtych olejów lub żywic łatwo rozpuszczalnych w rozpuszczalnikach organicznych. W zależności od bocznego łańcucha acylowego rozróżnia się pięć analogów: n-, ko-, ad-, pre-, posthumulony/lupulony. Głównym elementem składowym α-kwasów są analogi: n-humulonu (35-70% α-kwasów), kohumulonu (20-65% α-kwasów) i adhumulonu (10-15% α-kwasów). β-Kwasy w porównaniu do α-kwasów mają dodatkową grupę prenylową. Poza tym lupulony występują w dwóch różnych wzorach enolizacji. Przeważające analogi β-kwasów występujące w chmielu to: lupulony (20-55% β-kwasów), kolupulony (20-55% β-kwasów), adlupulony (10-15% β-kwasów). Główna rola α-kwasów w przemyśle browarniczym polega na ich izomeryzacji do odpowiednich gorzkich izo-α-kwasów podczas gotowania brzeczki.
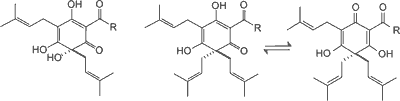
Ryc. 1. Struktura chemiczna występujących w szyszkach chmielu α-kwasów i β-kwasów (4).
a-Kwasy (humulony) β-Kwasy (lupulony)
n-: R = CH2CH(CH3)2
ko-: R = CH(CH3)2
ad-: R = CH(CH3)CH2CH3
pre-: R = CH2CH2CH(CH3)2
post-: R = CH2CH3
Drugą ważną grupą drugorzędowych metabolitów szyszek chmielu są polifenole, obejmujące wiele prenylowych chalkonów, takich jak ksantohumol (X) i desmetyloksantohumol (DMX), które są prekursorami dla izomercznych flawanonów, odpowiednio: izoksantohumolu (IX) i 8-prenylonaryngeniny (8-PN) (ryc. 2) (4).
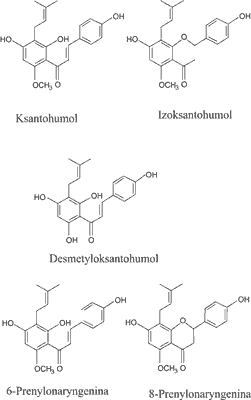
Ryc. 2. Struktura chemiczna prenylowanych flawonoidów występujących w chmielu (2).
Badania dotyczące biologicznej aktywności związków występujących naturalnie w chmielu skoncentrowane są na testowaniu ksantohumolu, α- i β-kwasów i 8-prenylonaryngeniny. Stwierdzono, że związki te wykazują różnorodną aktywność biologiczną: przeciwbakteryjną, antyoksydacyjną, antykolagenazową, estrogenną, chemoprewencyjną, przeciwzapalną, apoptotyczną, antyproliferacyjną wobec różnych linii komórek rakowych (np. wpływają na enzymy i czynniki transkrypcyjne zaangażowane w karcynogenezę), obniżają też poziom cholesterolu oraz wykazują właściwości przeciwwrzodowe (2, 4-6).
Właściwości antyoksydacyjne ekstraktu z szyszek chmielu
Ze względu na szeroki zakres działania biologicznego związków zawartych w chmielu, są one badane także jako potencjalne antyoksydanty. Yamaguchi i wsp. (7) wykazali w warunkach in vitro właściwości antyoksydacyjne dla kwasów goryczowych chmielu i ksantohumolu. W badaniach tych zastosowano metodę ORAC (Oxygen Radical Absorbance Capacity – zdolność pochłaniania wolnych rodników tlenowych) wykorzystywaną powszechnie do oceny zdolności antyoksydacyjnej w próbkach biologicznych i żywności. Najwyższa wartość ORAC odpowiada najwyższej aktywności antyoksydacyjnej. Jako kontroli o najwyższej wartości ORAC spośród jadalnych roślin użyto polifenonu 60 (zawierającego katechiny z zielonej herbaty) i zaobserwowano, że całkowita wartość ORAC dla ksantohumolu była porównywalna do polifenonu 60 i znacznie wyższa niż dla witaminy E i C (tab. 2).
Tabela 2. Wartość ORAC dla wybranych związków chemicznych występujących w szyszkach chmielu (7).
| Związki |
Całkowita wartość ORAC
(μmol troloksu) |
| Humulony | 1,20 |
| Lupulony | 1,90 |
| Ksantohumol | 4,20 |
| Witamina C | 1,40 |
| Witamina E | 0,75 |
| Polifenon 60 | 4,20 |
Autorzy zbadali również wartość SOAC, określającą zdolność wygaszania tlenu singletowego (Singlet Oxygen Absorbance Capacity), który powstaje w wyniku wzbudzenia cząsteczek tlenu i jest wysoce reaktywny. W białkach tlen singletowy (1O2) w największym stopniu uszkadza reszty aminokwasowe metioniny, cysteiny, histydyny i tryptofanu. Spośród składników kwasów nukleinowych najbardziej podatne na działanie 1O2 są reszty pirymidynowe, purynowe oraz guanina (8). Tlen singletowy jest też zaangażowany w patogenezę wielu chorób skórnych, takich jak trądzik, atopowe zapalenie skóry czy procesy starzenia skóry. W opisywanych badaniach dla ksantohumolu otrzymano wartość SOAC 8-15-krotnie wyższą niż dla witaminy E czy polifenonu 60. Wyniki tych badań wskazują jednoznacznie, że ksantohumol jest jednym z najlepszych naturalnie występujących antyoksydantów pod względem zdolności zmiatania tlenu singletowego (tab. 3) (7).
Tabela 3. Wartość SOAC dla wybranych związków występujących w szyszkach chmielu (7).
| Związki chemiczne |
SOAC μmol troloksu |
| Humulony | 0,75 |
| Lupulony | 0,80 |
| Ksantohumol | 14,10 |
| Witamina E | 1,00 |
| Polifenon 60 | 1,80 |
W innych badaniach nad kwasami goryczowymi chmielu wykazano hamowanie przez humulony hemolizy erytrocytów indukowanej nadtlenkiem wodoru. Odnotowano również inhibicję peroksydacji lipidów, zarówno w przypadku α-kwasów, jak i β-kwasów, a związki chmielu wykazały nawet silniejsze działanie niż α-tokoferol czy kwas askorbinowy (4).
Właściwości antybakteryjne i przeciwgrzybiczne ekstraktu z szyszek chmielu
Coraz więcej drobnoustrojów chorobotwórczych wytwarza oporność wobec stosowanych do tej pory antybiotyków. Poszukując nowych leków i związków wspomagających leczenie wielu chorób, naukowcy intensywnie badają różne ekstrakty roślinne, w tym również chmiel. W badaniach prowadzonych w warunkach in vitro wykazano silną aktywność hamującą lupulonów i ksantohumolu wobec bakterii indukujących powstawanie trądziku (Propionibacterium acnes, Staphylococcus epidermidis, Staphylococcus aureus, Streptococcus pyogenes i Kocuria rhizophila). Niskie wartości minimalnych stężeń hamujących związków chmielu są porównywalne do antybiotyków najczęściej stosowanych do leczenia trądziku (erytromycyna i klindamycyna) (7).
W innych badaniach wykazano, że ksantohumol jest związkiem o szerokim spektrum działania przeciwko bakteriom Gram-dodatnim (Streptococcus mutans i Staphylococcus aureus), grzybom (Trichophyton spp.) i wirusom (wirus zakaźnej biegunki bydła BVDV, wirus opryszczki pospolitej typ 1 i 2, cytomegalowirus, HIV-1). Wykazano również silne hamowanie replikacji zarodźca malarii, wywołującego malarię u ludzi (5). Ponadto, badania w układzie modelowym in vitro nad współdziałaniem lupulonów i ksantohumolu z niektórymi antybiotykami w hamowaniu rozwoju drobnoustrojów, wykazały pozytywne współdziałanie związków chmielu z polimyksyną, tobramycyną i cyprofloksacyną.
Nie zbadano jednak dotąd mechanizmów odpowiadających za to zjawisko. Sugeruje się, że antybakteryjne działanie związków występujących w chmielu oparte jest na zmianie właściwości i przepuszczalności błony komórkowej drobnoustrojów. Połączenie terapii antybiotykowej z ekstraktem z chmielu mogłoby spowodować obniżenie potrzebnej ilości antybiotyku, a tym samym zmniejszenie prawdopodobieństwa rozwoju oporności oraz zmniejszenie toksyczności leku dla osoby leczonej. Należy jednak pamiętać, że te badania mają charakter in vitro, a związki występujące w ekstrakcie z chmielu nie mogą być używane ogólnoustrojowo, gdyż ich przeciwdrobnoustrojowe działanie w surowicy krwi jest znacznie niższe (9).
Właściwości estrogenne ekstraktu z szyszek chmielu
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Murakami A, Darby P, Javornik B i wsp. Molecular phylogeny of wild hops, Humulus lupulus L. Heredity 2006; 97:66-74. 2. Zanoli P, Zavatti M. Pharmacognostic and pharmacological profile of Humulus lupulus L. J Ethnopharmacol 2008; 116:383-96. 3. Chadwick LR, Pauli GF, Farnsworth NR. The pharmacognosy of Humulus lupulus L. (hops) with an emphasis on estrogenic properties. Phytomed 2006; 13:119-31. 4. Van Cleemput M, Cattoor K, De Bosscher K i wsp. Hop (Humulus lupulus) – derived bitter acids as multipotent bioactive compounds. J Nat Prod 2009; 72:1220-30. 5. Gerhäuser C. Broad spectrum antiinfective potential of xanthohumol from hop (Humulus lupulus L.) in comparison with activities of other hop constituents and xanthohumol metabolites. Mol Nutr Food Res 2005; 49:827-31. 6. Dębski R. Hormonalna terapia zastępcza a rak sutka. Post Nauk Med 2008; 4:240-5. 7. Yamaguchi N, Satoh-Yamaguchi K, Mitsunori O. In vitro evaluation of antibacterial, anticollagenase, antioxidant activities of hop components (Humulus lupulus) addressing acne vulgaris. Phytomed 2009; 16:369-76. 8. Puzanowska-Tarasiewicz H, Starczewska B, Kuźmicka L. Reaktywne formy tlenu. Bromat Chem Toksykol 2008; 41:1007-15. 9. Natarajan P, Katta S, Andrei I i wsp. Positive antibacterial co-action between hop (Humulus lupulus) constituents and selected antibiotics. Phytomed 2008; 15:194-201. 10. Kretzschmar G, Zierau O, Wober J i wsp. Prenylation has a compound specific effect on the estrogenicity of naringenin and genistein. J Steroid Biochem Mol Biol 2010; 118:1-6. 11. Overk CR, Guo J, Chadwick LR i wsp. In vivo estrogenic comparisons of Trifolium pratense (red clover), Humulus lupulus (hops), and the pure compounds isoxanthohumol and 8-prenylnaringenin. Chem-Biol Interactions 2008; 176:30-9. 12. Possemiers S, Bolca S, Grootaert C i wsp. The prenylflavonoid isoxanthohumol from hops (Humulus lupulus L.) is activated into the potent phytoestrogen 8-prenylnaringenin in vitro and in the human intestine. J Nutr 2006; 136:1862-7. 13. Nikolic D, Li Y, Chadwick LR i wsp. Metabolism of xanthohumol and isoxanthohumol, prenylated flavonoids from hops (Humulus lupulus L.), by human liver microsomes. J Mass Spectrom 2005; 40:289-99. 14. Schaefer O, Hümpel M, Fritzemeier K i wsp. 8-Prenylnaringenin is a potent ERα selective phytoestrogen present in hops and beer. J Steroid Biochem Mol Biol 2003; 84:359-60. 15. Heyerick A, Vervarcke S, Depypere H i wsp. A first prospective, randomized, double-blind, placebo-controlled study on the use of a standardized hop extract to alleviate menopausal discomforts. Maturitas 2006; 54:164-75. 16. Wolanin K, Piwocka K. Kurkumina – od medycyny naturalnej do kliniki. Kosmos 2008; 1-2:53-65. 17. Makowski M, Połać I, Pertyński T. Estrogeny a rak sutka. Przegl Menopauz 2007; 3:150-4. 18. Monteiro R, Faria A, Azevedo I i wsp. Modulation of breast cancer cell survival by aromatase inhibiting hop (Humulus lupulus L.) flavonoids. J Steroid Biochem Mol Biol 2007; 105: 124-30. 19. Lust S, Vanhoecke B, Janssens A i wsp. Xanthohumol kills B-chronic lymphocytic leukemia cells by an apoptotic mechanism. Molecul Nutr Food Res 2005; 49:844-50. 20. Delmulle L, Bellahcène A, Dhooge W i wsp. Anti-proliferative properties of prenylated flavonoids from hops (Humulus lupulus L.) in human prostate cancer cell lines. Phytomed 2006; 13:732-4. 21. Colgate EC, Miranda CL, Stevens JF i wsp. Xanthohumol, a prenylflavonoid derived from hops induces apoptosis and inhibits NF-kappaB activation in prostate epithelial cells. Canc Let 2007; 246:201-9. 22. Kac J, Plazar J, Mlinarič A i wsp. Antimutagenicity of hops (Humulus lupulus L.): bioassay-directed fractionation and isolation of xanthohumol. Phytomed 2008; 15:216-20. 23. Schiller H, Forster A, Vonhoff C i wsp. Sedating effects of Humulus lupulus L. extracts. Phytomed 2006; 13:535-41. 24. Zanoli P, Zavatti M, Rivasi M i wsp. Evidence that the β-acids fraction of hops reduces central GABAergic neurotransmission. J Ethnopharmacol 2007; 109:87-92.


