© Borgis - Postępy Nauk Medycznych 3/2014, s. 140-144
*Karolina Wejnarska, Jarosław Kierkuś, Elwira Kołodziejczyk, Józef Ryżko, Grzegorz Oracz
Ocena przebiegu klinicznego przewlekłego zapalenia trzustki u dzieci ze współwystępowaniem mutacji w genach SPINK1 i CFTR
The clinical course of chronic pancreatitis in children with the coincidence of mutations in the CFTR and SPINK1 genes
Klinika Gastroenterologii, Hepatologii i Zaburzeń Odżywiania, Instytut „Pomnik-Centrum Zdrowia Dziecka”, Warszawa
Kierownik Kliniki: prof. dr hab. med. Józef Ryżko
Streszczenie
Wstęp. Przewlekłe zapalenie trzustki jest to choroba rozpoznawana u dzieci coraz częściej. Przyczyny PZT u dzieci są różnorodne, do najważniejszych należą m.in. mutacje w genach PRSS1, SPINK1 i CFTR.
Cel pracy. Celem naszej pracy była ocena ciężkości przebiegu klinicznego PZT u dzieci ze współwystępowaniem mutacji genów CFTR i SPINK1.
Materiał i metody. Do badania włączono 208 dzieci z PZT hospitalizowanych w latach 1988-2012. Dane analizowano pod kątem wieku rozpoznania choroby, nasilenia zmian zapalnych ocenianych w skali Cambridge podczas ECPW oraz częstości interwencji zabiegowych – endoskopowych i chirurgicznych. Wszystkie dzieci miały przeprowadzoną analizę genów w kierunku mutacji predysponujących do zapalenia trzustki (PRSS1, CFTR, SPINK1).
Wyniki. Współwystępowanie mutacji genów CFTR i SPINK1 stwierdzono u 9 dzieci (4,3%) (3 dziewczynek i 6 chłopców; ze średnią wieku 11,5 lat, od 6 do 15 lat). Współwystępowanie mutacji N34S/- i delF508/- wykryto u 3 pacjentów, mutacji N34S/- i IVS8-5T(TG)11/- u 5 dzieci oraz mutacji N34S/- i IVS3+2T>C/- i delF508/- u 1 pacjenta.[br]
Nie stwierdzono znamiennej statystycznie różnicy w wieku chorych podczas pierwszego epizodu zapalenia trzustki między badaną grupą pacjentów a pozostałymi chorymi (9 lat vs. 8,9 roku; NS). Nie stwierdzono różnicy w nasileniu zmian zapalnych ocenianych w skali Cambridge podczas badania ECPW (1,5° vs. 1,7°; NS), w częstości zabiegów terapeutycznych (endoskopowych i chirurgicznych) (38 vs. 35%; NS), protezowaniu przewodów trzustkowych (38 vs. 35%; NS) oraz częstości ESWL.
Wnioski. Przebieg kliniczny przewlekłego zapalenia trzustki u dzieci ze współwystępowaniem mutacji genów CFTR i SPINK1 nie różni się od przebiegu klinicznego choroby wywołanej innymi czynnikami etiologicznymi.
Summary
Introduction. The causes of chronic pancreatitis (CP) in children are varied. These include gene mutations, anatomic anomalies of the pancreatic duct and metabolic disorders.
Aim. The aim of our study was to evaluate the clinical severity of chronic pancreatitis in children with the coincidence of mutations in the CFTR gene and SPINK1 gene.
Material and methods. 208 children with chronic pancreatitis were enrolled into the study. Data were analyzed for age at diagnosis, severity of inflammatory lesions assessed on a Cambridge scale during ERCP and the frequency of intervention treatment. All the children had carried out the analysis of PRSS1, CFTR and SPINK1 gene mutations.
Results. The coincidence of mutations in CFTR and SPINK1 genes was found in 9 children (4.3%). There was no significant difference in the age of the disease onset between the studied group and the rest of the patients (9 years vs. 8.9 years, NS). There was no difference in the severity of inflammatory lesions assessed on a Cambridge scale during ERCP (1.5 vs. 1.7, NS). The frequency of therapeutic procedures (endoscopic and surgical) (38 vs. 35%, NS), pancreatic duct stenting (38 vs. 35%, NS) and the frequency of ESWL were also similar in both groups of patients.
Conclusions. The clinical course of chronic pancreatitis in children with the coincidence of mutations in the CFTR and SPINK1 genes does not differ from the clinical course of disease caused by other etiological factors.

Wstęp
Przewlekłe zapalenie trzustki (PZT) jest wśród populacji dziecięcej chorobą rzadką, o nieustalonej dotąd częstości występowania. Istotą choroby jest stopniowe niszczenie miąższu narządu przez postępujący proces zapalny oraz stopniowe zastępowanie go tkanką łączną. U dzieci jednak stosunkowo rzadko dochodzi do niewydolności funkcji zewnątrz- oraz wewnątrzwydzielniczej trzustki. Do upośledzenia trawienia składników odżywczych prowadzącego do zespołu złego wchłaniania i biegunki tłuszczowej dochodzi dopiero, gdy ponad 90% tkanki gruczołowej ulega zniszczeniu. Tak znaczne uszkodzenie narządu występuje zazwyczaj po wielu latach trwania choroby (5,6-13,1 roku), więc jest obserwowane raczej u pacjentów dorosłych. Funkcja wewnątrzwydzielnicza trzustki jest zachowana zazwyczaj dłużej od zewnątrzwydzielniczej, a co za tym idzie cukrzyca spowodowana PZT tym bardziej jest w pediatrii problemem rzadkim (1, 2).
Głównym objawem PZT zgłaszanym przez 95% pacjentów jest ból brzucha, szczególnie silny w okresach zaostrzeń. Bywa, że jest to jedyny prezentowany przez chorych objaw toczącego się procesu zapalnego. Jednak często towarzyszą mu wymioty (85%), nieco rzadziej niedrożność jelit (47%), gorączka (27%), żółtaczka (9%) czy nawet wstrząs opisywany u 7% pacjentów (3, 4).
Najczęstsze przyczyny PZT u dzieci znacznie różnią się od tych opisywanych wśród dorosłych. Do najważniejszych należą mutacje genetyczne, wady anatomiczne przewodu trzustkowego, zaburzenia gospodarki lipidowej i choroby dróg żółciowych (3, 5). Dość duża część PZT pozostaje nadal opisywana jako idiopatyczna – 30-40% (1), mimo że w ostatniej dekadzie rozwój diagnostyki molekularnej pozwolił na poznanie genetycznej etiologii choroby u znacznej liczby pacjentów. Przewlekłe zapalenie trzustki jest chorobą o bardzo zróżnicowanych przyczynach, które różnymi szlakami patomechanicznymi prowadzą do jednego obrazu klinicznego oraz histopatologicznego. Jak dowiedli już Shrikhande i wsp., poprzez ocenę histopatologiczną nie możemy dociec przyczyny PZT (6).
Do mutacji o potwierdzonym związku z chorobami trzustki należą m.in. mutacje w genach: PRSS1 (ang. cationic trypsinogen/serine protease 1), SPINK1 (ang. serine protease inhibitor Kazal type 1), CFTR (ang. cystic fibrosis transmembrane conductance regulator), CTRC (ang. chymotrypsin C), CPA1 (ang. carboxypeptidase A1) (7). Mutacja w genie PRSS1 jest potwierdzoną przyczyną rozwoju przewlekłego zapalenia trzustki (8, 9), w przeciwieństwie do genów SPINK1 i CFTR, których mutacje według piśmiennictwa jedynie zwiększają ryzyko wystąpienia choroby.
Według niektórych autorów współwystępowanie mutacji w genach SPINK1 i CFTR zwiększa zdecydowanie ryzyko wystąpienia zapalenia trzustki u tych pacjentów nawet kilkaset razy (8, 10, 11). Brak jest jednak danych w piśmiennictwie na temat ciężkości przebiegu choroby u tych chorych.
Cel pracy
Celem naszej pracy było porównanie przebiegu klinicznego przewlekłego zapalenia trzustki u pacjentów ze współwystępowaniem mutacji w genach SPINK1 i CFTR z przebiegiem choroby u pacjentów z PZT o innej etiologii.
Materiał i metody
Do badania włączono 208 dzieci w wieku 1,6-18 lat (średnia wieku 10,8 roku) z PZT hospitalizowanych w Klinice Gastroenterologii, Hepatologii i Zaburzeń Odżywiania IP-CZD w latach 1988-2012. Do kryteriów włączenia należały: wiek poniżej 18 roku życia, cechy przewlekłego zapalenia trzustki uwidocznione w badaniu obrazowym (MRCP, CT, ECPW lub USG) i/lub w badaniach służących ocenie funkcji zewnątrzwydzielniczej trzustki (trzydobowa ocena wydalania tłuszczów w kale, test oddechowy z triglicerydami znakowanymi izotopem węgla 13C, stężenie elastazy-1 w kale) oraz przynajmniej roczny okres obserwacji przebiegu choroby (od momentu pierwszego epizodu choroby).
U wszystkich pacjentów wykonano diagnostykę molekularną w kierunku mutacji genów związanych z przewlekłym zapaleniem trzustki:
– CFTR (ang. cystic fibrosis transmembrane conductance regulator) (MIM:219700) – mutacje ΔF508, del2,3 i poliT wariant w intronie 8 (IVS8-T), analiza eksonów 9, 10, 11 z zastosowaniem techniki sekwencjonowania DNA,
– PRSS1 (ang. cationic trypsinogen/serine protease 1) (MIM:276000) – mutacje R122H, R122C, A16V, N29I, E79K, N29T, K23R, D22G, D19A, analiza eksonów 2 i 3 z zastosowaniem techniki sekwencjonowania DNA,
– SPINK1 (ang. serum protease inhibitor Kazal type 1) (MIM 167790) – mutacje N34S, IVS3+2T > c, analiza eksonu 3 z zastosowaniem techniki sekwencjonowania DNA.
Analiza DNA była wykonana w latach 2002-2010 w Zakładzie Genetyki Medycznej IMiD, Warszawa oraz w latach 2011-2012 w Zakładzie Genetyki Genomed S.A., Warszawa.
Przebieg kliniczny analizowany był na podstawie następujących danych:
– wieku wystąpienia pierwszego epizodu zapalenia trzustki,
– nasilenia zmian zapalnych w endoskopowej cholangiopankreatografii wstecznej (ECPW) w skali Cambridge. ECPW wykonano u 157 dzieci, co stanowi 75,5% badanej grupy,
– częstości leczenia zabiegowego (endoskopowego, litotrypsji zewnątrzustrojową falą uderzeniową – ESWL, operacyjnego).
Istotność związku pomiędzy cechami kategorycznymi oceniana była przy pomocy testów z grupy chi2. Porównując dane ciągłe, zastosowano test U Manna-Whitneya i Kruskala-Wallisa (Statistica for Windows, wersja 5.0). Za poziom istotności statystycznej przyjęto p < 0,05.
Wyniki
Mutacje genów związanych z zapaleniem trzustki stwierdzono u 89 dzieci (42,8%) i była to najczęstsza przyczyna PZT wśród badanej grupy pacjentów (ryc. 1).
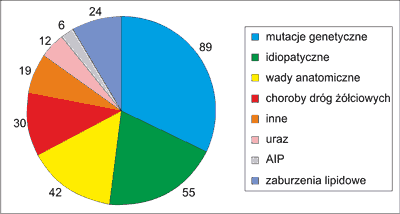
Ryc. 1. Przyczyny PZT w badanej grupie pacjentów.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Nydegger A, Couper R, Oliver M: Childhood pancreatitis. J Gastroenterol Hepatol 2006; 21: 499-509.
2. Oracz G: Przewlekłe zapalenie trzustki u dzieci – diagnostyka i leczenie. Instytut „Pomnik-Centrum Zdrowia Dziecka”, Warszawa 2012.
3. Oracz G: Przewlekłe zapalenie trzustki u dzieci. Terapia 2009; 17: 47-51.
4. Cichy W: Odrębności przewlekłego zapalenia trzustki u dzieci. Medical Science Review. Gastroenterologia. Wyd. 3, 2006: 93-100.
5. Werlin S, Kugathasan S, Frautschy B: Pancreatitis in children. J Pediatr Gastroenterol Nutr 2003; 37: 591-595.
6. Shrikhande SV, Martignoni ME, Shrikhande M et al.: Comparison of histological features and inflammatory cell reaction in alcoholic, idiopatic and tropical chronic pancreatitis. Br J Surg 2003; 90: 1565-1572.
7. Witt H, Beer S, Rosendahl J et al.: Variants in CPA1 are strongly associated with early onset chronic pancreatitis. Nat Genet 2013 Oct; 45(10): 1216-1220.
8. Braganza J, Lee S, McCloy R, McMahon M: Chronic Pancreatitis. Lancet 2011; 377: 1184-1197.
9. Gorry M, Garbbaizedeh D, Furey W et al.: Mutations in the cationic tripsinogen gene are associated with recurrent acute and chronic pancreatitis. Gastroenterology 1997; 113: 1063-1068.
10. Kandula L, Withcomb D, Lowe M: Genetic issues in pediatric pancreatitis. Curr Gastroenterol Rep 2006; 8: 246-251.
11. Noone PG, Zhou Z, Silverman LM et al.: Cystic Fibrosis Gene Mutations and Pancreatitis Risk: Relation to Epithelial Ion Transport and Typsin Inhibitor Gene Mutations. Gastroenterology 2001; 121: 1310-1319.
12. Witt H: Gene mutations in children with chronic pancreatitis. Pancreatology 2001; 1: 432-438.
13. Sobczyńska-Tomaszewska A, Bąk D, Oralewska B et al.: Analysis of CFTR, SPINK1, PRSS1 and AAT mutations in children with acute or chronić pancreatitis. J Pediatr Gastroenterol Nutr 2006; 43: 299-306.
14. Sultan M, Werlin S, Venkatasubramani N: Genetic prevalence and characteristics in children with reccurent pancreatitis. J Ped Gastoenterol Nut 2012; 54: 645-650.
15. Wang W, Sun X-T, Weng X-L et al.: Comprehensive secreening for PRSS1, SPINK1, CFTR, CTRC and CLDN2 gene mutations in Chinese pediatric patients with idiopathic chronic pancreatitis: a cohort study. BMJ Open 2013; 3: e003150.
16. Lowe M: Pancreatitis. [W:] Wyllie R, Hyams J (eds.): Pediatric Gastrointestinal and Liver Disease. Wyd. 4, Wydawnictwo Elsevier Urban & Partner, Wrocław 2011: 905-914.
17. Witt H, Luck W, Hennies H et al.: Mutations in the gene encoding the serine protease inhibitor, Kazal type 1 are associated with chronic pancreatitis. Nat Genet 2000; 25: 213-215.
18. Witt H, Apte MV, Keim V, Wilson JS: Chronic pancreatitis: challenges and advances in pathogenesis, genetics, diagnosis and therapy. Gastroenterology 2007; 132: 1557-1573.
19. Chen JM, Ferec C: Chronic pancreatitis: genetics and pathogenesis. Annu Rev Genomics Hum Genet 2009; 10: 63-87.
20. Ooi CY, Gonska T, Durie PR, Freedman SD: Genetic testing in pancreatitis. Gastroenterology 2010; 138: 2202-2206.
21. Pfutzer RH, Barmanda MM, Brunskill AP et al.: SPINK1/PSTI polymorhpisms act as disease modifiers in familial and idiopatic chronic pancreatitis. Gastroenterology 2000; 119: 615-623.
22. Witt H, Luck W, Backer M et al.: Mutation in the SPINK1 trypsin inhibitor gene, alcohol use and chronic pancreatitis. JAMA 2001; 285: 2716-2717.
23. Cohn JA, Friedman KJ, Noone PG et al.: Relation between mutations of the cystic fibrosis gene and idiopathic pancreatitis. N Eng J Med 1998; 339: 653-658.
24. Sharer N, Schwarz M, Malone G et al.: Mutations of the cystic fibrosis gene in patients with chronic pancreatitis. N Engl J Med 1998; 229: 645-652.
25. Schneider A, LaRusch J, Sun X et al.: Combined Bicarbonate Conductance-Impairing Variants in CFTR and SPINK1 Are Associated with Chronic Pancreatitis in Patients without Cystic Fibrosis. Gastroenterology 2011; 140: 162-171.
26. Derikx M, Drenth J: Genetic factors in chronic pancreatitis; implications for diagnosis, management and prognosis. Best Pract Res Clin Gastroenterol 2010; 24: 251-270.
27. Truninger K, Malik N, Amman R et al.: Mutations of the cystic fibrosis gene in patients with chronic pancreatitis. Am J Gastroenterol 2001; 96: 2657-2661.
28. Schneider A, Barmanda M, Slivka J et al.: Clinical characterization of patients with idiopatic chronic pancreatitis and SPINK1 mutations. Scan J Gastroenterol 2004; 39: 903-904.
29. Pfutzer RH, Barmanda MM, Brunskill AP et al.: SPINK1/PSTI polymorhpisms act as disease modifiers in familial and idiopatic chronic pancreatitis. Gastroenterology 2000; 119: 615-623.
30. Cohn JA, Friedman KJ, Noone PG et al.: Relation between mutations of the cystic fibrosis gene and idiopathic pancreatitis. N Eng J Med 1998; 339: 653-658.
31. LaRusch J, Whitcomb DC: Genetics of pancreatitis. Curr Opin Gastroenterol 2011; 27: 467-474.

