© Borgis - Anestezjologia Intensywna Terapia 2/2004, s. 103-109
Jerzy Paleczny1, Piotr Knapik2, Dariusz Maciejewski1, Elżbieta Łoniewska-Paleczny1
Odległe następstwa tracheostomii przezkrtaniowej sposobem Fantoniego
Long-term outcome after Fantoni translaryngeal tracheostomy
1Oddział Anestezjologii i Intensywnej Terapii;
ordynator: dr n. med. D. Maciejewski – Szpital Wojewódzki w Bielsku-Białej
2Katedra Anestezjologii i Intensywnej Terapii;
kierownik: dr hab. med. P. Knapik – Wydział Lekarski w Zabrzu, Śl. AM w Katowicach
Summary
Background. Tracheostomy is a common ICU procedure used for temporary, rather than permanent management of the airway. A satisfactory outcome after decannulation and discharge is very important. In recent years, less invasive, percutaneous dilatational techniques have been introduced into clinical practice, resulting in a marked decrease in the number of long-term complications. No studies have been previously published describing the long-term outcome of the Fantoni translaryngeal technique (TLT). Methods. We have analyzed the outcome of all TLT´s performed in ICU patients who survived 6 months after decannulation, over 4 years at a single institution. A questionnaire was used, in addition to spirometry and spiral computer tomography of the trachea. Results. TLT´s were performed in 32 patients; the analysis was attempted in 10 patients who survived. The questionnaire was answered by 8 patients; two patients refused further evaluation. In two cases (25%) change of voice was reported. A spiral CT scan was performed in 7 patients revealing stenosis of the tracheal lumen in one case. Flow impairment was also diagnosed by spirometry in this case, however he had no clinical symptoms or complaints. Conclusion. We found long-term outcomes after Fantoni translaryngeal tracheostomy techniques to be satisfactory. The small number of patients did not allow for statistical analysis and/or recommendations. Tracheal stenosis may be easily diagnosed with the use of a CT scan and spirometry in the absence of clinical symptoms.

Anest Inten Terap 2004; 36, 103-109
Intensywna terapia jest dziedziną medycyny, szczególnie dynamicznie rozwijającą się w ostatnich latach. Wprowadzanie coraz doskonalszych leków i metod leczenia spowodowało znaczne zwiększenie przeżywalności w wielu jednostkach chorobowych, ale i szybko rosnącą liczbę chorych w oddziałach intensywnej terapii, u których niejednokrotnie występują zaburzenia oddechowe o różnej etiologii, stąd wymagają oni często wykonania zabiegu tracheostomii na pewnym etapie leczenia.
O skali problemu dotyczącego zagadnienia tracheo-stomii w oddziałach intensywnej terapii świadczyć może szereg retrospektywnych analiz. Zetouni podaje, że spośród wszystkich rodzajów oddziałów w szpitalu, właśnie w oddziale intensywnej terapii zgłaszano najczęściej potrzebę wykonania tego zabiegu [1]. Tracheostomia jest też określana, jako jedna z najpowszechniej wykonywanych w oddziałach intensywnej terapii procedur chirurgicznych [2].
Technika chirurgiczna wykonania tracheostomii znana i stosowana jest w medycynie klinicznej od niemal stu lat. Ostatnio rozwinęły się metody przezskórne, możliwe do wykonania przy łóżku chorego. Za pierwszą z nich uważa się powszechnie metodę przedstawioną w 1985 roku przez zespół Ciaglia. Jest ona stosowana w wielu ośrodkach do dnia dzisiejszego i zyskała miano klasycznej techniki dylatacyjnej ( Percutaneous Dilatational Tracheostomy – PDT) [3]. Kolejny, dużo prostszy, instrumentalny sposób wykonania tracheostomii dylatacyjnej za pomocą specjalnych kleszczy, przedstawił Griggs w 1990 roku [4]. Całkowicie odmienna jest opracowana przez lekarzy włoskich w latach 1993-1995 metoda Fantoniego, która ze względu na sposób wytworzenia otworu stomijnego zwana jest tracheotomią przezkrtaniową ( Translaryngeal Tracheostomy – TLT) [5]. Ostatnio do medycyny klinicznej wprowadzono kolejne dwie nowe metody: Ciaglia „Blue Rhino” (2000 r.) będąca w swej istocie modyfikacją klasycznej techniki dylatacyjnej [6], oraz metoda „PercuTwist” (2002 r.) z nieco odmiennym sposobem rozszerzania ściany tchawicy [7]. Istotę zabiegów tracheotomii poszczególnymi metodami przedstawiono na rycinach 1-5. Poznawszy różne techniki tracheotomii przezskórnej, zauważyć można, że sposób wytworzenia otworu w ścianie tchawicy znacząco różni się od pozostałych tylko w technice TLT, zwanej również wsteczną.
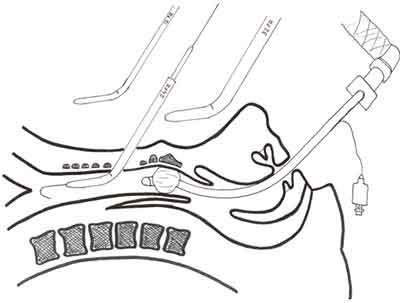
Ryc. 1. Technika Ciaglia. Otwór stomijny kształtowany jest za pomocą kolejnych rozszerzadeł, wprowadzanych po prowadnicy do światła tchawicy, aż do momentu uzyskania dylatacji, umożliwiającej wprowadzenie rurki tracheostomijnej o zaplanowanym rozmiarze.
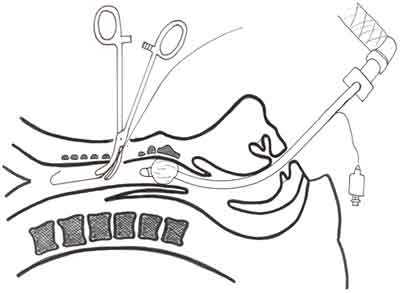
Ryc. 2. Technika Griggsa. Po umieszczonej w świetle tchawicy prowadnicy wprowadza się specjalnej konstrukcji narzędzie, mające kształt dużych kleszczy naczyniowych(Guide Wire Dilatation Forceps-GWDF). Rozwarcie i wycofanie kleszczy GWDF umożliwia wytworzenie otworu w przedniej ścianie tchawicy.
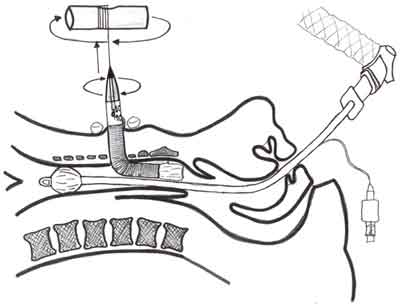
Ryc. 3. Technika Fantoniego. Tracheostomia przezkrtaniowa. Pod kontrolą bronchoskopową, drogą tracheopunkcji do tchawicy wprowadzana jest stalowa prowadnica typu J, którą poprzez krtań, nosogardło i jamę ustną wyprowadza się na zewnątrz. Do prowadnicy przymocowuje się specjalnej konstrukcji rurkę tracheostomijną. Odmiennie od poprzednich technik, istotą zabiegu jest precyzyjne, częściowe wydobycie rurki tracheostomijnej z wnętrza tchawicy w kierunku przedniej ściany szyi a następnie jej prawidłowa rotacja w kierunku rozwidlenia tchawicy.

Ryc. 4. Technika Ciaglia „Blue Rhino”. W odróżnieniu od klasycznej techniki Ciaglia, używa się tylko jednego, stożkowatego rozszerzadła. Umieszczone na nim znaczniki wskazują stopień rozwarcia ściany tchawicy w trakcie poszerzania otworu stomijnego, umożliwiając dopasowanie rurki tracheostomijnej.
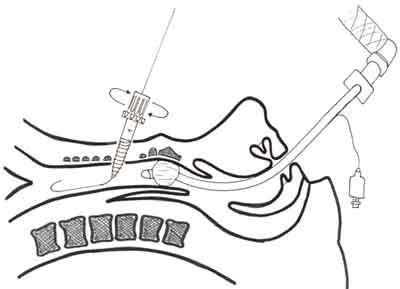
Ryc. 5. Technika „PercuTwist”. Rozszerzenie tkanek przedtchawiczych i ściany tchawicy wykonywane jest dylatatorem w kształcie śruby, delikatnie wkręcanym wzdłuż prowadnicy do światła tchawicy.
Tracheostomia wykonywana u chorych w OIT ma zwykle charakter czasowy, a okres jej utrzymania zależy od momentu powrotu pełnej wydolności oddechowej. Niezwykle istotne znaczenie mają następstwa jej zastosowania u chorych wyleczonych, u których możliwe było usunięcie rurki tracheostomijnej i zam-knięcie otworu. W piśmiennictwie światowym znaleźć można doniesienia o efektach odległych zabiegów wykonanych sposobami Ciaglia i Griggsa; ocena odległa wyników TLT znana jest jedynie z opisów autora metody, prof. A. Fantoniego [5]. W pracy tej przedstawiamy analizę następstw tej całkowicie odmiennej, odśrodkowej techniki wykonania tracheostomii.
Metodyka
W wieloprofilowym Oddziale Intensywnej Terapii Szpitala w Bielsku-Białej w 1996 roku wprowadzono technikę Grigsa, a w roku następnym metodę Fantoniego, jako rutynowy sposób wykonania tracheostomii. Równoczesne stosowanie w oddziale różnych metod tracheostomii przezskórnej, umożliwiło dobór metody do konkretnej sytuacji klinicznej i pozwoliło na wykonywanie wszystkich zaplanowanych tracheo-stomii technikami dylatacyjnymi.
Analizie poddano przebieg leczenia wszystkich kolejnych chorych hospitalizowanych w oddziale w okresie 4 lat (od sierpnia 1997 do sierpnia 2001), u których wykonano zabieg tracheostomii sposobem Fantoniego i u których leczenie zakończyło się pomyślnie. Jako kryterium czasu umożliwiającego dokonanie oceny późnych następstw tracheostomii przezkrtaniowej przyjęto okres minimum 6 miesięcy od momentu dekaniulacji.
Wykorzystując dane zawarte w historiach chorób, oceniono podstawowe dane demograficzne pacjentów, główną przyczynę ich hospitalizacji, czas intubacji dotchawiczej poprzedzający wykonanie tracheo-stomii, rodzaj zastosowanych rurek intubacyjnych oraz tracheostomijnych, czas utrzymania tracheostomii oraz czas, który upłynął od dekaniulacji do dnia przeprowadzania oceny. Ta część badania miała charakter retrospektywny.
Po uzyskaniu akceptacji Komisji Bioetycznej przy Beskidzkiej Izbie Lekarskiej w Bielsku-Białej, wszystkich zakwalifikowanych do badania chorych poddano prospektywnej ocenie odległych efektów wykonania tracheostomii. Kliniczne objawy, które mogą wystąpić jako następstwo tracheostomii (np. zmiana barwy głosu, obecność chrypki, stałego lub w trakcie wysiłku fizycznego uczucia duszności, świstu krtaniowego, bólu w miejscu zabiegu, częstych infekcji górnych dróg oddechowych lub konieczności specjalistycznego leczenia laryngologicznego lub chirurgicznego w okresie po dekaniulacji) dla każdego chorego były zbierane przez autorów pracy w formie specjalnej ankiety. Wygląd blizny był oceniany przez lekarza nie uczestniczącego w procesie leczniczym i nie znającego techniki wykonania zabiegu. Zastosowano tu następującą skalę „efektu kosmetycznego”: 1 – blizna ledwie widoczna, 2 – widoczna, ale nie wymagająca korekty, 3 – przerośnięta, zniekształcona. Dodatkowo chorym, którzy wyrazili pisemną zgodę wykonano badanie spirometryczne oraz radiologiczną ocenę światła tchawicy.
Badanie spirometryczne obejmowało pomiar: pojemności życiowej (VC), natężonej objętości wydechowej pierwszosekundowej (FEV1), natężonej objętości wydechowej półsekundowej (FEV0,5), a także badanie wypadkowej maksymalnego przepływu i objętości z automatycznym wyliczeniem: maksymalnego przepływu wdechowego w momencie odpowiadającym 50% forsownej wdechowej pojemności płuc (MIF50 – Maximal Expiratory Flow at 50%FVC IN), maksymalnego przepływu wydechowego, gdy do końca forsownego wydechu pozostało jeszcze 50% forsownej wdechowej pojemności płuc (MEF50 – Maximal Expiratory Flow at 50%FVC EX) i szczytowego przepływu wydechowego (PEF).
Uzyskane wartości oceniono wg kryteriów Rotmana, stosowanych w spirometrycznej diagnostyce zwężeń w obrębie górnych dróg oddechowych [8]. Spirometrycznym wykładnikiem zwężenia górnych dróg oddechowych było stwierdzenie przynajmniej jednej z wartości:
– MIF 50 Ł 100 l min-1
– MEF 50 / MIF 50 ł 1
– FEV1 / PEF ł 10 ml l-1 min-1
– FEV1 / FEV0,5ł 1,5
Dodatkowo oceniano kształt krzywej wdechowej i wydechowej, maksymalnego przepływu i objętości w poszukiwaniu cech mogących świadczyć o zwężeniu światła tchawicy.
Badania powyższe wykonano w Pracowni Spirometrycznej Specjalistycznego Zespołu Chorób Płuc i Gruźlicy w Bielsku-Białej, spirometrem PNEMO-RS (ARTMED, Kraków). Badania były przeprowadzane, a następnie oceniane przez specjalistę w zakresie pulmonologii, posiadającego wieloletnie doświadczenie w ocenie spirometrii, który nie uczestniczył w procesie leczniczym i nie znał techniki uprzedniego wykonania zabiegu tracheostomii.
Badanie tomografii spiralnej tchawicy wykonywano w Pracowni Diagnostyki Obrazowej Szpitala Onkologicznego w Bielsku-Białej przy użyciu tomografu GE HiSpeed DX/i (General Electric Company, USA), techniką spiralną, warstwą akwizycyjną 2 mm, rekonstrukcją co 1 mm, z wysoką rozdzielczością (matryca 512/pole skanowania 25 cm) i pitch´em 1,5. Wynik badania był oceniany zawsze przez tego samego lekarza, specjalistę radiologa z wieloletnim doświadczeniem, który również nie znał techniki poprzedniego wykonania zabiegu tracheostomii.
Wyniki
Do sierpnia 2001 r. technikę Fantoniego zastosowano u 32 krytycznie chorych leczonych w Oddziale Intensywnej Terapii (25,5±9,5 punktów w skali APACHE II przy przyjęciu do szpitala). Najczęstszym wskazaniem do wykonania tracheostomii była konieczność prowadzenia przedłużonej wentylacji mechanicznej (26 chorych – 81,2%).
W okresie poprzedzającym wykonanie tracheostomii, wszyscy chorzy intubowani byli wyłącznie rurkami intubacyjnymi z mankietami niskociśnieniowymi. Zgodnie z obowiązującym w oddziale standardem, ciśnienie w mankiecie uszczelniającym we wszelkiego rodzaju rurkach (również tracheostomijnych) było kontrolowane minimum dwa razy dziennie. Wszystkie zabiegi wykonano wykorzystując każdorazowo oryginalny zestaw (Mallincrodt Medical, Włochy).
Leczenie zakończyło się pomyślnie u 10 (31,3%) chorych i zostali oni zakwalifikowani do badania. Kompleksową analizę udało się jednak przeprowadzić tylko u 8 chorych. Jeden z pacjentów nie wyraził zgody na jakąkolwiek ocenę (chory nr 7), a w drugim przypadku (chora nr 4) tracheostomia była nadal utrzymana (w momencie zbierania danych przez 851 dni). Istotne dane analizowanej grupy chorych, mogące mieć wpływ na uzyskane wyniki zestawiono szczegółowo w tabeli I.
Tabela I. Dane chorych, których leczenie zakończyło się pomyślnie
| Numer kolejny chorego | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | wartośćśrednia |
| Inicjały chorego | K.J. | K.A. | P.Ł. | O.A. | W.M. | C.J. | N.W. | G.J. | M.H. | K.M. | |
| Płeć (M/F) | M | F | M | F | F | F | M | M | M | M | |
| Główna diagnoza * | NEUR | ARDS | IUCM | NEUR | UW | ARDS | IUCM | UW | ARDS | UW | |
| Wiek (lat) | 68 | 28 | 11 | 18 | 54 | 68 | 25 | 47 | 54 | 39 | 41,2 ?20,2 |
| Czas intubacji przed tracheotomią (dni) | 12 | 17 | 10 | 10 | 15 | 15 | 15 | 11 | 16 | 15 | 14,6 ?6,9 |
| Czas utrzymania tracheostomii (dni) | 31 | 17 | 50 | 851** | 10 | 27 | 58 | 9 | 20 | 30 | 28,0 ?16,8 |
| Czas od dekaniulacji do oceny (miesięcy) | 48 | 39 | 37,5 | ** | 37,5 | 11 | 10 | 9 | 7,5 | 7,5 | 22,8 ?16,7 |
* Wyjaśnienie zastosowanych skrótów: ARDS – zespół ostrej niewydolności oddechowej, NEUR – schorzenia neurologiczne, IUCM – izolowany uraz czaszkowo-mózgowy, UW – uraz wielonarządowy.
** Tracheostomia utrzymana w dniu zbierania danych. Oznaczonych wartości nie uwzględniono w wyliczeniu wartości średniej.
Odpowiedzi na pytania zawarte w ankiecie uzyskano od 8 chorych i w tych przypadkach dokonano również oceny blizny po zabiegu. Najczęstszym objawem stwierdzanym u chorych po dekaniulacji, była zmiana głosu odnotowana u dwóch badanych (25%). U pozostałych chorych (75%) nie odnotowano specyficznych objawów związanych z tracheostomią i żaden z nich nie wymagał specjalistycznego leczenia w okresie po dekaniulacji. U 6 chorych bliznę po tracheostomii oceniono jako ledwie widoczną (75%), a u 2 jako widoczną, nie wymagającą korekty chirurgicznej (25%).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Zetouni A, Kost K: Tracheostomy: a retrospective review of 281 cases. J Otolaryngol 1994; 23: 61-66.
2. Heffner JE, Miller KS, Sahn SA: Tracheostomy in the intensive care unit. Part 1: indications, technique, management. Chest 1986; 90: 269-274.
3. Ciaglia P, Firsching R, Syniec C: Elective percutaneous dilatational tracheostomy: a new simple bedside procedure; preliminary report. Chest 1985; 87: 715-719.
4. Griggs WM, Worthley LI, Gilligan JE, Thomas PD, Myburg JA: A simple percutaneous tracheostomy technique. Surg Gynecol Obstet 1990; 170: 543-545.
5. Fantoni A, Ripamonti D: A non-derivative, non-surgical tracheostomy: the translaryngeal method. Inten Care Med 1997; 23: 386-392.
6. Bewsher MS, Adams AM, Clarke CW, McConachie I, Kelly DR: Evaluation of a new percutaneous dilatational tracheostomy set apparatus. Anaesthesia 2001; 56: 859-864.
7. Frova G, Quintel M: A new simple method for percutaneous tracheostomy: controlled rotating dilatation. A preliminary report. Inten Care Med 2002; 28: 299-303.
8. Rotman HH, Liss HP, Weg JG: Diagnosis of upper airway obstruction by pulmonary function testing. Chest 1975; 68: 796-799.
9. Stauffer JL, Olson DE, Petty TL: Complications and consequences of endotracheal intubation and tracheostomy. Am J Med 1981; 70: 65-76.
10. Steele AP, Evans HW, Afaq MA, Robson JM, Dourado J, Tayar R, Stockwell MA: Long-term follow-up of Griggs percu-taneous tracheostomy with spiral CT and questionnaire. Chest 2000; 117: 1430-1433.
11. Norwood S, Vallina VL, Short K, Saigusa M, Fernandez LG, McLarty JW: Incidence of tracheal stenosis and other late complications after percutaneous tracheostomy. Ann Surg 2000; 232: 233-241.
12. Leonard RC, Lewis RH, Singh B, Van Heerden PV: Late outcome from percutaneous tracheostomy using the Portex kit. Chest 1999; 115: 1070-1075.
13. Callanan V, Gillmore K, Field S, Beaumont A: The use of magnetic resonance imaging to assess tracheal stenosis following percutaneous dilatational tracheostomy. J Laryngol Otol 1997; 111: 953-957.
14. Klussmann JP, Brochhagen HG, Sittel C, Eckel HE, Wassermann K: Atresia of the trachea following repeated percutaneous dilatational tracheotomy. Chest 2001; 119: 961-964.
15. Maciejewski D, Paleczny J: Wstępne doświadczenia w zastosowaniu tracheostomii sposobem Fantoniego w oddziale intensywnej terapii. Anest Int Terap 1999; 31: 39-97.
16. Lavelle TF Jr, Rotman HH, Weg JG: Isoflow-volume curves in the diagnosis of upper airway obstruction. Am Rev Respir Dis 1978; 117: 845-852.
17. Pierzchała W: Przydatność badania wypadkowej maksymalnego przepływu i objętości w rozpoznaniu zwężenia krtani i tchawicy. Pneum Pol 1982;1-2: 25-30.
18. Law RC, Carney AS, Manara AR: Long-term outcome after percutaneous dilatational tracheostomy. Endoscopic and spirometry findings. Anaesthesia 1997; 52: 51-56.
19. Walz MK, Peitgen K, Thurauf N, Trost HA, Wolfhard U, Sander A, Ahmadi C, Eigler FW: Percutaneous dilatational tracheostomy-early results and long-term outcome of 326 critically ill patients. Inten Care Med 1998; 24: 685-690.
20. Kearney PA, Griffen MM, Ochoa JB, Boulanger BR, Tseui BJ, Mentzer RM Jr: A single-center 8-year experience with percutaneous dilatational tracheostomy. Ann Surg 2000; 231: 701-709.
21. Minuto A, Besozzi A, Bertolini M, Spanu P, Iapichino G: Ciaglia´s percutaneous dilatative tracheostomy in intensive care. Perioperative complications and long-term results. Minerva Anestesiol 1998; 64: 505-512.
22. Stoeckli SJ, Breitbach T, Schmid S: A clinical and histological comparison of percutaneous dilational versus conventional surgical tracheostomy. Laryngoscope 1997; 107: 1643-1646.
23. Escarment J, Suppini A, Sallaberry M, Kaiser E, Cantais E, Palmier B, Quinot JF: Percutaneous tracheostomy by forceps dilation: report of 162 cases. Anaesthesia 2000; 55: 125-130.
24. Van Heerbeek N, Fikkers BG, Van den Hoogen FJ, Mollen RM, Marres HA: The guide wire dilating forceps technique of percutaneous tracheostomy. Am J Surg 1999; 177: 311-315.
25. Dollner R, Verch M, Schweiger P, Graf B, Wallner F: Long-term outcome after Griggs tracheostomy. J Otolaryngol. 2002; 31:386-389.





