© Borgis - Postępy Fitoterapii 2/2011, s. 106-112
*Joanna Kołodziejczyk-Czepas, Beata Olas
Garcinia – wartościowe rośliny lecznicze w profilaktyce chorób układu krążenia
Garcinia – a valuable medicinal plants in prophylaxis of cardiovascular diseases
Katedra Biochemii Ogólnej, Uniwersytet Łódzki
Kierownik Katedry: prof. dr hab. Barbara Wachowicz
Summary
Garcinia (Guttiferae) is a large genus of polygamus trees or shrubs commonly found in tropical Asia and Africa, and consists of over 200 species. Garcinia indica (dried rind known as “kokam”) is an Indian spice, used in many parts of the country for making several vegetarian and non-vegetarian “curry” preparations. Many therapeutic effects of Garcinia indica fruits have been described in traditional medicine. Garcinol, a natural biologically active compound is a polyisoprenylated benzophene derivative, isolated from the Garcinia indica fruit rind. Kokam contains also other compounds: hydroxycitric acid, citric acid, malic acid, polyphenols, carbohydrates, anthocyanin pigments and ascorbic acid. Recently, garcinol has been widely investigated because of its beneficial health properties, including anti-inflammatory and antioxidative activity. In the article, the biological activities of compounds naturally occurring in Garcinia (garcinol and guttiferone K) and their role in the protection of the cardiovascular system are described.

Wstęp
Choroby układu krążenia występujące samodzielnie lub jako powikłania innych schorzeń stanowią trudne wyzwanie dla współczesnej medycyny. Rozwój nowych metod leczenia jest wspierany przez propagowanie zdrowego stylu życia, obejmującego prawidłowe żywienie. Wiele badań potwierdza istotny związek pomiędzy dietą bogatą w składniki pochodzenia roślinnego a zmniejszeniem ryzyka wystąpienia chorób cywilizacyjnych (1). Trwają poszukiwania mające na celu opracowanie nowych i bardziej skutecznych terapii chroniących układ krążenia. W badaniach tych zwraca się szczególną uwagę na substancje i wyciągi roślinne znane od wieków i stosowane w medycynie tradycyjnej różnych kultur. Prowadzone są liczne badania, mające na celu poznanie mechanizmów ich dobroczynnego działania na organizm człowieka i możliwości zastosowania zarówno w profilaktyce, jak i w leczeniu wielu chorób.
Przykładem znanych od dawna roślin leczniczych są drzewa z rodzaju Garcinia, zawierające wiele aktywnych biologicznie związków, w tym garcinol. Suszona skórka owoców Garcinia indica jest składnikiem przypraw stosowanych w kuchni indyjskiej. Natomiast ekstrakty z Garcinia cambogia stosowane były od dawna w medycynie tradycyjnej jako lek w chorobach nowotworowych i wrzodach, leczeniu hemoroidów, biegunek oraz jako środek przeciwgorączkowy (2). Owoce Garcinia cambogia są szczególnie bogate w pochodną garcinolu – guttiferon K (ryc. 1). Obecnie dostępne dane sugerują, że garcinol i jego pochodne (na przykład guttiferon K) zawarte w tych roślinach mogą być szczególnie obiecującymi związkami o działaniu profilaktycznym i terapeutycznym. Zaobserwowano, że przede wszystkim garcinol wykazuje m.in. działanie przeciwzapalne, przeciwnowotworowe, przeciwbakteryjne oraz antyoksydacyjne (3, 4). Ponieważ wiadomo, że stres oksydacyjny jest zaangażowany w patogenezę wielu chorób, przeciwutleniające działanie garcinolu i jego pochodnych może być szczególnie istotne w jego korzystnym wpływie na układ krążenia.
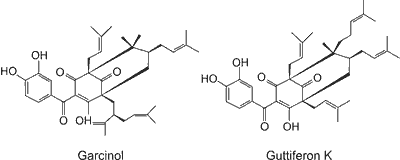
Ryc. 1. Struktura chemiczna garcinolu i jego pochodnej – guttiferonu K (wg 17).
Występowanie i właściwości biologiczne garcinolu
Garcinol (camboginol) jest naturalnym roślinnym polifenolem występującym w roślinach z rodziny Guttiferae, z rodzaju Garcinia (Garcinia cambogia, Garcinia indica, Garcinia huillkensis i in.) (5). Drzewa te występują w tropikalnych regionach Azjii i Afryki; z ponad 200 znanych gatunków Garcinia, 35 występuje na terenie Indii (6). Są bogatym źródłem drugorzędowych metabolitów, takich jak ksantony, flawonoidy, benzofenony, laktony i kwasy fenolowe. Z tego względu stanowią potencjalne źródło aktywnych biologicznie związków o korzystnym działaniu na organizm człowieka. Wysuszona skórka owocu Garcinia (określana często jako „kokam”), zawierająca 2-3% żółtego barwnika – garcinolu, spożywana jest jako składnik przyprawy curry. Stanowi także składnik wielu kosmetyków, jak również leków stosowanych w medycynie tradycyjnej Indii. Ekstrakty ze skórki owocu Garcinia zawierają oprócz garcinolu jego bezbarwny izomer (isogarcinol), kwas hydroksycytrynowy i jego lakton, kwas cytrynowy, kwas szczawiowy oraz liczne polifenole. Pod względem biochemicznym garcinol jest poliizoprenylowaną pochodną benzofenonu (7, 8).
Antyoksydacyjne działanie garcinolu
Mechanizmy antyoksydacyjnego działania garcinolu i jego pochodnych nie są jak do tej pory w pełni poznane. Badania nad garcinolem prowadzone w latach 80. XX wieku zasugerowały, że nie wykazuje on właściwości antyoksydacyjnych (9). Dlatego też większość prowadzonych dotychczas badań nad biologicznym działaniem tego związku koncentrowała się głównie na jego przeciwzapalnej i przeciwnowotworowej aktywności. Pojawia się jednak coraz więcej danych wskazujących na to, że garcinol może również wykazywać silne działanie antyoksydacyjne. Stwierdzono, że związek ten zmiata anionorodnik ponadtlenkowy, rodnik hydroksylowy oraz rodnik metylowy (10, 11). W warunkach in vitro także ekstrakt z G. indica już w niskich stężeniach (25 i 50 ppm) jest bardzo efektywnym zmiataczem wolnych rodników (12). Garcinol może także znacznie silniej niż α-tokoferol hamować produkcję rodnika hydroksylowego, powstającego w reakcji Fentona (13). Badania Mishra i wsp. (14) wykazały natomiast, że ekstrakt z G. indica lepiej niż inne preparaty roślinne przeciwdziała peroksydacji lipidów w mitochondriach. Aktywność antyoksydacyjna garcinolu wydaje się opierać na jego zdolności do oddawania atomu wodoru w reakcjach biochemicznych (15), prawdopodobnie głównymi regionami odpowiedzialnymi za przeciwutleniające działanie garcinolu są 1,3-diketon oraz część pierścienia fenolowego (16).
W wyniku reakcji garcinolu z rodnikiem nadtlenkowym pochodzącym z 2,2’-azo-bis-izobutyronitrylu (AIBN – inicjator używany w reakcjach polimeryzacji rodnikowej), zespół Sang i wsp. (13) wyizolowali i zidentyfikowali cztery główne pochodne garcinolu (1): związek będący pochodną hydroksygarcinolu (2), cambogin (isogarcinol, C38H50O6) (3), GDPPH-1 (4) i GDPPH-2 (5) (ryc. 2) (13). Utworzenie dwóch dodatkowych produktów (2 i 3) reakcji garcinolu z rodnikiem nadtlenkowym może świadczyć, że w mechanizmie antyoksydacyjnym garcinolu oprócz 1,3-diketonu i pierścienia fenolowego bierze również udział podwójne wiązanie grupy izoprenylowej. Kiedy garcinol reaguje z rodnikiem nadtlenkowym, poprzez przeniesienie pojedynczego elektronu (4, 13), w wyniku deprotonacji grupy hydroksylowej 1,3-diketonu, który uległ enolizacji, powstaje niesparowany elektron. Jeśli reakcja zostaje zainicjowana na grupie hydroksylowej przy C-3, powstają związki 2 i 4. Natomiast, jeśli reakcja rozpocznie się na grupie hydroksylowej przy C-1 powstają związki 3 i 5. Opierając się na chemicznej strukturze czterech produktów reakcji zaproponowano antyoksydacyjny mechanizm działania garcinolu, który przedstawiono na rycinie 3 (13).
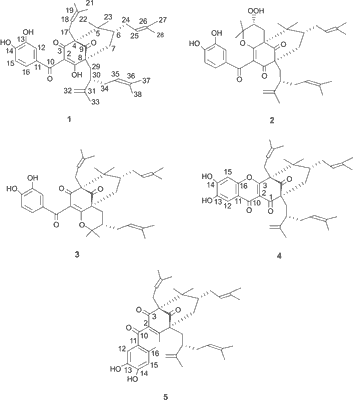
Ryc. 2. Struktura chemiczna garcinolu (1) i jego pochodnych (2-5) (wg 13).
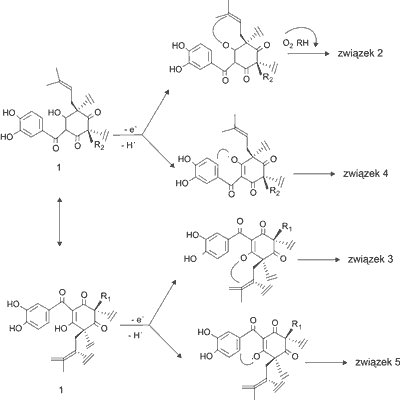
Ryc. 3. Mechanizm działania antyoksydacyjnego i tworzenia pochodnych garcinolu (2-5) (wg 13).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Kaliora AC, Dedoussis GVZ, Schmidt H. Dietary antioxidants in preventing atherogenesis. Atherosclerosis 2006; 187:1-17. 2. Wildman REC. Handbook of neutraceuticals and functional foods. CRC Press, Boca Raton 2002. 3. Chatterjee A, Yasmin T, Bagchi D i wsp. The bactericidal effects of Lactobacillus acidophilus, garcinol and Protykin compared to clarithromycin, on Helicobacter pylori. Mol Cell Biochem 2003; 243:29-35. 4. Hong J, Kwon SJ, Sang S, i wsp. Effects of garcinol and its derivatives on intestinal cell growth: inhibitory effects and autooxidation-dependent growth-stimulatory effects. Free Rad Biol Med 2007; 42:1211-21. 5. Jena BS, Jayaprakasha GK, Singh RP i wsp. Chemistry and biochemistry of (–)hydroxycitric acid from Garcinia. J Agric Food Chem 2002; 50:10-22. 6. Padhye S, Ahmad A, Oswal N i wsp. Emerging role of garcinol, the antioxidant chalcone from Garcinia indica Choisy and its synthetic analogs. J Hematol Oncol 2009; 2:38. 7. Peter KV. Handbook of herbs and species. CRC Press, Boca Raton 2001. 8. Duke JA, Bogenschutz-Godwin MJ, duCellier J i wsp. Hand book of medicinal herbs. 2nd ed. CRC Press, Boca Raton 2002; 481. 9. Krishnamurthy N, Sampathu SR. Antioxidant principles of Kokum rind. J Food Sci Technol 1988; 25, 44-5. 10. Tanaka T, Kohno H, Shimada R i wsp. Prevention of colonic aberrant crypt foci by dietary feeding of garcinol in male F344 rats. Carcinogenesis 2000; 21:1183-9. 11. Liao Ch-H, Ho Ch-T, Lin J-K. Effects of garcinol on free radical generation and NO? production in embryonic rat cortical neurons and astrocytes. Biochem Biophys Res Commun 2005; 329:1306-14. 12. Selvi AT, Joseph GS, Jayaprakasha GK. Inhibition of growth and aflatoxin production in Aspergillus flavus by Garcinia indica extract and its antioxidant activity. Food Microbiol 2003; 20:455-60. 13. Sang S, Pan M-H, Cheng X i wsp. Chemical studies on antioxidant mechanism of garcinol: analysis of radical reaction products of garcinol and their antitumor activities. Tetrahedron 2001; 57:9931-8. 14. Mishra A, Bapat MM, Tilak JC i wsp. Antioxidant activity of Garcinia indica (kokam) and its syrup. Curr Sci 2006; 91:90-3. 15. Shimada KK, Fujikawa KY, Nakamura T. Antioxidative properties of xanthan on autooxidation of soybean oil in cyclodextrin. J Agric Food Chem 1992; 40: 945-8. 16. Sang S, Liao C-H, Pan M-H i wsp. Chemical studies on antioxidant mechanism of garcinol: analysis of radical reaction products of garcinol with peroxyl radicals and their antitumor activities. Tetrahedron 2002; 58:10095-102. 17. Kołodziejczyk J, Masullo M, Olas B i wsp. Effects of garcinol and guttiferone K isolated from Garcinia cambogia on oxidative/nitrative modifications in blood platelets and plasma. Platelets 2009; 20:487-92. 18. Beckman JS, Beckman TW, Chen J i wsp. Apparent hydroxyl radical production by peroxynitrite: implications for endothelial injury from nitric oxide and superoxide. Proc Natl Acad Sci USA 1990, 87:1620-4. 19. Ischiropoulos H, Zhu L, Beckman JS. Peroxynitrite formation from macrophage-derived nitric oxide. Arch Biochem Biophys 1992; 298:446-51. 20. Olas B, Wachowicz B. Rola reaktywnych form tlenu w płytkach krwi. Post Biol Kom 2003; 2:325-37. 21. Olas B, Wachowicz B. Role of reactive nitrogen species in blood platelet functions. Platelets 2007; 23:1-11. 22. Nowak P, Olas B, Wachowicz B. Stres oksydacyjny w przebiegu hemostazy. Post Biochem 2010, 2, 56(3):239-247. 23. Low SY, Sabetkar M, Bruckdorfer KR i wsp. The role of protein nitration in the inhibition of platelet activation by peroxynitrite. FEBS Letters 2002; 511:59-64. 24. Herrero MB, de Lamirande E, Gagnon C. Tyrosine nitration in human spermatozoa: a physiological function of peroxynitrite, the reaction product of nitric oxide and superoxide. Mol Human Reprod 2001; 7:913-21. 25. Ischiropoulos H. Biological tyrosine nitration: a pathophysiological function of nitric oxide and reactive oxygen species. Arch Biochem Biophys 1998; 1:1-11. 26. Sucu N, Unlu A, Tamer L i wsp. 3-nitrotyrosine in atherosclerotic blood vessels. Clin Chem Lab Med 2003; 1:23-5. 27. Nuriel T, Deeb RS, Hajjar DP i wsp. Protein 3-nitrotyrosine in complex biological samples: quantification by high-pressure liquid chromatography/electrochemical detection and emergence of proteomic approaches for unbiased identification of modification sites. Methods Enzymol 2008; 441:1-17. 28. Dietrich-Muszalska A, Olas B. Modifications of blood platelet proteins of patients with schizophrenia. Platelets 2009; 20:90-6. 29. Dalle-Donne I, Giustarini D, Colombo R i wsp. Protein carbonylation in human diseases. Trends Mol Med 2003; 9:169-76. 30. Dalle-Donne I, Rossi R, Giustarini D i wsp. Protein carbonyl groups as biomarkers of oxidative stress. Clin Chim Acta 2003; 329:23-38. 31. Olas B, Nowak P, Kołodziejczyk J i wsp. The effects of antioxidants on peroxynitrite-induced changes in platelet proteins. Thromb Res 2004; 113, 399-406. 32. Olas B, Nowak P, Kołodziejczyk J i wsp. Protective effects of resveratrol against oxidative/nitrative modifications of plasma proteins and lipids exposed to peroxynitrite. J Nutr Biochem 2006; 17:96-102. 33. Nowak P, Kołodziejczyk J, Wachowicz B. Peroxynitrite and fibrinolytic system; The effect of peroxynitrite on plasmin activity. Mol Cell Bioch 2004; 267, 141-6. 34. Madamanchi NR, Vendrov A, Runge MS. Oxidative stress and vascular disease. Arteroscler Thromb Vasc Biol 2005; 25:29-38. 35. Griendling KK, Fitzgerald GA. Oxidative stress and cardiovascular injury. Part I: Basic mechanisms and in vivo monitoring of ROS. Circulation 2003; 108:1912-16. 36. Esmon CT. Crosstalk between inflammation and thrombosis. Maturitas 2004; 47:305-14. 37. Coleman JW. Nitric oxide in immunity and inflammation. Int Immunopharmacol 2001; 1:1397-406. 38. Kowalczyk E, Kopff A, Kopff M i wsp. Metabolizm tlenku azotu. Wiad Lek 2006; 59:889-93. 39. Vinten-Johansen J. Physiological effects of peroxynitrite. Circ Res 1997; 87:170-2. 40. Hayashi Y, SawaY, Ohtake S i wsp. Peroxynitrite formation from human myocardium after ischemia-reperfusion during open heart operation. Ann Thorac Surg 2001; 72:571-6. 41. Liao CH, Sang S, Liang YC i wsp. Suppression of inducible nitric oxide synthase and cyclooxygenase-2 in downregulating nuclear factor-kappa B pathway by garcinol. Mol Carcinog 2004; 41:140-9. 42. Bogatcheva NV, Sergeeva MG, Dudek SM i wsp. Arachidonic acid cascade in endothelial pathobiology. Microvasc Rese 2005; 69:107-27. 43. Hong J, Sang S, Park H-J i wsp. Modulation of arachidonic acid metabolism and nitric oxide synthesis by garcinol and its derivatives. Carcinogen 2006; 2:278-86. 44. Koeberle A, Northoff H, Werz O. Identification of 5-lipoxygenase and microsomal prostaglandin E2 synthase-1 as functional targets of the anti-inflammatory and anti-carcinogenic garcinol. Biochem Pharmacol 2009; 77:1513-21. 45. Koshy AS, Anila L, Vijayalakshmi NR. Flavonoids from Garcinia cambogia lower lipid levels in hypercholesterolemic rats. Food Chem 2001; 72:289-94. 46. Hutadilok-Towatana N, Kongkachuay S, Mahabusarakam W. Inhibition of human lipoprotein oxidation by morelloflavone and camboginol from Garcinia dulcis. Nat Prod Res 2007; 21(7):655-62. 47. Yamaguchi F, Ariga T, Yoshimura Y i wsp. Antioxidative and anti-glycation activity of garcinol from Garcinia indica fruit rind. J Agric Food Chem 2000; 48:180-5. 48. Jabłońska-Trypuć A. Molekularny mechanizm nieenzymatycznej glikacji białek i jej rola w cukrzycy. Przegląd Kardiodiabet 2007; 2(4):253-8.



