© Borgis - Postępy Fitoterapii 2/2011, s. 113-121
*Bogdan Kędzia
Propolis w leczeniu próchnicy zębów
Propolis in the treatment of dental caries
Instytut Włókien Naturalnych i Roślin Zielarskich w Poznaniu
Dyrektor Instytutu: prof. dr hab. Grzegorz Spychalski
Summary
Dental caries is a infection caused by physiological bacterial flora of oral cavity. This process is initiated by dental plaque. Dental plaque is a bacteria biofilm on the surface of teeth. The developing of caries is caused by Streptococci, mainly Streptococcus mutans and S. sobrinus.
The bacteriostatic and bactericidal activity of propolis on microorganisms dental caries, antiadherent activity, influence of propolis on experimental caries also therapy of dental caries by propolis are discussed.

Płytka nazębna
Próchnica zębów jest zakażeniem wywołanym przez fizjologiczną florę jamy ustnej. Jest to miejscowe zniszczenie tkanki zębowej przez bakteryjne produkty fermentacji węglowodanów zawartych w pożywieniu. Proces ten jest następstwem demineralizacji szkliwa zębowego na skutek wytwarzania przez drobnoustroje jamy ustnej produktów kwaśnych. Produkty te powstają w wyniku metabolizmu przez drobnoustroje węglowodanów, głównie sacharozy. Sacharoza jest cukrem dobrze rozpuszczającym się w ślinie i stanowi substrat do produkcji zewnątrzkomórkowych polisacharydów i kwasów. Drobnoustroje próchnicogenne wytwarzają z sacharozy nierozpuszczalne w wodzie glikany, które są dla nich źródłem substancji odżywczych oraz siedliskiem służącym do dalszego ich rozwoju. Ponadto ułatwiają one przyleganie (adhezję) drobnoustrojów do powierzchni zęba.
Płytka nazębna jest nalotem bakteryjnym, tworzącym się na powierzchni zębów, złożonym z żywych i martwych bakterii, ich produktów oraz wspomnianych wyżej glikanów i produktów pochodzących ze śliny i składników pożywienia. Na rycinie 1 przedstawiono lokalizację płytki nazębnej na powierzchni zębów. Rozróżniamy płytkę nazębną tworzącą się w bruzdach zębów, na ich gładkich powierzchniach (płytka nazębna naddziąsłowa), na powierzchni stycznych zębów (płytka nazębna naddziąsłowa) i pomiędzy dziąsłami i zębami (płytka nazębna poddziąsłowa).
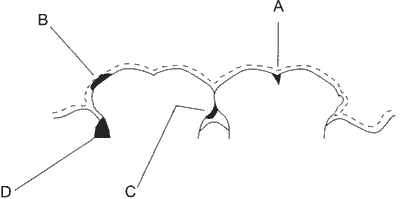
Ryc. 1. Lokalizacja płytki nazębnej na powierzchni zębów (wg 1).
A – Płytka nazębna typu bruzdowego, B – płytka powierzchniowa (naddziąsłowa), C – płytka na powierzchniach stycznych zębów (naddziąsłowa), D – płytka poddziąsłowa.
Zapoczątkowanie i dalszy rozwój próchnicy zębów przypisuje się paciorkowcom, głównie Streptococcus mutans i S. sobrinus. Inne paciorkowce jamy ustnej (S. cricetus, S. ferus, S. raptus, S. macacie i S. downei) spotykane są w płytce nazębnej bardzo rzadko. W dalszym procesie powstawania próchnicy zębów dużą rolę odgrywają pałeczki kwasu mlekowego – Lactobacillus sp. oraz promieniowce – Actinomyces sp.
Próchnica początkowa, polegająca na przerwaniu ciągłości szkliwa zębowego, jest odwracalna i szkliwo może ulec remineralizacji. Jednakże w miarę postępowania procesu dochodzi do ubytku twardych tkanek zęba. Jeśli procesu nie udaje się przerwać (na drodze leczenia ubytku), przenosi się on na zębinę, a następnie niszczy miazgę zębową.
Próchnica zębów jest jedną z najczęściej spotykanych chorób u ludzi i jest wynikiem częstego spożywania węglowodanów oraz niedostatecznej higieny jamy ustnej.
Działanie propolisu na drobnoustroje wywołujące próchnicę zębów
W badaniach in vitro ekstrakty z propolisu wykazują działanie przeciwdrobnoustrojowe, hamujące glukozylotransferazę i przeciwadherencyjne. Badania prowadzono głównie na paciorkowcach próchnicotwórczych Streptococcus mutans i S. sobrinus.
W przypadku działania przeciwdrobnoustrojowego oceniano aktywność bakteriostatyczną (MIC) i bakteriobójczą (MBC) paciorkowców próchnicotwórczych. Określano również hamowanie u tych drobnoustrojów enzymu glukozylotransferazy (GTS) syntetyzującego glukany z sacharozy oraz hamowanie zdolności przylegania paciorkowców próchnicotwórczych do tkanki zębowej, tzw. adherencji (ADH).
Działanie przeciwdrobnoustrojowe
Koo i wsp. (2) oceniali działanie bakteriostatyczne (MIC – Minimal inhibitory concentration) i bakteriobójcze (MBC – Minimal bactericidal concentration) 3 ekstraktów etanolowych z propolisu (EEP) pochodzącego z różnych rejonów Brazylii na paciorkowce próchnicotwórcze.
Badania wykazały, że MIC wobec Streptococcus mutans, S. sobrinus i S. cricetus (tab. 1) mieści się w granicach 25-400 μg/ml, a MBC w granicach 100 -> 800 μg/ml.
Tabela 1. Działanie bakteriostatyczne (MIC) i bakteriobójcze (MBC) ekstraktów etanolowych z propolisu (EEP) na paciorkowce próchnicotwórcze (wg 2).
| Paciorkowce próchnicotwórcze |
Działanie EEP* |
| MIC (μg/ml) |
MBC (μg/ml) |
Streptococcus mutans
Streptococcus sobrinus
Streptococcus cricetus | 50, 100, 400
25, 50, 400
25, 50, 400 | 400, 400, > 800
100, 200, > 800
100, 200, > 800 |
| *W badaniach uwzględniono 3 próbki EEP pochodzące z różnych rejonów Brazylii. |
Badania Hayacibary i wsp. (3), prowadzone na 2 próbkach propolisu brazylijskiego (tab. 2) wykazały, że ekstrakty etanolowe (EEP), jak również frakcje heksanowe (Fr. Heks.) i chloroformowe (Fr. CHCl3) wykazywały działanie bakteriostatyczne (MIC) w granicach 12,5-400 μg/ml i działanie bakteriobójcze (MBC) w granicach 50-400 μg/ml. Fr. Heks. pochodzące z obu próbek propolisu były bardziej aktywne w porównaniu do EEP, natomiast Fr. CHCl3 miały podobną aktywność przeciwdrobnoustrojową w porównaniu do EEP.
Tabela 2. Działanie bakteriostatyczne (MIC) i bakteriobójcze (MBC) ekstraktów etanolowych (EEP) z propolisu brazylijskiego i ich frakcji na paciorkowce próchnicotwórcze (wg 3).
Ekstrakty etanolowe (EEP) z propolisu i ich frakcje | Paciorkowce próchnicotwórcze |
| S. mutans |
S. sobrinus |
| MIC |
MBC |
MIC |
MBC |
Propolis 3
EEP
Frakcja heksanowa
(Fr Heks.)
Frakcja chloroformowa (Fr. CHCl3) | 25-50
25-50
25-50 | 200-400
50-100
200-400 | 25-50
12,5-25
25-50 | 100-200
25-50
200-400 |
Propolis 12
EEP
Fr Heks.
Fr. CHCl3 | 200-400
25-50
200-400 | 200-400 | 200-400
25-50
200-400 | 200-400 |
Z kolei badania Kima i wsp. (4) wykazały, że paciorkowce chorobotwórcze, pochodzące z zębów próchniczych, w liczbie 57, były bardzo wrażliwe na działanie ekstraktu etanolowego (EEP) z propolisu koreańskiego. Wyniki badań zebrane w tabeli 3 wskazują, że 33,3% tych szczepów było wrażliwych na działanie EEP w stężeniu 17,5 μg/ml, 64,9% było wrażliwych na działanie EEP w stężeniu 35,0 μg/ml i 1,8% szczepów było wrażliwych na działanie EEP w stężeniu 70,0 μg/ml.
Tabela 3. Działanie bakteriostatyczne (MIC) ekstraktu etanolowego (EEP) z propolisu koreańskiego na paciorkowce próchnicotwórcze (wg 4).
| Paciorkowce próchnicotwórcze |
Liczba szczepów |
Stężenie EEP hamujące wzrost szczepów paciorkowców (MIC) (μg/ml) |
| 17,5 |
35,0 |
70,0 |
Streptococcus mutans
Streptococcus sobrinus | 41
46 | 18
1 | 23
14 | 0
1 |
Łącznie
Procent | 57
100,0 | 19
33,3 | 37
64,9 | 1
1,8 |
Na podstawie przedstawionych powyżej wyników badań można przyjąć, że paciorkowce próchnicotwórcze (głównie S. mutans i S. sobrinus) były wrażliwe na działanie ekstraktów propolisowych w granicach stężeń 17,5-400 μg/ml. Natomiast działanie bakteriobójcze tych ekstraktów w większości mieściło się w granicach 100-400 μg/ml, jednak w niektórych przypadkach było wyższe od 800 μg/ml.
Hamowanie aktywności glukozylotransferazy (GTS)
Ikeno i wsp. (5) wykazali, że aktywność glukozylotransferazy (GTS) hamowana jest przez ekstrakt etanolowy z propolisu (EEP). Do hodowli komórek paciorkowców próchnicotwórczych dodawano EEP w ilości 2,5 mg/ml i oceniano aktywność wytwarzanego enzymu. Wyniki badań zebrane w tabeli 4 wskazują, że w przypadku Streptococcus mutans EEP hamował aktywność GST na poziomie 60,3%, w przypadku S. sobrinus na poziomie 38,7%, a w przypadku S. cricetus na poziomie 39,5%.
Tabela 4. Wpływ ekstraktu etanolowego (EEP) z propolisu na aktywność glukozylotransferazy (GTS) (wg 5).
| Paciorkowce próchnicotwórcze jako źródło GTS |
Aktywność GTS (mg/2 h/ml) |
| bez EEP |
EEP (2,5 mg/ml) |
obniżenie aktywności (%) |
Streptococcus mutans
Streptococcus sobrinus
Streptococcus cricetus | 6,30
1,86
2,00 | 2,50
1,14
1,21 | 60,3
38,7
39,5 |
Badania Koo i wsp. (6) wyraźnie wskazują, że ekstrakt etanolowy z propolisu (EEP) hamuje tworzenie się nierozpuszczalnego w wodzie glukanu z sacharozy pod wpływem glukozylotransferazy (GTS). W roztworze reakcyjnym znajdowało się 1.000 μl 0,25 mol/l sacharozy, 100 μl enzymu glukozylotransferazy (GTS) oraz odpowiednie stężenia EEP (μg/ml).
Stwierdzono (ryc. 2), że pod wpływem wzrastających stężeń EEP (5, 15, 30 i 60 μg/ml) następowało gwałtowne hamowanie powstawania nierozpuszczalnego glukanu z sacharozy (odpowiednio 917, 750, 225 i 26 μg/ml). Całkowite zahamowanie powstawania glukanu z sacharozy indukowane przez GST zaobserwowano przy stężeniu EEP w ilości 80 μg/ml.
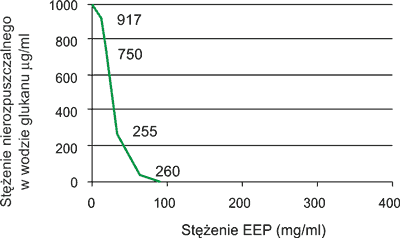
Ryc. 2. Hamowanie tworzenia się nierozpuszczalnego w wodzie glukanu z sacharozy pod wpływem glukozylotransferazy (GST) w obecności ekstraktu etanolowego z propolisu (EEP) (wg 6).
Późniejsze badania Koo i wsp. (7) potwierdziły te spostrzeżenia. W obecności 3 różnych ekstraktów etanolowych z EEP pochodzenia brazylijskiego, całkowite zahamowanie syntezy nierozpuszczalnego glukanu z sacharozy pod wpływem glukozylotransferazy (GTS) zachodziło w obecności EEP w granicach stężeń od 125 do 500 μg/ml.
W tabeli 5 przedstawiono wpływ ekstraktów i frakcji uzyskanych z propolisu na aktywność enzymu glukozylotransferazy (GTS). Z badań wykonanych przez Hayacibarę i wsp. (3), Koo i wsp. (8) oraz Duarte i wsp. (9) wynika, że największą aktywnością hamowania tego enzymu odznaczała się frakcja chloroformowa i heksanowa otrzymane z ekstraktu etanolowego z propolisu (hamowały one w 50% aktywność GTS w stężeniach 11,4 i 17,9 μg/ml). Ekstrakty etanolowe, chloroformowe, heksanowe i octanu etylu działały nieco słabiej. Hamowały one w 50% aktywność GTS w granicach stężeń 41,2-141,9 μg/ml.
Tabela 5. Wpływ ekstraktów z propolisu i ich frakcji na aktywność glukozylotransferazy (GTS) (wg 3, 8, 9).
| Pozycja piśmiennictwa |
Rodzaj ekstraktu lub frakcji z propolisu |
Stężenie hamujące 50% aktywności GTS (μg/ml) |
3
8
9 | Ekstrakt chloroformowy
Ekstrakt etanolowy (EEP)
Ekstrakt heksanowy
Ekstrakt octanu etylu
Ekstrakt etanolowy (EEP)
Frakcja heksanowa z EEP
Frakcja chloroformowa z EEP | 97,3
105,4
125,7
141,9
41,2
17,9
11,4 |
Badania Ikeno i wsp. (5) oraz Koo i wsp. (10) wykazały, że wśród składników propolisu odpowiedzialnych za hamowanie aktywności GTS znajduje się kwas cynamonowy, apigenina i kemferol (tab. 6). Stwierdzono, że kwas cynamonowy w stężeniach od 5,0 do 7,5 mg/ml hamował w ponad 90% aktywność enzymu GTS. W stężeniach od 67,5 do 140,0 mg/ml właściwości takie wykazywały apigenina i kemferol. Są to przedstawiciele kwasów aromatycznych i związków flawonoidowych występujących w propolisie. Prawdopodobnie również inne związki obecne w ekstraktach propolisowych odznaczają się podobnym działaniem. Wymaga to jednak dalszych badań w tym kierunku.
Tabela 6. Składniki propolisu odznaczające się zdolnością hamowania aktywności glukozylotransferazy (GTS) (wg 5, 10).
| Składniki propolisu |
Piśmiennictwo |
Stężenia związków hamujące w ponad 90% aktywność GTS |
| stężenie związku (mg/ml) |
hamowanie enzymu (%) |
| Kwas cynamonowy | 5 | 5,0
6,25
7,5 | 91,8
98,8
99,8 |
| Apigenina | 10 | 67,5
135,0 | 92,8
94,3 |
| Kemferol | 10 | 140,0 | 90,4 |
Działanie antyadherencyjne
Jedną z cech paciorkowców próchnicotwórczych jest ich zdolność przylegania do tkanki zębowej. Hamowanie tego procesu nazywamy działaniem antyadherencyjnym. Ekstrakty propolisowe odznaczają się takimi właściwościami.
Koo i wsp. (7) badali wpływ ekstraktów etanolowych (EEP) otrzymanych z propolisu brazylijskiego na przyleganie paciorkowców próchnicotwórczych do powierzchni. Do tego celu użyto Streptococcus mutans i S. sobrinus, które hodowano w probówkach ułożonych pod kątem 30° przez 18 godz., w obecności różnych stężeń EEP, a następnie hodowlę tych drobnoustrojów przylegającą do ścian probówki (po usunięciu hodowli) zawieszano w jałowiej wodzie destylowanej i określano ich liczbę spektrofotometrycznie. Na tej podstawie określano stężenie EEP całkowicie hamujące przyleganie paciorkowców do powierzchni szkła.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Samaranayake LP. Podstawy mikrobiologii dla stomatologów. Wyd Lek PZWL, Warszawa 2004; 237-56. 2. Koo H, Rosalen PL, Cury JA i wsp. Effect of a new variety of Apis mellifera propolis on mutans streptococci. Curr Microbiol 200; 41:192-6. 3. Hayacibara MF, Koo H, Rosalen PL i wsp. In vitro and in vivo effects of isolated fractions of Brazilian propolis on caries development. J Ethnopharmacol 2005; 101:110-5. 4. Kim MJ, Kim CS, Kim B-H i wsp. Antimicrobial effect of Korean propolis against the mutans streptococci isolated from Koreans. J Microbiol 2011; 49: 161-4. 5. Ikeno K, Ikeno T, Miyazawa C. Effects of propolis on dental karies in rats. Caries Res 1991; 25:347-51. 6. Koo H, Gomes BPFA, Rosalen PL i wsp. In vitro antimicrobial activity of propolis and Arnica montana against oral pathogens. Arch Oral Biol 2000; 45:141-8. 7. Koo H, Rosalen PL Cury JA i wsp. Effect of a new variety of Apis mellifera propolis on rmutans streptococci. Curr Microbiol 2000; 41:192-6. 8. Koo H, Vacca-Smith AM, Bowen WH i wsp. Effects of Apis mellifera propolis on the activities of streptococcal glucosyltransferases in solution and adsorbed on to saliva-coated hydroxyapatite. Caries Res 2000; 34:418-26. 9. Duarte S, Koo H, Bowen WH i wsp. Effect of a novel type of propolis and its chemical fractions on glucosyltransferases and on grouth and adherence of mutans streptococci. Biol Pharm Bull 2003; 26:527-31. 10. Koo H, Rosalen PL, Cury JA i wsp. Effects of compounds found in propolis on Streptococcus mutans growth and on glucosyltransferase activity. Antimicrob Agents Chemother 2002; 46:1302-9. 11. Koo H, Rosalen PL, Cury JA i wsp. Effect of Apis mellifera propolis from two Brazilian regions on caries development in desalivated rats. Caries Res 1999; 33: 393-400. 12. Duarte S., Rosalen P, Hayacibara MF i wsp. The influence of a novel propolis on mutans streptococci biofilms and caries development in rats. Arch Oral Biol 2006; 51:15-22. 13. Schmidt H, Hempel C-M, Schmidt G i wsp. Doppelblindversuch über den Einfluss eines propolishaltingen Mundwassers auf die entzündete und gesunde Gingiva. Stomatol DDR 1980; 30:491-7. 14. Poppe B, Michaelis H. Ergebnisse einer zweimal Ehrlich kontrollierten Mundhygieneaktion mit propolishaltiger Zahnpaste (Doppelblindstudie). Stomatol DDR 1986; 36: 195-203. 15. Neumann D, Götze G, Binus W. Klinische Studie zur Untersuchung der Plaque- und Gingivitishemmung durch Propolis. Stomatol DDR 1986; 36:677-81. 16. Murray MC, Worthington HV, Blinkhorn AS. A study to investigate the effect of a propolis-containing mouthrinse on the inhibition of de novo plaque formation. J Clin Periodontol 1997; 24:796-8. 17. Koo H, Cury JA, Rosalen PL i wsp. Effect of mout hrinse contaning selected propolis on 3-day dental plaque accumulation and polysaccharide formation. Caries Res 2002; 36:445-8. 18. Danilewskij NF, Frankowskaja SI, Flis ZA i wsp. Propolis und ihre Auwendung in der Stomatologie. Probl Stomatol (Kiew) 1960; Nr 5:422-3. 19. Vljakov M. Naszijat opit s pczelen klej pri leczenieto na d’lbokija karies na wremienite z’bi. Stomatologija (Sofia) 1969; Nr 5:394-7. 20. Scheller S, Stojko A, Szwarnowiecka I i wsp. Przeciwbakteryjne właściwości kitu pszczelego. Now Wet 1978; 8:73-6. 21. Ilewicz L, Scheller S, Chróściel H i wsp. Dalsze próby zastosowania etanolowego ekstraktu propolisu (EEP) w leczeniu niektórych chorób zębów i błony śluzowej jamy ustnej. Czas Stomat 1982; 35:749-53.


