© Borgis - Postępy Fitoterapii 2/2015, s. 89-95
*Katarzyna Sułkowska-Ziaja, Paulina Motyl, Bożena Muszyńska, Anna Firlej
Piptoporus betulinus (Bull.) P. Karst. – bogate źródło związków aktywnych biologicznie
Piptoporus betulinus (Bull.) P. Karst. – a rich source of biologically active compounds
Katedra i Zakład Botaniki Farmaceutycznej, Wydział Farmaceutyczny, Uniwersytet Jagielloński Collegium Medicum w Krakowie
Kierownik Katedry i Zakładu: prof. dr hab. Halina Ekiert
Summary
Piptoporus betulinus Bull. P. Karst. is a mushroom species belonging to the family of Fomitopsidaceae. It is a relatively common component of the native mycoflora. This species had been used in folk medicine due to its antimicrobial properties, helping agent in acceleration of wounds healing, but also as laxative as well as assisting in stomach diseases. Chemical and biological studies have shown that extracts of its fruiting bodies as well as isolated from them compounds are curative, comprising a multidirectional antimicrobial and antiviral activity. They have the ability to inhibit cell mitoses in plants, stimulate the growth of yeasts and moulds, and the induction of interferon synthesis. The present work describes the chemical composition and biological activity of extracts from fruiting bodies and biomass from in vitro cultures of this species.

Pozycja taksonomiczna i etymologia
Piptoporus betulinus (Bull.) P. Karst – białoporek brzozowy, przedstawiciel rodziny Fomitopsidaceae – Pniarkowate, jest grzybem bardzo pospolitym. Swoim zasięgiem obejmuje półkulę północną. Charakterystyczną cechą tego gatunku jest kolonizowanie brzóz (Betula sp.). Występuje zarówno na żywych, jak i martwych pniach i gałęziach tego gatunku. Najczęściej spotykany jest on w lasach, zaroślach, parkach, przy drogach, szczególnie w miejscach wilgotnych i zacienionych. Jego owocniki wyrastają od wiosny do jesieni, są jednoroczne. Przez niektórych autorów młode owocniki tego gatunku uważane są za jadalne. Powszechnie jest on jednak zaliczany do grzybów niejadalnych (1).
Nazwa piptoporus to połączenie dwóch słów – greckiego czasownika piptein, które oznacza „spadać”, „zrzucać” i wywodzącego się z łaciny słowa porus, które oznacza „pory”. Drugi człon nazwy betulinus (łac.) oznacza „brzozowy” i nawiązuje do rodzaju drzewa, na którym rośnie białoporek (2).
Opis morfologiczny
Owocniki białoporka osiągają rozmiary od 50 do 200 mm szerokości i od 20 do 60 mm grubości. Występują pojedynczo lub w nielicznych grupach. Są mocno zrośnięte z drewnem, przyrośnięte bokiem do podłoża lub też wyrastają z silnie skróconego, szczątkowego trzonu. Początkowo owocnik ma barwę białą, ciemniejącą z czasem w brudnoorzechową, płową. Młode owocniki mają kształt kolisty, przechodzący następnie w nerkowaty. Powierzchnia początkowo jest gładka i sprawiająca wrażenie pokrytej cienką, przypominającą papier błonką. Z wiekiem staje się matowa, często popękana i lekko się złuszcza. Brzegi owocnika są tępe, nabrzmiałe, mocno zaokrąglone i często podwinięte, o wałkowatym kształcie.
Pory warstwy hymenialnej są białe, jasnobrązowe lub białoszare, o średnicy od 0,15 do 0,25 mm, mają kształt kulisty bądź lekko kanciasty. Rurki mają początkowo barwę białą, która z wiekiem przechodzi w słomkową. Są one krótkie, od 1 do 8 mm długości, w jednej warstwie. Charakterystyczną cechą jest ich oddzielanie się od miąższu. Grubość miąższu mieści się pomiędzy 15 a 40 mm. Miąższ barwy białej, w młodych owocnikach miękki, soczysty i elastyczny, z wiekiem szarzeje, staje się kruchy i bardzo lekki. Smak grzyba jest łagodny lub nieco gorzkawy i kwaskowaty (1).
Skład chemiczny owocników Piptoporus betulinus
Analiza cukrów prostych wchodzących w skład polisacharydów nierozpuszczalnych w wodzie, a rozpuszczalnych w środowisku zasadowym, określonych jako WIP (ang. water insoluble polysaccharides) wykazała, że w przeważającej ilości składają się one z glukozy (94,3%), w niewielkiej ilości z mannozy (4,1%) i ksylozy (1,5%), zaś galaktoza występowała tylko w ilościach śladowych.
Wiązaniem przeważającym w polisacharydach jest połączenie α-(1→3) (3). Całkowitą zawartość węglowodanów w owocnikach określono na poziomie 12,51 g/100g s.m., w tym ok. 0,36 g/100 g s.m. stanowi mannitol i ok. 12,15 g/100 g s.m. trehaloza.
Analiza profilu kwasów tłuszczowych dowiodła, że ilościowo dominują nienasycone kwasy tłuszczowe: PUFA (61,98%) i MUFA (8,92%). Owocniki zawierają również witaminy, m.in. α-, β-, γ- i δ-tokoferol (577,62 μg/100 g s.m.) oraz witaminę C (87,9 mg/100 g s.m.). Ponadto stwierdzono obecność β-karotenu (0,09 mg/100 g s.m.) i likopenu (0,23 mg/g s.m.), a także oznaczono całkowitą zawartość flawonoidów (6,79 mg/g ekstraktu) i związków fenolowych (34,94 mg/g ekstraktu) (4).
Szeroko reprezentowane są związki o strukturze terpenów, takie jak neosterol czy fitosterol. W owocnikach zidentyfikowano również ergosta-7,22-dien-3-β-ol, fungisterol, ergosterol oraz kwas tumulozowy (ryc. 1) (5, 6).
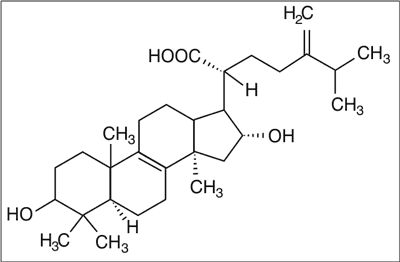
Ryc. 1. Budowa chemiczna kwasu tumulozowego.
Badania produktów hydrodestylacji owocników pozwoliły na identyfikację związków reprezentujących różne grupy chemiczne. Stwierdzono obecność mono- i seskwiterpenów, alkoholi alifatycznych, aldehydów, ketonów, a także związków aromatycznych. Po raz pierwszy w historii wyizolowano (S)-(-)-daucen, izobazzanen oraz (-)-β-barbaten (ryc. 2) – związki terpenowe o uznanej aktywności biologicznej (6).
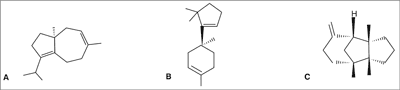
Ryc. 2. Budowa chemiczna (S)-(-)daucenu (A), izobazzanenu (B) i (-)-β-barbatenu (C).
Podczas analizy GC/MS lotnych związków występujących w ekstrakcie dichlorometanowym z owocników stwierdzono, że dominującymi ilościowo składnikami są 1-okten-3-ol i 1-oktanol. Oznaczono też niewielkie ilości 3-heptanonu i limonenu (ryc. 3). Związek 1-okten-3-ol, powszechnie występujący w grzybach, zwany alkoholem grzybowym, odpowiada za intensywny zapach owocników, zaś 1-oktanol jest mniej wyczuwalny i nadaje grzybom słodki owocowo-kwiatowy zapach (7, 8).
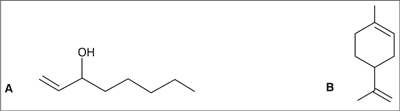
Ryc. 3. Budowa chemiczna 1-okten-3-olu (A) i limonenu (B).
W 2011 roku grupa rosyjskich badaczy wyizolowała i określiła strukturę głównego polisacharydu występującego w owocnikach P. betulinus – piptoporanu I (9). Jest to rozgałęziony glukan, którego szkielet zbudowany jest z reszt α-(1→3)-glukopiranozy podstawionej w pozycji C-6 przez pojedyncze reszty β-D-glukopiranozy. Taka struktura charakteryzuje glukany typu mieszanego, tzn. zawierające zarówno wiązania α, jak i β. Przeprowadzając reakcję piptoporanu I z czerwienią Kongo, po raz pierwszy wykazano, że glukany typu mieszanego nie mają struktury helikalnej.
N-glikany to związki, które są przyłączone do asparaginy w motywie Asn-Xxx-Ser (Thr), gdzie Xxx jest dowolnym aminokwasem z wyjątkiem proliny. Obecnie N-glikany budzą znaczne zainteresowanie, ze względu na ich obecność w wielu biofarmaceutykach. Istnieje wiele metod strukturalnej analizy tych związków, takich jak spektroskopia masowa, HPLC, elektroforeza, jednakże nie są one precyzyjne i szybkie. N-glikany uwolnione z glikoprotein zawierają izomery, a więc wymagają wcześniejszego rozfrakcjonowania przed masową analizą spektralną. Aby uniknąć tych problemów wykorzystuje się technikę mobilności jonowej. Metoda ta opiera się na kształcie oddzielanych cząsteczek i umożliwia wytworzenie pewnego odstępu pomiędzy izomerami w milisekundowym przedziale czasowym zamiast dziesiątek minut, które są typowe dla rozdzielania w fazie ciekłej. Technika mobilnych jonów została wykorzystana do zbadania ekstraktów P. betulinus trawionych endoglikozydazą H. W otrzymanym widmie dominowały oligomery heksozy, prawdopodobnie α-(1→3)-D-glukany. Uwolnione N-glikany wytworzyły jony o niskiej liczebności. Oligomery heksozy oraz jony N-glikanów powstałe z ekstrakcji mają różne linie trendu – większe związki są stosunkowo dobrze rozdzielone, chociaż pewne nakładanie odbywa się w dolnej części mas. Analiza składu wykazała, że główne piki N-glikanów składają się z serii Hex5-10HexNAc2 (9).
W ekstrakcie metanolowym z owocników P. betulinus wyodrębniono sześć kwasów triterpenowych typu lanostanu, m.in. kwasy poliporenowe A i C (ryc. 4), a także dwie pochodne kwasu poliporenowego A (10). Podczas poszukiwań związków odpowiedzialnych za działanie przeciwzapalne i hamujące aktywność hialuronidazy w ekstrakcie etylooctanowym zidentyfikowano kolejne triterpeny pochodne lanostanu: kwas 3α-acetylo-poliporenowy A oraz kwas (25S)-(+)-12α-hydroksy-3α-metylokarboksyacetylo-24-metylolanosta-8,24(31)-dien-26-owy (11).
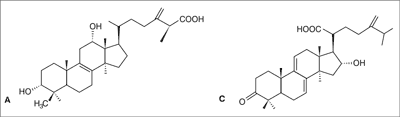
Ryc. 4. Budowa chemiczna kwasu poliporenowego A i kwasu poliporenowego C.
Innym związkiem o udowodnionym działaniu biologicznym zidentyfikowanym w ekstrakcie z P. betulinus jest (E)-2-(4-hydroksy-3-metylo-2-butenylo)-hydrochinon (ryc. 5) (12).

Ryc. 5. Budowa chemiczna pochodnej hydrochinonu (A) i piptaminy (B) wyizolowanych z P. betulinus.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Gumińska B, Wojewoda W. Grzyby i ich oznaczanie. PWRiL, Warszawa 1988. 2. Needham W. Fungus Notebook. Potomac Sporophore 2010; 25:6. 3. Wiater A, Paduch R, Pleszczynska M i wsp. Alpha-(1→3)-D-glucans from fruiting bodies of selected macromycetes fungi and the biological activity of their carboxymethylated products. Biotechnol Lett 2011; 33:787-95. 4. Reis FS, Pereira E, Barros L i wsp. Biomolecule profiles in inedible wild mushrooms with antioxidant value. Molecules 2011; 16:4328-38. 5. Poder R. The Ice Man’s fungi: Facts and mysteries. Int J Med Mushrooms 2005; 7:357-9. 6. Rosecke J, Pietsch M, Konig WA. Volatile constituents of wood-rotting basidiomycetes. Phytochem 2000; 54:747-50. 7. Rapior S, Cavaliè S, Andary, C i wsp. Investigation of some volatile components of seven fresh wild mushrooms (Basidiomycetes). J Essent Oil Res 1996; 8:199-201. 8. Breheret S, Talou T, Rapior S i wsp. Monoterpenes in the aromas of fresh wild mushrooms (Basidiomycetes). J Agric Food Chem 1997; 45:831-6. 9. Olennikov DN, Agafonova SV, Rokhin AV i wsp. Branched glucan from the bodies of Piptoporus betulinus (Bull.:Fr.) Karst. Prikl Biokhim Mikrobiol 2012; 48:74-80. 10. Kamo T, Asanoma M, Shibata H i wsp. Anti-inflammatory lanostane-type triterpene acids from Piptoporus betulinus. J Nat Prod 2003; 66:1104-6. 11. Wangun HV, Berg A, Hertel W i wsp. Anti-inflammatory and anti-hyaluronate lyase activities of lanostanoids from Piptoporus betulinus. J Antibiot 2004; 57:755-8. 12. Kawagishi H, Hamajima K, Inoue Y i wsp. Novel hydroquinone as a matrix metallo-proteinase inhibitor from the mushroom, Piptoporus betulinus. Biosci Biotechnol Biochem 2002; 66:2748-50. 13. Schlegel B, Luhmann U, Hartl A i wsp. Piptamine, a new antibiotic produced by Piptoporus betulinus Lu 9-1. J Antib 2000; 53:973-4. 14. Capasso L. 5300 years ago, The Ice Man used natural laxatives and antibiotics. Lancet 1998; 352:1864. 15. Peintner U, Pöder R, Pümpel T. The iceman’s fungi. Mycol Res 1998; 102:1153-62. 16. Lemieszek MK, Langer E, Kaczor J i wsp. Anticancer effect of fraction isolated from medicinal birch polypore mushroom, Piptoporus betulinus (Bull.: Fr.) P. Karst. (Aphyllophoromycetideae): In vitro studies. Int J Med Mushrooms 2009; 11:351-64. 17. Kaczor J, Klecha IM, Rzeski W i wsp. Extract from Piptoporus betulinus Bull. Fr. supress human tumor cell growth. Post Fitoter 2004; 2:62-6. 18. Shamtsyan M, Konusova V, Maksimova Y i wsp. Immunomodulating and anti-tumor action of extracts of several mushrooms. J Biotech 2004; 113:77-83. 19. Karaman M, Mimica-Dukic N, Knezevic P i wsp. Antibacterial properties of selected lignicolous mushrooms and fungi from Northern Serbia. Int J Med Mushrooms 2009; 11:269-79. 20. Suay I, Arenal F, Asensio FJ i wsp. Screening of Basidiomycetes for antimicrobial activities. Antonie Leeuwenhoek 2000; 78:129-39. 21. Keller C, Maillard M, Keller J i wsp. Screening of European fungi for antibacterial, antifungal, larvicidal, molluscicidal, antioxidant and free-radical scavenging activities and subsequent isolation of bioactive compounds. Pharma Biol 2002; 40:518-25. 22. Koch K, Witt S, Lindequist U. The influence of selected higher Basidiomycetes on the binding of lipopolysaccharide to CD14+ cells and on the release of cytokines. Int J Med Mushrooms 2002; 4:229-35. 23. Sułkowska-Ziaja K, Muszyńska B, Motyl P i wsp. Phenolic compounds and antioxidant activity in some species of polyporoid mushrooms from Poland. Int J Med Mushrooms 2012; 14:385-93. 24. Orhan I, Üstün O. Determination of total phenol content, antioxidant activity and acetylcholinesterase inhibition in selected mushrooms from Turkey. J Food Comp Anal 2011; 24:386-90. 25. Kandefer-Szerszen M, Kawecki Z. Ether extracts from the fruiting body of Piptoporus betulinus as interference inducers. Acta Microbiol Pol 1974; 6: 197-200. 26. Kandefer-Szerszen M, Kawecki Z, Guz M. Fungal nucleic acids as interferon inducers. Acta Microbiol Pol 1979; 28:277-91. 27. Kandefer-Szerszen M, Karpinska T, Kawecki Z. The influence of inhibitors of cellular synthesis and UV irradiation on interferon induction by RNA from Piptoporus betulinus. Arch Immunol Ther Exp 1982; 30:25-31. 28. Cyranka M, Graz M, Kaczor J i wsp. Investigation of antiproliferative effect of ether and ethanol extracts of birch polypore medicinal mushroom, Piptoporus betulinus (Bull.: Fr.) P. Karst. (higher Basidiomycetes) in vitro grown mycelium. Int J Med Mushrooms 2011; 13:525-33.





