Karolina Raczkowska-Łabuda, Anna Gorzelnik, Jolanta Jadczyszyn, *Lidia Zawadzka-Głos
HPV-zależne nowotwory głowy i szyi a 10 lat doświadczeń ze szczepionkami przeciwko wirusowi brodawczaka ludzkiego
HPV-related head and neck tumors – 10 years of experience with human papillomavirus vaccinations
Department of Pediatric Otolaryngology, Medical University of Warsaw, Poland
Head of Department: Associate Professor Lidia Zawadzka-Głos, MD, PhD
Streszczenie
W ostatnich latach obserwuje się w Europie dynamiczny wzrost zachorowań na nowotwory głowy i szyi. Co roku około 6000 osób w naszym kraju zostaje postawionych przed diagnozą patologicznego rozrostu w obrębie narządów głowy i szyi. Ryzyko zachorowania na nowotwory tej grupy zwiększa się u obu płci proporcjonalnie do wieku, ze szczytem około 64. r.ż. Prawidłowo postawiona diagnoza nowotworu głowy i szyi typowo ma miejsce w wieku między 45. a 64. r.ż.
W wielu krajach Europy, w tym i w Polsce, obserwowany jest tzw. „fenomen epidemiologiczny” czyli wzrost zapadalności na nowotwory głowy i szyi u osób poniżej 40. r.ż., które nigdy nie paliły i nie nadużywały alkoholu. Zmienił się profil pacjenta z nowotworem głowy i szyi.
Szacuje się, że ponad 90% mężczyzn i 80% kobiet będzie zainfekowanych przynajmniej jednym typem wirusa HPV w trakcie swojego życia. Połowę tych infekcji wywołają typy onkogenne. Typ 16 wirusa odpowiada za 90% infekcji wysokiego ryzyka i podnosi prawdopodobieństwo wystąpienia nowotworu jamy ustnej i gardła zależnych od wirusa brodawczaka ludzkiego nawet 15 do 230 razy. W obliczu odmienności przebiegu i rokowania u chorych ze zmianą związaną z wirusem brodawczaka ludzkiego wyłączono nowotwory głowy i szyi HPV-zależne z dotychczasowego systemu stagingu TNM (ang. tumor, nodes, metastasis) i utworzono odrębną grupę uwzględniającą jedynie zmiany tego typu.
Szczepionki przeciwko HPV to jeden z najważniejszych kroków w prewencji nowotworowej ostatnich kilku dekad. W Polsce dostępne są 3 różne preparaty ujęte jako dodatkowe w PSO.
Summary
In the recent years, there has been a rapid increase in the incidence of head and neck cancers in Europe. Every year, 6,000 persons in Poland are diagnosed with a neoplastic proliferative disease in the head and neck region. The risk of cancer of this group increases with age in both genders, with a peak incidence around the age of 64. A diagnosis of a head and neck tumor typically occurs between the age of 45 and 64.
In many European countries, including Poland, the so-called “epidemiological phenomenon” is observed. Epidemiological phenomenon consists in an increasing incidence of head and neck cancers in persons under 40 years of age who had never smoked or abused alcohol. The profile of patient with head and neck cancer has changed.
It is estimated that over 90% of men and 80% of women will be infected with at least one type of HPV in their lifetime. Half of the infections are caused by the oncogenic types. HPV type 16 is responsible for 90% of high-risk infections and increases the likelihood of human papillomavirus-related oropharyngeal cancers by 15 to 230 times, depending on the type of the virus. In the view of the differences in course and prognosis in patients with HPV-related cancers, these tumors have been excluded from the existing TNM staging system (tumor, nodes, metastasis), and a separate classification, only for this group of tumors, was created.
HPV vaccines have been one of the most important steps in cancer prevention in the last few decades. In Poland, 3 different vaccines are included in the National Vaccination Program as recommended, but they are not reimbursed by the State.
Wstęp
W ostatnich latach obserwuje się w Europie dynamiczny wzrost zachorowań na nowotwory głowy i szyi. Polska nie stanowi wyjątku w tym zestawieniu. Co roku około 6000 osób w naszym kraju zostaje postawionych przed diagnozą rozrostu nowotworowego w obrębie narządów głowy i szyi, które globalnie charakteryzują się niekorzystnym rokowaniem (1). Ryzyko zachorowania na nowotwory tej grupy zwiększa się u obu płci proporcjonalnie do wieku, ze szczytem około 64. r.ż. Prawidłowo postawiona diagnoza nowotworu głowy i szyi zazwyczaj ma miejsce w wieku między 45. a 64. r.ż. (1, 2).
Niemniej ostatnio w wielu krajach Europy, w tym i w Polsce, obserwuje się tzw. „fenomen epidemiologiczny” czyli wzrost zapadalności na nowotwory głowy i szyi u osób poniżej 40. r.ż., którzy nigdy nie palili i nie nadużywali alkoholu (2, 3). W tych przypadkach wykazano bezsprzeczny związek z infekcją wirusem brodawczaka ludzkiego (ang. human papilloma virus – wirus brodawczaka ludzkiego) (2, 3).
Epidemiologia
Zgodnie z aktualnymi danymi Krajowego Rejestru Nowotworów, nowotwory w obrębie głowy i szyi (tj. jednostki odpowiadające kodom ICD-10 C00-C15, C30-C33, C69 oraz C73) stanowiły w 2012 roku 9% wszystkich nowotworów rozpoznanych u mężczyzn oraz 5% nowotworów rozpoznanych u kobiet (1). Specjalistom z zakresu leczenia tych nowotworów powyższe statystyki wydają się zaniżone (4). Dane WHO pokazują, iż każdego roku rozpoznaje się na świecie 550 000 nowych zachorowań na nowotwory jamy ustnej i gardła oraz 160 000 nowych przypadków nowotworów krtani. Szacuje się, że rocznie na nowotwory głowy i szyi umiera około 400 000 osób na świecie (2-6).
Epidemia HPV?
W większości krajów świata obserwowany jest spadek liczby nowych przypadków zachorowania na nowotwory jamy ustnej, krtani i gardła dolnego, silnie związany ze spadkiem spożycia produktów branży tytoniowej. Niestety równolegle na przestrzeni ostatnich 20-30 lat zanotowano wzrost zachorowań na nowotwory gardła środkowego (przede wszystkim migdałków podniebiennych, trzonu języka i podniebienia miękkiego). Taki stan rzeczy potwierdzają dane statystyczne z Australii (7), Kanadzie (8), Danii (9), Norwegii (10), Szwecji (11), Holandii (12), Stanów Zjednoczonych (13) i Wielkiej Brytanii (14). Analiza rozdźwięku częstotliwości zachorowań na nowotwory głowy i szyi w tych dwóch lokalizacjach przyczyniła się do ustalenia związku pomiędzy zmianami w obrębie gardła a infekcją wirusem brodawczaka ludzkiego (15). Obecnie szacuje się, iż prawie 70% nowotworów gardła zależnych jest od HPV (16, 17).
Profil pacjenta z nowotworem głowy i szyi HPV-zależnym
W związku z powyższym zmienił się również profil pacjenta z nowotworem głowy i szyi. Najwięcej danych klinicznych na ten temat zebrano w analizie ICON-S (ang. Collaboration on Oropharyngeal Cancer Network for Staging) (18). Badaniem objęto 1907 osób z HPV-zależną zmianą w obrębie jamy ustnej i gardła oraz 696 pacjentów z płaskokomórkowym nowotworem głowy i szyi niezwiązanym z wirusem brodawczaka ludzkiego. Wykazano, że typowy chory zdiagnozowany w kierunku HPV-zależnej zmiany to młody mężczyzna rasy kaukaskiej (zaobserwowano dwuszczytowy charakter zależności występowania nowotworu od wieku – 30 i 55 lat). Wśród pacjentów z nowotworami głowy i szyi HPV-zależnymi 84% stanowią mężczyźni, natomiast w przypadku nowotworów głowy i szyi HPV-niezależnych odsetek mężczyzn wynosi 76%. Typowy pacjent nie jest uzależniony od tytoniu ani alkoholu (spożywa alkohol jedynie sporadycznie), natomiast znaczny odsetek chorych zażywa marihuanę. Powyższe spostrzeżenie nie zmienia faktu, iż palenie tytoniu dodatkowo zwiększa ryzyko infekcji wirusem brodawczaka ludzkiego (19). Chorzy to osoby o większej ogólnej liczbie partnerów seksualnych (> 9) oraz partnerów do seksu oralnego (> 4) w porównaniu z HPV-ujemnymi badanymi (20). Najdokładniejsze dane dotyczące rasy, pochodzenia etnicznego czy płci u chorego na HPV-zależne nowotwory głowy i szyi pochodzą ze Stanów Zjednoczonych (ryc. 1) (21).
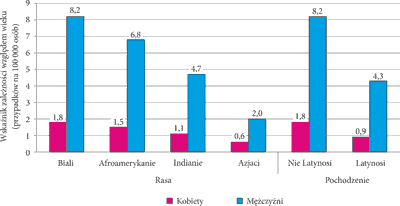
Ryc. 1. Charakterystyka etniczna pacjentów z HPV-zależnym nowotworem głowy i szyi (21)
Typy wirusa brodawczaka ludzkiego w nowotworach laryngologicznych
Na dzień dzisiejszy szacuje się, że ponad 90% mężczyzn i 80% kobiet będzie zainfekowanych przynajmniej jednym typem wirusa HPV w trakcie swojego życia (22-24). Połowę tych infekcji wywołają typy onkogenne (22-24). Typ 16 wirusa odpowiada za 90% infekcji wysokiego ryzyka i podnosi prawdopodobieństwo wystąpienia nowotworu jamy ustnej i gardła zależnych od wirusa brodawczaka ludzkiego nawet 15 do 230 razy (18, 25). Obecnie nie istnieje skuteczna metoda leczenia aktywnej infekcji HPV, a przebieg zakażenia jest bezobjawowy i w większości przypadków samoograniczający się – wyleczenie następuje w przeciągu 1 do 2 lat. Osoby zakażone nieświadomie przekazują patogen swoim partnerom. Dodatkowo zmiany w obrębie głowy i szyi, ze względu na swoje umiejscowienie, rozwijają się skrycie i wywołują objawy niecharakterystyczne, typowe dla banalnych infekcji górnych dróg oddechowych (ból gardła, ból podczas przełykania, chrypka) (2, 4). Ponadto nie istnieje skuteczna metoda skriningowa dla nowotworów głowy i szyi zależnych od HPV. Wymazy, które doskonale sprawdzają się dla takich narządów jak szyjka macicy czy odbyt, są bardzo trudne do uzyskania w diagnostyce zmian głowy i szyi. Należałoby pobrać materiał z głębokich krypt migdałków podniebiennych, co obarczone jest zbyt wysokim ryzykiem nieprawidłowego pozyskania próbki i wyników fałszywie ujemnych (18).
Szczepienia przeciwko HPV w walce z nowotworem
Przytoczone do tej pory dane podkreślają istotną rolę szczepień przeciwko HPV w profilaktyce nowotworów głowy i szyi. Wstępny raport NHANES (ang. National Health and Nutrition Examination Survey) potwierdza powyższe stwierdzenie (26). Badaniu poddano 2627 osób w wieku od 18 do 33 lat. Średnio 4 lata po szczepieniu przeciwko HPV (preparatem 4-walentnym, aktywnym przeciwko wirusom typu 6, 11, 16 i 18) pobrano od badanych materiał z popłuczyn jamy ustnej, który przeanalizowano pod kątem obecności wirusa brodawczaka ludzkiego. Aktywną infekcję wirusem HPV typu 6, 11, 16 lub 18 wykryto u 0,11% badanych, którzy otrzymali przynajmniej jedną dawkę szczepionki i u 1,61% osób nieszczepionych (p = 0,008). Różnica między grupami odpowiada redukcji częstości infekcji tymi typami wirusa o 88,2%. Równocześnie wykazano, że 33 inne typy HPV, których szczepionka nie obejmowała, występowały w obu grupach ze zbliżoną częstością: 3,98% vs. 4,74% (p = 0,24) (26).
Cytując dr hab. n. med. Maurę L. Gillison: „Szczepionki przeciwko HPV to jeden z najważniejszych kroków w prewencji nowotworowej ostatnich kilku dekad. Rodzice, którzy decydują się zaszczepić swoje dzieci przeciwko wirusowi brodawczaka ludzkiego powinni zdawać sobie sprawę z dodatkowej korzyści w postaci ochrony przed nowotworami jamy ustnej i gardła” (27).
Diagnostyka
Wyniki leczenia chorych z nowotworami głowy i szyi w Polsce są wysoce niezadowalające. Związane jest to m.in. ze znacznym zaawansowaniem narządowym choroby nowotworowej w momencie diagnozy, co z kolei jest konsekwencją braku odpowiednich badań skriningowych i algorytmów diagnostycznych (2, 3). Prawie 90% pacjentów w chwili rozpoznania prezentuje niebolesną zmianę szyi (28). U niektórych chorych w badaniu laryngologicznym trudno jest wskazać miejsce wyjścia nowotworu ze względu na małe rozmiary guza, a powiększone węzły chłonne bardzo często mają charakter torbielowaty, co skutkuje niediagnostycznymi aspiratami w biopsji. Wymienia się kilka przyczyn opóźnionej diagnozy:
– brak czujności onkologicznej ze względu na ujemny wywiad w kierunku uzależnienia od tytoniu;
– brak objawów podmiotowych i przedmiotowych we wczesnej fazie choroby;
– nieodpowiednie badanie jamy ustnej i gardła ze względu na niedostatki wiedzy i sprzętowe;
– małe rozmiary guza – poniżej punktu wychwytu w diagnostyce obrazowej;
– niska czułość biopsji aspiracyjnej z węzłów chłonnych;
– losowość doboru miejsc śródoperacyjnych biopsji (29).
Na dzień dzisiejszy złotym standardem w diagnostyce infekcji HPV jest hybrydyzacja in situ lub PCR wykrywające DNA wirusowe. Niemniej w praktyce klinicznej powszechne jest posiłkowanie się immunohistochemicznym oznaczeniem ekspresji białka p16 czy real-time PCR do określenia skali wiremii wirusem typu 16.
Białko p16 funkcjonuje jako supresor guza poprzez wiązanie cykliny D1 (kompleks CDK4/CDK6), co zapobiega fosforylacji białka Rb. W przypadku raków HPV-zależnych obserwuje się nadekspresję tego białka. Jest to wskaźnik o wysokiej czułości – wyniki fałszywie ujemne nie przekraczają 4% (30). Wysoka jądrowa i cytoplazmatyczna ekspresja p16 silnie wskazuje na HPV-zależny nowotwór. W przypadku wyników na średnio bądź słabo dodatnich wskazane jest wykonanie ISH (hybrydyzacji in situ) lub RT-PCR (ang. real-time PCR) (30). Ponadto wysokie miano p16 w HPV-zależnych nowotworach wiąże się z lepszym rokowaniem (31). Przy badaniu ekspresji p16 należy jednak uwzględnić możliwość otrzymania wyników fałszywie dodatnich, ponieważ nie jest to specyficzny marker infekcji wirusem brodawczaka ludzkiego, ponadto występuje w 5-8% nowotworów głowy i szyi HPV-niezależnych (32).
Rokowanie
Istnieje wiele doniesień w literaturze potwierdzających lepsze rokowania u chorych ze zmianą HPV-zależną względem pacjentów z nowotworem głowy i szyi bez związku z wirusem brodawczaka ludzkiego (33-36). Spostrzeżenie to pozostaje prawdziwe nawet w przypadkach nawrotu choroby czy zaawansowanego stadium nowotworu. Retrospektywna analiza na dużej grupie pacjentów wykazała, że ogólny wskaźnik 3-letniego przeżycia dla pacjentów z nowotworem głowy i szyi wynosił 82,4% dla chorych ze zmianą HPV-zależną względem 57,1% u chorych z innym nowotworem głowy i szyi. Wskaźnik 3-letniego okresu wolnego od progresji choroby wynosił odpowiednio 73,7% względem 43,4%. Przekłada się to na zmniejszenie ryzyka zgonu o 58% i progresji o 51% (37).
Skala cTNM i pTNM
W obliczu odmienności przebiegu i rokowania u chorych ze zmianą związaną z wirusem brodawczaka ludzkiego zaopiniowano konieczność wyłączenia Nowotworów Głowy i Szyi HPV- zależnych z dotychczasowego systemu stagingu TNM (ang. tumor, nodes, metastasis) i utworzenia odrębnej grupy uwzględniającej jedynie zmiany tego typu (8-18).
Ósma edycja TNM staging system stworzona przez UICC (ang. Union for International Cancer Control) i AJCC (ang. American Joint Committee on Cancer) w 2017 roku wyodrębniła HPV-zależne nowotwory jamy ustnej i gardła (tab. 1, 2) (38, 39).
Tab. 1. TNM kliniczny dla nowotworów głowy i szyi HPV-zależnych
| Staging kliniczny TNM HPV-zależnego raka gardła środkowego AJCC UICC 2017 |
| Wielkość guza pierwotnego (T) |
| Kategoria T | Kryteria |
| T0 | Nie zidentyfikowano guza pierwotnego |
| T1 | Guz pierwotny o wielkości 2 cm lub mniejszy w największym wymiarze |
| T2 | Guz pierwotny o wielkości większej niż 2 cm, ale nie większej niż 4 cm w największym wymiarze |
| T3 | Guz pierwotny o wielkości większej niż 4 cm w największym wymiarze lub naciekający językową powierzchnię głośni |
| T4 | Guz pierwotny miejscowo zaawansowany.
Guz naciekający krtań, zewnętrzne mięśnie języka, mięsień skrzydłowy przyśrodkowy, podniebienie twarde, żuchwę lub dalej. |
| Przerzuty w regionalnych węzłach chłonnych – ocena kliniczna (cN) |
| Kategoria N | Kryteria |
| NX | Nie można ocenić regionalnych węzłów chłonnych |
| N0 | Regionalne węzły chłonne bez przerzutów |
| N1 | Jeden lub więcej przerzutów w ipsilateralnych węzłach chłonnych, żaden nie większy niż 6 cm |
| N2 | Jeden lub więcej przerzutów w kontrlateralnych lub obustronnych węzłach chłonnych, żaden nie większy niż 6 cm |
| N3 | Węzły chłonne większe niż 6 cm |
| Przerzuty odległe (M) |
| Kategoria M | Kryteria |
| M0 | Brak przerzutów odległych |
| M1 | Występują przerzuty odległe |
| Zaawansowanie choroby – ocena kliniczna |
| Kiedy T to... | i N to... | i M to... | wtedy zaawansowanie kliniczne... |
| T0, T1 lub T2 | N0 lub N1 | M0 | I |
| T0, T1 lub T2 | N2 | M0 | II |
| T3 | N0, N1, lub N2 | M0 | II |
| T0, T1, T2, T3 lub T4 | N3 | M0 | III |
| T4 | N0, N1, N2, lub N3 | M0 | III |
| Każde T | Każde N | M1 | IV |
Tab. 2. TNM histopatologiczny dla nowotworów głowy i szyi HPV-zależnych
| HPV related oropharyngeal carcinoma TNM clinical staging AJCC UICC 2017 |
| Wielkość guza pierwotnego (T) |
| Kategoria T | Kryteria |
| T0 | Nie zidentyfikowano guza pierwotnego |
| T1 | Guz pierwotny o wielkości 2 cm lub mniejszy w największym wymiarze |
| T2 | Guz pierwotny o wielkości większej niż 2 cm, ale nie większej niż 4 cm w największym wymiarze |
| T3 | Guz pierwotny o wielkości większej niż 4 cm w największym wymiarze lub naciekający językową powierzchnię głośni |
| T4 | Guz pierwotny miejscowo zaawansowany.
Guz naciekający krtań, zewnętrzne mięśnie języka, mięsień skrzydłowy przyśrodkowy, podniebienie twarde, żuchwę lub dalej. |
| Przerzuty w regionalnych węzłach chłonnych – ocena kliniczna (cN) |
| Kategoria N | Kryteria |
| NX | Nie można ocenić regionalnych węzłów chłonnych |
| pN0 | Regionalne węzły chłonne bez przerzutów |
| pN1 | Przerzuty w czterech lub mniej węzłów chłonnych |
| pN2 | Przerzuty w ponad czterech węzłach chłonnych |
| Przerzuty odległe (M) |
| Kategoria M | Kryteria |
| M0 | Brak przerzutów odległych |
| M1 | Występują przerzuty odległe |
| Zaawansowanie choroby – ocena histopatologiczna |
| Kiedy T jest... | i N jest... | i M jest... | wtedy zaawansowanie kliniczne... |
| T0, T1, lub T2 | N0 lub N1 | M0 | I |
| T0, T1, lub T2 | N2 | M0 | II |
| T3 lub T4 | N0, N1 | M0 | II |
| T3 lub T4 | N2 | M0 | III |
| Każde T | Każde N | M1 | IV |
Leczenie
Wyodrębnienie tej grupy nowotworów z dotychczasowej klasyfikacji stanowi olbrzymi postęp, lecz nie pociąga za sobą zmian w schematach leczenia. Algorytmy postępowania u chorych z nowotworami w obrębie głowy i szyi są identyczne dla pacjentów ze zmianą HPV-zależną i niezależną. Aktualne wytyczne obejmują podejście multimodalne: chemioterapię (ChT), radioterapię (RT) i chirurgię. Długoterminowe efekty takiego leczenia niosą ze sobą komplikacje w postaci zapalenia śluzówki, dysfagii, zwłóknienia tkanek miękkich w naświetlanym polu, xerostomii czy problemów dentystycznych. Trwają badania dotyczące deintensyfikacji RT i/lub ChT. Wieloośrodkowa analiza grupy ECOG 1308 (ang. Eastern Cooperative Oncology Group) przeprowadzona na 80 pacjentach porównywała skuteczność mniejszej dawki RT (54 Gy w 27 frakcjach) u pacjentów w stadium III lub IVA nowotworu jamy ustnej i gardła HPV-zależnego. Wyjściowo chorzy otrzymali ChT indukcyjną w postaci trzech cykli cisplatyny, paklitakselu i cetuksymabu. Niższe dawki RT zaproponowano jedynie pacjentom z pełną, kliniczną odpowiedzią na indukcyjną chemioterapię – 56 osób. 51 z 56 chorych kontynuowało chemioterapię cetuksymabem łącznie z radioterapią 54 Gy. Pozostali otrzymali 69,3 Gy w 33 frakcjach. W obu przypadkach dołączono cotygodniową dawką cetuksymabu. Wśród pacjentów z pełną odpowiedzią na indukcyjną ChT uzyskano 2-letni okres wolny od progresji u 80% chorych. W tej samej grupie 2-letnie przeżycie wyniosło 94% (40). Niemniej, jak zauważył Beitler podczas eksperckiej debaty w Sea Island w 2015 roku, E1308 nie osiągnął założonego celu w postaci okresu wolnego od choroby wynoszącego powyżej 2 lat (40).
Największe nadzieje związane z optymalizacją terapii pacjentów z HPV-zależnym nowotworem głowy i szyi pokładane są w dwóch analizach: ECOG 3311 oraz NRG HN002 (41, 42). Obecnie zmniejszenie intensywności leczenia to krok w nieznane i obawa przed pogorszeniem doskonałych prognoz przeżycia możliwych przy utrzymaniu dotychczasowych standardów terapii. Dalsze wieloośrodkowe badania są niezbędne w celu wypracowania konsensusu dotyczącego nowych wytycznych leczenia.
Wnioski
W świetle powyższych informacji, rola populacyjnych szczepień przeciwko HPV w prewencji nowotworów głowy i szyi wydaje się konstytutywna. Nie istnieje skuteczna metoda skriningowa, nie ma także zgody względem algorytmu leczenia, ale dysponujemy szczepionką o rewelacyjnej skuteczności. Stąd konieczność immunizacji przedekspozycyjnej zarówno dziewcząt, jak i chłopców.
Kraje, w których wprowadzono populacyjne programy szczepień przeciwko HPV, koncentrują się na uzyskaniu jak najwyższego odsetka osób zaszczepionych, popularyzacji wiedzy na temat masowej skali infekcji wywołanych przez wirusa brodawczaka ludzkiego oraz nagłośnieniu niezaprzeczalnych korzyści wynikających z immunizacji młodzieży.
W Polsce przegraliśmy batalię o włączenie szczepionki przeciwko HPV do PSO w 2017 roku. Nie istnieje ogólnokrajowy rejestr nowotworów głowy i szyi HPV-zależnych, a wyniki leczenia są niezadawalające.
Piśmiennictwo
1. Krajowy Rejestr Nowotworów. Głowa i szyja; http://onkologia.org.pl/nowotwory-narzadow-glowy-i-szyi/ (accessed 21.08.2017).
2. Program profilaktyki nowotworów głowy i szyi. Epidemiologia; http://www.pngs.wco.pl/epidemiologia/ (accesed 21.08.2017).
3. Od 5 lat edukują o nowotworach głowy i szyi. Gazeta Lekarska; http://www. gazetalekarska.pl/?p=36092.
4. Golusiński W: I Ogólnopolski Program Profilaktyki Nowotworów Głowy i Szyi. Świat Lekarza; http://swiatlekarza.pl/ogolnopolski-program-profilaktyki-nowotworow-glowy-szyi/.
5. Ferlay J, Soerjomataram I, Dikshit R et al.: Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136: E359-E386.
6. Jemal A, Bray F, Center MM et al.: Global cancer statistics. CA Cancer J Clin 2011; 61(2): 69-90.
7. Hong AM, Grulich AE, Jones D et al.: Squamous cell carcinoma of the oropharynx in Australian males induced by human papillomavirus vaccine targets. Vaccine 2010; 28: 3269- 3272.
8. Auluck A, Hislop G, Bajdik C et al.: Trends in oropharyngeal and oral cavity cancer incidence of human papillomavirus (HPV)-related and HPV-unrelated sites in a multicultural population: The British Columbia experience. Cancer 2010: 116: 2635-2644.
9. Blomberg M, Nielsen A, Munk C et al.: Trends in head and neck cancer incidence in Denmark, 1978-2007: Focus on human papillomavirus associated sites. Int J Cancer 2011; 129: 733-741.
10. Mork J, Møller B, Dahl T et al.: Time trends in pharyngeal cancer incidence in Norway 1981-2005: A subsite analysis based on a reabstraction and recoding of registered cases. Cancer Causes Control 2010; 21: 1397-1405.
11. Hammarstedt L, Lindquist D, Dahlstrand H et al.: Human papillomavirus as a risk factor for the increase in incidence of tonsillar cancer. Int J Cancer 2006; 119: 2620-2623.
12. Braakhuis BJ, Visser O, Leemans CR: Oral and oropharyngeal cancer in the Netherlands between 1989 and 2006: Increasing incidence, but not in young adults. Oral Oncol 2009; 45: e85-e89.
13. Chaturvedi AK, Engels EA, Anderson W et al.: Incidence trends for human papillomavirus-related and -unrelated oral squamous cell carcinomas in the United States. J Clin Oncol 2008; 26: 612-619.
14. Reddy VM, Cundall-Curry D, Bridger MW: Trends in the incidence rates of tonsil and base of tongue cancer in England, 1985-2006. Ann R Coll Surg Engl 2010; 92: 655-659.
15. Chaturvedi AK, Engels EA, Pfeiffer RM et al.: Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 2011; 29: 4294-4301.
16. Mehanna H, Beech T, Nicholson T et al.: Prevalence of human papillomavirus in oropharyngeal and nonoropharyngeal head and neck cancer – systematic review and meta-analysis of trends by time and region. Head Neck 2013; 35: 747-755.
17. Gillison ML, D’Souza G, Westra W et al.: Distinct risk factors profiles for human papillomavirus type 16-positive and human papillomavirus type 16-negative head and neck cancers. J Natl Cancer Inst 2008; 100: 407-420.
18. O’Sullivan B, Huang SH, Su J et al.: Development and validation of staging system for HPV-related oropharyngeal cancer by the International Collaboration on Oropharyngeal cancer Network for Staging (ICON-S): a multicenter cohort study. Lancet Oncol 2016; 17: 440.
19. Gillison ML, Broutian T, Pickard RK et al.: Prevelance of oral HPV infection in the United States 2009-2010. JAMA 2012; 307: 693-703.
20. Dahlstrom KR, Li G, Tortolero-Luna G et al.: Differences in history of sexual behavior between patients with oropharyngeal squamous cell carcinoma and patients with squamosus cell carcinoma at other head and neck sites. Head Neck 2011; 33(6): 847-855.
21. Viens LJ, Henley SJ, Watson M et al.: Human papillomavirus-associated cancers – United States, 2008-2012. MMWR 2016; 65(26): 661-666.
22. Chesson HW, Dunne EF, Hariri S, Markowitz LE: The estimated lifetime probability of acquiring human papillomavirus in the United States. STD 2014; 41(11): 660-664.
23. Hariri S, Unger ER, Sternberg M et al.: Prevalence of genital human papillomavirus among females in the United States, the National Health and Nutrition Examination Survey, 2003-2006. J Infect Dis 2011; 204(4): 566-573.
24. Raczkowska-Łabuda K, Gorzelnik A, Zawadzka-Głos L: Why is a laryngologist interested in cervical cancer? Summary information about HPV vaccination. New Med 2017; 21(3): 84-93.
25. D’Souza G, Gross ND, Pai SI et al.: Oral human papillomavirus (HPV) infection in HPV-positive patients with oropharyngeal cancer and their partners. J Clin Oncol 2014; 32: 2408-2415.
26. Gillison ML, Broutian T, Graubard B et al.: Impact of HPV vaccination on oral HPV infections among young adults in the US. American Society of Clinical Oncology annual meeting. 2017.
27. Harris J: Vaccination Reduces Oral HPV Infections by 90%. Oncology Nursing News; http://www.oncnursingnews.com/web-exclusives/vaccination-reduces-oral-hpv-infections-by-90 (accessed 21.08.2017).
28. Garde SA, Kies MS, Morrison WH et al.: Outcomes and patterns of care of patients with locally advanced oropharyngeal carcinoma treated in the early 21st century. Radiat Oncol 2013; 8: 21.
29. Lewis A, Kang R, Levine A, Maghami E: The New Face of Head and Neck Cancer: The HPV Epidemic. Cancer Network; https: //www.cancernetwork.com (accessed 01.08.2017).
30. Lewis JS: P16 Immunohistochemistry as a standalone test for risk stratification in oropharyngeal squamous cell carcinoma. Head Neck Pathol 2012; 6(suppl. 1): S75-S82.
31. Weinberger PM, Yu Z, Haffty BG et al.: Molecular classification identifies a subset of human papillomavirus- associated oropharyngeal cancers with favorable prognosis. J Clin Oncol 2006; 24: 736.
32. Liang C, Marsit CJ, McClean MD et al.: Biomarkers of HPV in head and neck squamous cell carcinoma. Cancer Res 2012; 72(19): 5004-5013.
33. Fakhry C, Westra WH, Li S et al.: Improved survival of patients with human papillomavirus-positive head and neck squamous cell carcinoma in a prospective clinical trial. J Natl Cancer Inst 2008; 100(4): 261-269.
34. Rischin D, Young RJ, Fisher R et al.: Prognostic significance of p16INK4A and human papillomavirus in patients with oropharyngeal cancer treated on TROG 02.02 phase III trial. J Clin Oncol 2010; 28: 4142-4148.
35. Rich JT, Milov S, Lewis JS et al.: Transoral laser microsurgery (TLM) +/- adjuvant therapy for advanced stage oropharyngeal cancer: outcomes and prognostic factors. Laryngoscope 2009; 119: 1709-1719.
36. National Comprehensive Cancer Network. Head and neck cancers; http://www.nccn.org/professionals/physician_gls/pdf/head-and-neck.pdf (accessed 15.03.2017).
37. Ang KK, Harris J, Wheeler R et al.: Human papillomavirus and survival of patients with oropharyngeal cancer. NEJM 2010; 363: 24-35.
38. Lydiatt WM, Ridge JA, Patel SG et al.: Oropharynx (p16-) and Hypopharynx. In: AJCC Cancer Staging Manual. 8th ed. New York: Springer; 2017. 123.
39. O’Sullivan B, Lydiatt WM, Haughey BH et al.: HPV-Mediated (p16+) Oropharyngeal Cancer. In: AJCC Cancer Staging Manual. 8th ed. New York: Springer; 2017. 123.
40. Helwick C: HPV-Positive Head and Neck Cancer: When Can Chemotherapy Be Omitted? The Asco Post; http://www.ascopost.com/issues/september-25-2015/hpv-positive-head-and-neck-cancer-when-can-chemotherapy-be-omitted/ (accessed 21.08.2017).
41. Marur S, Li S, Cmelak AJ et al.: E1308: Phase II trial of induction chemotherapy followed by reduced-dose radiation and weekly cetuximab in patients with HPV-associated resectable squamous cell carcinoma of the oropharynx – ECOG-ACRIN Cancer Research Group. J Clin Oncol 2017: 35: 490-497.
42. NRG-HN002: A randomized phase II trial for patients with p16 positive, non-smoking associated, locoregionally advanced oropharyngeal cancer; https://www.nrgoncology.org/Clinical-Trials/NRG-HN002.
